2. 全军肝胆外科研究所
2. Institute of Hepatobiliary Surgery, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
近年来中枢神经系统脱髓鞘疾病,如多发性硬化(multiplesclerosis,MS),在国内外均有发病率上升的趋势[1]。由于其病程长,易复发,累及部位多,神经功能缺损大,导致患者身心受到巨大损害,极易引起情感障碍,尤以发病后的焦虑、抑郁障碍最多见[2-3]。抑郁、焦虑可显著降低 MS患者的生活质量,并影响其对治疗的依从性及预后[4],是我国乃至世界精神病防治工作和科研工作中的一个重要课题。大量实验研究表明[5-6],抑郁症和焦虑症多与中枢神经递质去甲肾上腺素和五羟色胺的功能紊乱有关,且血清神经递质的浓度与脑组织中神经递质的浓度呈高度正相关。
在中枢神经系统,少突胶质细胞形成包裹轴突的髓鞘[7],其具有加快神经传递速度、绝缘及营养等作用。研究表明由少突胶质细胞崩解死亡所引发的髓鞘脱失与许多神经及精神疾病的发生关系密切[8-9]。双环己酮草酰二腙(cuprizone,CPZ) 是一种铜离子螯合剂,可靶向性损伤少突胶质细胞诱导大脑多个脑区出现可修复的脱髓鞘病变[10-11]。因此,该动物模型尤其适合于髓鞘脱失及再生的实验研究[12]。本实验主要通过观察CPZ诱导的脱髓鞘模型小鼠的行为学及血清神经递质的变化,探究髓鞘脱失和再生过程中情绪的变化及其原因。
1 材料与方法 1.1 实验动物和主要试剂 1.1.1 动物分组8周龄C57BL/6小鼠36只,雄性,体质量18~22 g,由第三军医大学实验动物中心提供,分为正常对照组、慢性脱髓鞘组及髓鞘修复组,每组12只。
1.1.2 主要试剂NE、DA、5-HT、E、5-HIAA和DOPAC的标准品,十烷基磺酸钠(OSA)以及CPZ和LFB均购自Sigma公司;MBP大鼠抗小鼠单克隆抗体购自Abcam公司;GFAP兔抗鼠多克隆抗体购自Dako公司;Alexa Fluor 488-conjugated驴抗大鼠二抗、Alexa Fluor 594驴抗兔二抗购自Jackson公司;DAPI染液及一抗抗体稀释液购自北京中杉金桥公司;甲醇和乙腈(购自TEDIA公司);小鼠五羟色胺(5-HT)和去甲肾上腺素(NE)酶联免疫吸附(ELISA)测定试剂盒购自厦门慧嘉生物科技有限公司。
1.2 标本采集 1.2.1 光学显微镜样品制备每组取3只小鼠,麻醉小鼠,从左心室插入针头至主动脉,用37 ℃生理盐水灌注,再用4%多聚甲醛固定液滴注,取脑组织置于固定液中进行后固定,30%蔗糖磷酸盐溶液脱水,脱水完全后进行冰冻切片,切片厚度为20 μm,脑组织切片置于冰冻切片保护液中-20 ℃保存待用。
1.2.2 透射电镜样品制备每组取3只小鼠用于电镜观察,将小鼠迅速取脑后置于2.5%戊二醛中固定24 h后,镜下分离胼胝体区域并切成1 mm3小块,漂洗后用1%锇酸固定;常规漂洗后进行丙酮梯度脱水,环氧树脂包埋,半薄切片定位后,进行超薄切片,铅铀双染;透射电子显微镜(TECNAI10,FEI公司)观察胼胝体区域髓鞘的超微结构。
1.2.3 动物血清标本的采集每组取6只小鼠,麻醉后打开腹腔,腹主动脉抽取全血约800 μL于促凝管中,血标本于室温静置20 min,低温离心机离心处理 (3 000 r/min,10 min),收集上层血清标本,置于-80 ℃ 保存待用。
1.3 实验方法 1.3.1 实验动物模型的制备正常对照组小鼠采 用正常饲料饲养14周;慢性脱髓鞘组用含有0.2%CPZ粉末的饲料饲养14周;髓鞘修复组用含有0.2%CPZ粉末的饲料饲养12周后,换用正常饲料饲养2周。
1.3.2 体质量检测和行为学实验方法 1.3.2.1 体质量检测从建立慢性脱髓鞘模型开始,每周进行2次体质量检测并记录,绘制成曲线。
1.3.2.2 旷场实验应用旷场实验设备(XR-XZ301,上海欣软信息科技公司)记录小鼠在旷场中20 min 内的自由活动情况,然后用实时分析软件分析其运动的总路程、中央路程、中央时间等。
1.3.2.3 高架十字迷宫实验采用高架十字迷宫(XR-XG201,上海欣软信息科技公司)记录5 min内的进入各臂的次数和停留时间。实验过程应用监测分析系统检测并分析。计算开臂内滞留时间百分比(%)和开臂进入次数百分比(%)作为评判焦虑的指标。
1.3.2.4 悬尾实验小鼠尾部末端1.5 cm处固定悬挂于悬尾仪器的金属环上,记录6 min内第2~6 min 处于静止的总时间作为评判抑郁的指标。
1.3.3 卢卡斯快蓝(LFB)染色配制0.01%的LFB染液,选相同平面的脑组织切片,漂洗捞片于载玻片上,37 ℃烤片2 h,置于LFB染液中,60 ℃烤箱过夜,95%酒精漂洗,双蒸水漂洗,0.05%碳酸锂溶液中和70%酒精中分色,蒸馏水终止分色,梯度乙醇脱水、二甲苯透明、封片。普光显微镜(Olympus BX60)下观察,用Image-Pro Plus 6.0软件计算染色平均光密度值。
1.3.4 免疫组织荧光染色选取脑组织切片,充分漂洗,1%BSA/0.3%Triton X-100孵育,各组切片分别 加入兔抗鼠GFAP(1 ∶200)和大鼠抗小鼠MBP(1 ∶200) 一抗,4 ℃孵育过夜,充分漂洗,分别入荧光二抗中,常温避光孵育2 h,充分漂洗,DAPI染核,漂洗后用荧光抗淬灭封片剂封片,荧光显微镜(Nikon Eclipse90i)下观察并照相,用Image-Pro Plus 6.0软件进行细胞计数及染色光密度值的测定。
1.3.5 高效液相-电化学检测法精密称取NE、E、DA、5-HT、5-HIAA和DOPAC标准品各1.0 mg,用超纯水配制成浓度为0.10 g/L的标准储备液,取以上配制标准储备液用超纯水配制成不同浓度(0.5、1.0、2.0、5.0、10、40、80、200 ng/mL)的混合标准储备液。标准液进样20 μL,计算回归方程即标准曲线。样品预处理:取100 μL血清和10 μL 0.5 mol/L高氯酸加入1.5 mL的离心管中涡旋混匀,4 ℃放置20 min沉淀蛋白,低温离心机(15 000 r/min,15 min)离心取上清液,用0.22 μm过滤器过滤后待测。应用高效液相库伦阵列电化学检测器(型号5600A,ESA公司)检测单胺类递质及其代谢产物的含量(ng/L)。
1.3.6 酶联免疫吸附测定(ELISA)检测时严格按照试剂盒说明书要求进行操作,用酶标仪于450 nm测定吸光度值,根据标准品做出标准曲线,得出样品5-HT和NE的含量(ng/L)。
1.4 统计学分析采用SPSS 18.0进行数据统计分析,计量数据用x±s 表示,多个样本均数比较进行方差齐性检验,组间比较采用方差分析,变量间相互关系采用相关分析,P <0.05表示差异有统计学意义。
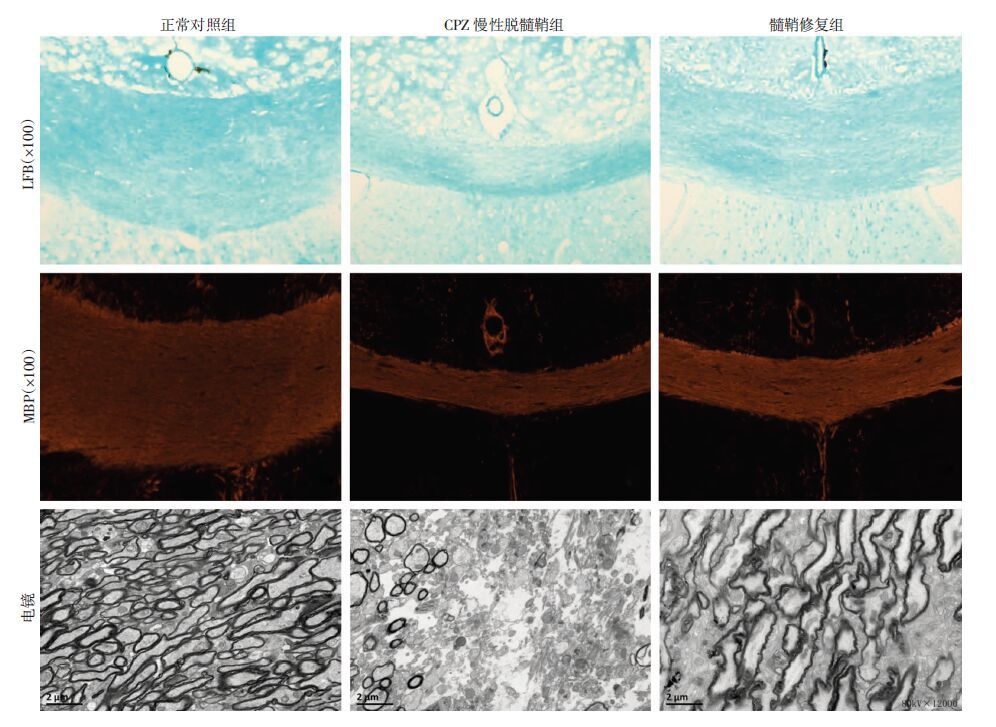
2 结果 2.1 各组小鼠髓鞘的变化LFB染色结果显示,正常对照组小鼠胼胝体区髓鞘染色较深且结构致密,平均光密度值(optical dencity,OD)为(0.28±0.09),而慢性脱髓鞘组髓鞘染色较浅且颜色不均匀,OD值为(0.15±0.05),两组间差异有统计学意义(P <0.01);髓鞘修复组胼胝体区域髓鞘染色明显变深,OD值为(0.21±0.05),显著高于慢性脱髓鞘组(P <0.05),但仍不如正常对照组染色深(P <0.01),见图 1。
|
| 图 1 各组小鼠胼胝体区髓鞘的变化情况 |
免疫荧光染色观察髓鞘碱性蛋白MBP的表达,结果发现正常对照组胼胝体区域宽且分布较均匀;慢性脱髓鞘组及髓鞘修复组胼胝体区域较正常对照组窄且染色不均匀,慢性脱髓鞘组胼胝体区域面积显著下降约65%(P <0.01),髓鞘修复组下降约48%(P <0.05),见图 1。
透射电镜观察胼胝体区髓鞘的细微结构,可见正常对照组的髓鞘结构致密,有髓鞘包绕组织的比例较大(71.48±4.98)%;慢性脱髓鞘组和髓鞘修复组的髓鞘结构松散,髓鞘修复组较慢性脱髓鞘组髓鞘增多[(36.19±6.75)% vs (12.02±4.23)%,P <0.01],但髓鞘厚度及有髓组织比例仍低于正常对照组(P <0.01),见图 1。上述结果提示:慢性脱髓鞘组及髓鞘修复组胼胝体区域出现不同程度的髓鞘脱失,模型诱导成功。
2.2 免疫荧光检测星形胶质细胞在各组小鼠胼胝体区及皮层区的变化胶质纤维酸性蛋白(GFAP)是星形胶质细胞的常 用标志物,通过对GFAP的免疫荧光染色,可以看出正常对照组胼胝体(corpus callosum,CC)区及皮层(cortex,CTX)区的星形胶质细胞数量较少(26.32±7.63);与正常对照组相比,慢性脱髓鞘组(64.15±13.30)及髓鞘修复组(58.12±15.47)的星形胶质细胞数量明显增加(P <0.01),见图 2。结果提示:星形胶质细胞可能对髓鞘的脱失有影响。

|
| 图 2 星形胶质细胞在各组小鼠胼胝体区及皮层区的变化情况 (×100) |
2.3 各组小鼠体质量的变化
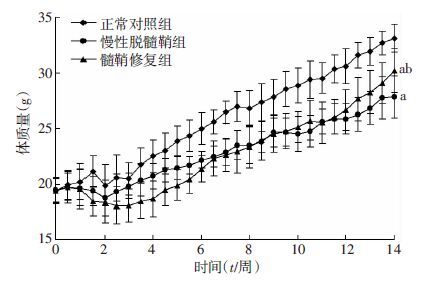
对各组小鼠在不同时间点的体质量进行检测,发现正常对照组小鼠体质量随时间呈现大幅度上升趋势;慢性脱髓鞘组和髓鞘修复组小鼠体质量在前3周呈下降状态,后缓慢上升;实验结束时3组小鼠两两间体质量比较,差异均有统计学意义(P <0.05),见图 3。
|
| a:P <0.01,与正常对照组比较;b:P <0.05,与慢性脱髓鞘组比较 图 3 各组小鼠体质量的变化情况 |
2.4 行为学实验检测小鼠焦虑和抑郁的行为改变 2.4.1 各组小鼠在旷场实验中的自主运动情况
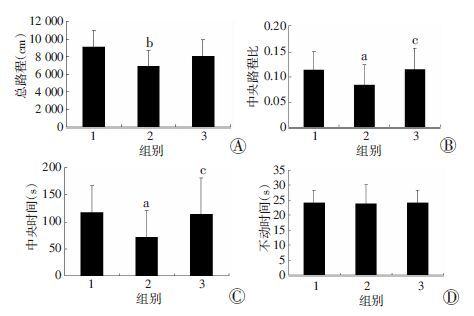
与正常对照组小鼠相比,慢性脱髓鞘组小鼠的中央运动路程比(P <0.05)和中央运动时间(P <0.05)均减少,表现出明显的焦虑样行为,且总运动路程降低(P <0.01);髓鞘修复组与慢性脱髓鞘组相比,在中央运动路程比(P <0.05)和中央运动时间(P <0.05)均有升高,且与正常对照组比较上述指标差异均无统计学意义(P>0.05);各组小鼠的不动时间差异无统计学意义(P>0.05),见图 4。
|
|
1:正常对照组;2:慢性脱髓鞘组;3:髓鞘修复组 a:P <0.05,b:P <0.01,与正常对照组比较;c:P <0.05,与慢性脱髓鞘组比较 A:各组小鼠的总运动路程;B:各组小鼠的中央运动路程比;C:各组小鼠的中央运动时间;D:各组小鼠的不动时间 图 4 各组小鼠在旷场中的自主运动情况 |
2.4.2 脱髓鞘小鼠在高架十字迷宫中的焦虑行为
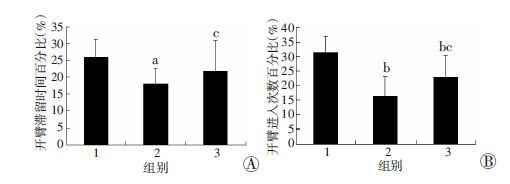
与正常对照组相比,慢性脱髓鞘组小鼠的开臂滞留时间百分比(OT%)(P <0.05)和开臂进入次数百分比(OE%)(P <0.01)均减少;与慢性脱髓鞘组比较,髓鞘修复组的OE%有所增加(P <0.05),而OT%差异无统计学意义(P>0.05);髓鞘修复组与正常对照组比较,OE%减少(P <0.05),而OT%差异无统计学意义(P>0.05),见图 5。
|
|
1:正常对照组;2:慢性脱髓鞘组;3:髓鞘修复组 a:P <0.05,b:P <0.01,与正常对照组比较;c:P <0.05,与慢性脱髓鞘组比较 A:开臂滞留时间百分比;B:开臂进入次数百分比 图 5 脱髓鞘小鼠在高架十字迷宫中的焦虑行为 |
2.4.3 脱髓鞘小鼠在悬尾实验中的抑郁行为
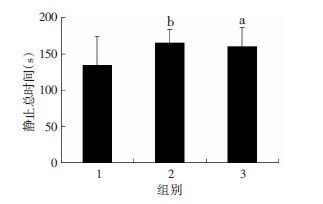
与正常对照组相比较,慢性脱髓鞘组(P <0.01)和髓鞘修复组(P <0.05)小鼠处于静止的总时间均显著增加,且慢性脱髓鞘组和髓鞘修复组间差异无统计学意义(P>0.05),见图 6。上述所有行为学实验结果提示:髓鞘的脱失和修复过程可能与焦虑或抑郁行为有联系。
|
| 1:正常对照组;2:慢性脱髓鞘组;3:髓鞘修复组 a:P <0.05,b:P <0.01,与正常对照组比较 图 6 脱髓鞘小鼠在悬尾实验中的抑郁行为 |
2.5 高效液相色谱-电化学检测各组小鼠血清单胺类神经递质及其代谢物的浓度
HPLC-ECD检测血清单胺类神经递质及其代谢产物浓度见表 1。慢性脱髓鞘组小鼠血清NE、5-HT和5-HIAA的浓度与正常对照组相比差异具有统计学意义(P <0.05);髓鞘修复组与慢性脱髓鞘组血清NE的浓度相比差异具有统计学意义(P <0.05)。结果表明:慢性脱髓鞘组小鼠血清单胺类神经递质及其代谢物有一定程度的升高。
| 组别 | NE | DA | 5-HT | E | 5-HIAA | DOPAC |
| 正常对照组 | 1.71±0.66 | 2.33±0.40 | 135.37±17.82 | 2.37±2.01 | 27.26±3.17a | 0.94±0.33 |
| 慢性脱髓鞘组 | 2.95±0.96a | 2.65±1.30 | 159.68±23.06a | 2.69±0.63 | 43.87±6.59 | 1.59±0.93 |
| 髓鞘修复组 | 1.39±0.24b | 1.72±0.91 | 147.14±18.99 | 1.99±1.38 | 38.22±10.42 | 0.97±0.14 |
| a:P <0.05,与正常对照组比较;b:P <0.05,与慢性脱髓鞘组比较 | ||||||
2.6 ELISA检测各组小鼠血清5-HT和NE的浓度
结果见表 2。可见正常对照组与慢性脱髓鞘组血清NE和5-HT的浓度差异有统计学意义(P <0.05),髓鞘修复组与慢性脱髓鞘组血清NE的浓度差异有统计学意义(P <0.05),而髓鞘修复组与正常对照组血清NE和5-HT的浓度差异无统计学意义(P>0.05)。
| 组别 | NE | 5-HT |
| 正常对照组 | 10.14±7.57 | 48.24±14.57 |
| 慢性脱髓鞘组 | 26.03±8.46a | 91.82±27.02a |
| 髓鞘修复组 | 12.67±8.57b | 71.37±27.56 |
| a:P <0.05,与正常对照组比较;b:P <0.05,与慢性脱髓鞘组比较 | ||
2.7 LFB染色OD值与血清单胺类神经递质及其代谢物的相关分析
将LFB染色的OD值分别与NE、DA、5-HT、E、5-HIAA 和DOPAC进行了线性相关分析,可见LFB染色OD值与5-HT和5-HIAA有明显的相关性(P <0.05),与NE、DA、E和DOPAC无明显相关性(P>0.05)。这提示髓鞘的脱失可能会影响5-HT的代谢平衡。
2.8 行为学实验结果与血清单胺类神经递质及其代谢物的相关分析分别对高架十字迷宫OT%、OE%、悬尾实验不动时间和旷场实验中央活动时间与NE、DA、5-HT、E、5-HIAA 和DOPAC进行了线性相关分析,结果显示高架十字迷宫OT%和高架十字迷宫OE%与5-HT和5-HIAA 存在显著的相关性(P <0.05),悬尾实验不动时间及旷场实验中央活动时间与血清单胺类神经递质无显著相关性。这提示5-HT及其代谢物的升高可能与情绪障碍如抑郁及焦虑有内在联系。
3 讨论CPZ是一种选择性铜离子螯合剂,能够靶向损伤少突胶质细胞的线粒体[13],诱导中枢神经系统髓鞘脱失[11]。近年来研究表明:该模型可用于MS及精神分裂症等神经精神类疾病的研究[14],尤其适合于髓鞘脱失和再生过程中情感障碍的相关研究。
本实验研究通过观察建模期间小鼠体质量变化发现:慢性脱髓鞘小鼠体质量的上升幅度小,其原因可能与小鼠脱髓鞘病理改变以及情绪变化有关。近年研究[15-16]通过磁共振弥散张量成像对焦虑、抑郁症的研究中发现患者早期即存在不同程度脑白质有髓神经纤维微观结构的完整性异常。本研究利用LFB染色、免疫荧光和透射电镜技术评估模型小鼠髓鞘脱失及修复情况,结果显示慢性脱髓鞘组有明显的髓鞘脱失,而髓鞘修复组经过正常饲料喂养2周后,可见髓鞘有不同程度的修复。通过GFAP免疫荧光对星形胶质细胞进行检测,发现GFAP在髓鞘脱失期及修复期均保持较高的水平,与之前的研究相符[1, 10]。这一结果说明星形胶质细胞的大量活化可能是影响髓鞘再生的重要因素之一。在行为学实验中,我们发现慢性脱髓鞘小鼠在旷场和高架十字迷宫等经典的检测焦虑行为的实验中表现出焦虑样行为学改变。与正常对照组相比,慢性脱髓鞘小鼠在旷场中央区活动的时间和中央路程比均下降;在高架十字迷宫中OT%、OE%下降,这说明慢性脱髓鞘小鼠缺乏冒险行为而具有明显的焦虑行为。通过旷场实验和悬尾实验对各组小鼠的抑郁样行为进行评估,可见慢性脱髓鞘小鼠在旷场实验中的水平运动能力下降,可能与小鼠脑组织多处脱髓鞘改变及抑郁行为有关;慢性脱髓鞘小鼠在悬尾实验中的不动时间增加,表现出抑郁样行为。行为学研究显示慢性脱髓鞘小鼠具有焦虑、抑郁行为,而髓鞘修复组小鼠亦有一定程度的焦虑、抑郁样行为,但较慢性脱髓鞘组小鼠有改善,说明髓鞘的脱失和修复过程对小鼠的情绪变化有影响。
目前关于焦虑、抑郁障碍的发病机制仍未明确,单胺类神经递质可能是焦虑抑郁症发病及治疗研究的重点[17]。Coppen等[18]研究发现,中枢缺乏5-HT和NE会导致抑郁,而焦虑则与NE和5-HT亢进有关[19]。目前有研究认为,突触后膜5-HT1A和5-HT2受体激活可引起焦虑,而突触后膜5-HT1A受体阻断以及5-HT2 受体激活能导致抑郁,焦虑和抑郁障碍常常共存,可能是由于两者均存在5-HT1A受体或5-HT2受体功能异常所致[20-21]。本研究结果显示:慢性脱髓鞘组与正常对照组比较,血清NE和5-HT浓度均有显著升高,且5-HIAA亦有明显升高,说明焦虑或者焦虑抑郁共病是由5-HT、NE活性亢进所致;DA及代谢物略有升高,但无明显差异,可能与样本量较少及个体差异大有关,值得进一步研究;与慢性脱髓鞘组相比,髓鞘修复组血清单胺类神经递质及其代谢物有一定程度的降低,但仍没有达到正常水平,说明髓鞘的修复可能对神经递质等与情绪相关的生物活性物质有调节作用。3组小鼠血清5-HT及其代谢产物的浓度与髓鞘的损伤及小鼠的焦虑抑郁行为有显著相关性。上述所有结果支持焦虑、抑郁障碍的发病是以中枢神经系统结构和神经化学物质为基础的观点[22]。
综上所述,脱髓鞘环境下所出现的焦虑、抑郁等情感障碍可能起因于神经元相关的髓鞘体积减小而导致相关神经递质的紊乱,少突胶质细胞的功能异常有可能是情感障碍的发病原因之一。由此推断,少突胶质细胞具有作为治疗靶点来改善情感障碍的潜在可能,这将为此类疾病的治疗提供一个新的方向,但其中的机制还需要今后更深入的研究。
| [1] | Milo R, Kahana E. Multiple sclerosis: geoepidemiology, genetics and the environment[J]. Autoimmun Rev,2010, 9 (5) : A387 –A394. DOI:10.1016/j.autrev.2009.11.010 |
| [2] | Jones K H, Ford D V, Jones P A, et al. A large-scale study of anxiety and depression in people with Multiple Sclerosis: a survey via the web portal of the UK MS Register[J]. PLoS One,2012, 7 (7) : e41910 . DOI:10.1371/journal.pone.0041910 |
| [3] | Alsaadi T, El-Hammasi K, Shahrour T M, et al. Prevalence of Depression and Anxiety among Patients with Multiple Sclerosis Attending the MS Clinic at Sheikh Khalifa Medical City, UAE: Cross-Sectional Study[J]. Mult Scler Int,2015, 2015 : 487159 . DOI:10.1155/2015/487159 |
| [4] | Lily O, McFadden E, Hensor E, et al. Disease-specific quality of life in multiple sclerosis: the effect of disease modifying treatment[J]. Mult Scler,2006, 12 (6) : 808 –813. |
| [5] | 袁勇贵, 吴爱琴, 张心保. 焦虑和抑郁合病的生物学研究进展[J]. 国外医学: 精神病学分册,2000, 27 (3) : 143 –148. |
| [6] | Hamon M, Blier P. Monoamine neurocircuitry in depression and strategies for new treatments[J]. Prog Neuropsychopharmacol Biol Psychiatry,2013, 45 : 54 –63. DOI:10.1016/j.pnpbp.2013.04.009 |
| [7] | 黄嘉璐, 穆建坤, 孟召友, 等. 少突胶质细胞前体细胞在双环己酮草酰二腙诱导的脱髓鞘模型中的变化特点[J]. 第三军医大学学报,2013, 35 (12) : 1237 –1241. DOI:10.16016/j.1000-5404.2013.12.013 |
| [8] | Takahashi N, Sakurai T, Davis K L, et al. Linking oligodendrocyte and myelin dysfunction to neurocircuitry abnormalities in schizophrenia[J]. Prog Neurobiol,2011, 93 (1) : 13 –24. DOI:10.1016/j.pneurobio.2010.09.004 |
| [9] | Dubois-Dalcq M, Ffrench-Constant C, Franklin R J. Enhancing central nervous system remyelination in multiple sclerosis[J]. Neuron,2005, 48 (1) : 9 –12. DOI:10.1016/j.neuron.2005.09.004 |
| [10] | Steelman A J, Thompson J P, Li J. Demyelination and remyelination in anatomically distinct regions of the corpus callosum following cuprizone intoxication[J]. Neurosci Res,2012, 72 (1) : 32 –42. DOI:10.1016/j.neures.2011.10.002 |
| [11] | Matsushima G K, Morell P. The neurotoxicant, cuprizone, as a model to study demyelination and remyelination in the central nervous system[J]. Brain Pathol,2001, 11 (1) : 107 –116. |
| [12] | 王洪凯, 梅峰, 刘志, 等. 不同年龄小鼠脱髓鞘动物模型中脑内星形胶质细胞激活情况的观察[J]. 第三军医大学学报,2012, 34 (8) : 696 –700. DOI:10.16016/j.1000-5404.2012.08.020 |
| [13] |
Benardais K, Kotsiari A, Skuljec J, et al. Cuprizone [bis(cyclohexylidenehydrazide)] is selectively toxic for mature oligodendrocytes[J]. Neurotox Res, 2013, 24(2): 244-250. DOI: 10.1007/s12640-013-9380-9 |
| [14] | Kipp M, Clarner T, Dang J, et al. The cuprizone animal model: new insights into an old story[J]. Acta Neuropathol,2009, 118 (6) : 723 –736. DOI:10.1007/s00401-009-0591-3 |
| [15] | Paulus M P. The role of neuroimaging for the diagnosis and treatment of anxiety disorders[J]. Depress Anxiety,2008, 25 (4) : 348 –356. DOI:10.1002/da.20499 |
| [16] | Dalby R B, Frandsen J, Chakravarty M M, et al. Depression severity is correlated to the integrity of white matter fiber tracts in late-onset major depression[J]. Psychiatry Res,2010, 184 (1) : 38 –48. DOI:10.1016/j.pscychresns.2010.06.008 |
| [17] | Castren E. Is mood chemistry?[J]. Nat Rev Neurosci,2005, 6 (3) : 241 –246. DOI:10.1038/nrn1629 |
| [18] | Coppen A, Shaw D M, Malleson A. Changes in 5-hydroxytryptophan metabolism in depression[J]. Br J Psychiatry,1965, 111 : 105 –107. |
| [19] | Bystritsky A, Kerwin L, Feusner J D, et al. A pilot controlled trial of bupropion XL versus escitalopram in generalized anxiety disorder[J]. Psychopharmacol Bull,2008, 41 (1) : 46 –51. |
| [20] | Paul E D, Lowry C A. Functional topography of serotonergic systems supports the Deakin/Graeff hypothesis of anxiety and affective disorders[J]. J Psychopharmacol,2013, 27 (12) : 1090 –1106. DOI:10.1177/0269881113490328 |
| [21] | Stein M B. Neurobiology of generalized anxiety disorder[J]. J Clin Psychiatry,2009, 70 (Suppl 2) : 15 –19. |
| [22] | Blier P. Neurotransmitter targeting in the treatment of depression[J]. J Clin Psychiatry,2013, 74 (Suppl 2) : 19 –24. DOI:10.4088/JCP.12084su1c.04 |



