2. 100048 北京,解放军总医院第一附属医院药剂药理科
2. Department of Biochemistry and Molecular Biology, College of Sciences, Hainan Medical University, Haikou, Hainan Province, 570102
3. Department of Hepatobiliary Surgery, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042, China
4. Battalion 15, Cadet Brigade, Third Military Medical University, Chongqing, 400038
肺癌是世界范围内发病率和死亡率较高的恶性肿瘤之一,其中80%~85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1],且绝大多数患者被确诊时已到局部晚期或发生了远处转移[2],严重威胁着人类健康。分子靶向药物在NSCLC临床治疗中占有重要地位,与传统的化疗、放疗相比,其特异性更强,不良反应较轻,毒副作用小[3]。棘皮动物微管相关蛋白样4-间变性淋巴瘤激酶(echinoderm microtubule-associated protein like 4-anaplastic lymphoma kinase,EML4-ALK)融合基因是NSCLC新的治疗靶点,在NSCLC中出现的频率为3%~5%,在不伴有表皮生长因子受体(epidermal growth factor receptor,EGFR)或v-Ki-ras2大鼠Kirsten肉瘤病毒癌基因同源基因(v-Ki-ras2 Kirsten rat sarcoma viral oncogene homolog,KRAS)突变的腺癌中的表达率为42.80%[4]。克唑替尼(Crizotinib)是一种新型的多靶点酪氨酸激酶抑制剂,其靶点包括EML4-ALK、肝细胞生长因子受体(hepatocyte growth factor receptor,c-MET)、原癌基因蛋白酪氨酸激酶ROS(c-ros oncogene 1,ROS1)等。2011年,美国食品和药物管理局批准克唑替尼用于治疗ALK基因重排阳性的局部晚期或转移性NSCLC[5]。但是,克唑替尼和其他的酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)一样,服用一段时间后也会产生耐药。目前报道的相关耐药机制主要有ALK激酶域的突变[6]和信号旁路的激活[7, 8, 9],具体机制仍不明确,尚需进一步研究。目前EML4-ALK表达阳性的肺癌细胞有NCI-H2228和NCI-H3122,其中NCI-H3122细胞株在国内应用少,为了更加深入研究克唑替尼的耐药机制,本研究通过浓度递增法诱导建立克唑替尼耐药模型H3122CR,多方面考察耐药细胞与亲本细胞的生物学差异,并考察耐药细胞差异表达的miRNAs,为进一步研究奠定基础。
1 材料与方法 1.1 材料与仪器克唑替尼(Crizotinib,PF-02341066,商品名XALKORI)购自广州亿邦医药科技有限公司;人肺腺癌细胞株NCI-H3122(EML4-ALK融合基因阳性)购自海德创业(北京)生物科技有限公司;RPMI1640为美国Gibco公司产品;胎牛血清为杭州四季青生物工程有限公司产品;CCK-8试剂盒为日本同仁化学研究所产品;Annexin V-FITC/PI凋亡检测试剂盒和细胞周期检测试剂盒购自碧云天生物技术有限公司;miRNeasy Mini kit购自德国QIAGEN公司;Fast SYBR Green Master Mix购自美国Applied Biosystems;TURBO DNA-free Kit购自Ambion公司;miRNA第1链cDNA合成试剂盒和PCR引物购自上海生工公司;Agilent 2100分析仪器;Agilent RNA 6000 Pico Kit;TruSeq Small RNA Sample Prep Kits购自Illumina公司。
1.2 细胞培养NCI-H3122细胞培养在含10%胎牛血清和1%双抗(青霉素和链霉素)的RPMI1640培养液中,于37 ℃、5% CO2的细胞培养箱中进行常规培养。克唑替尼溶于二甲基亚砜(DMSO)中,配置成20 mmon/L的储备液,保存于-20℃的冰箱中备用。
1.3 药物浓度递增法诱导NCI-H3122克唑替尼耐药细胞株采用克唑替尼浓度递增法诱导建立获得性耐药细胞系[9, 10]。取处于生长对数期的NCI-H3122细胞,加入克唑替尼初始浓度为0.01 μmol/L培养液诱导,1~2 d更换培养液去除死亡的细胞,待细胞生长稳定后增加药物浓度,一般培养2~3周药物剂量加倍,最终细胞能够在1 μmol/L的克唑替尼培养液中稳定生长,将其命名为H3122CR,并在含有1 μmol/L的克唑替尼培养基中长期培养。
1.4 细胞形态学观察取生长对数期的H3122细胞和H3122CR细胞,在倒置显微镜下观察两者的形态学差异。
1.5 绘制细胞生长曲线将对数生长期的H3122和H3122CR细胞制备成单细胞悬液,按1 000个/孔接种于96孔板,同时设置6个复孔,细胞贴壁后加CCK-8,孵育2 h后用酶标仪测定450 nm波长处光密度值,连续观察5 d,以培养时间为横坐标,D(450)值为纵坐标绘制细胞生长曲线。
1.6 药物敏感性实验将处于对数生长期的H3122和H3122CR细胞,分别以4.0×104/mL和5.0×104/mL的细胞数接种于96孔板,100 μL/孔。培养12 h后,加入浓度梯度的克唑替尼(0.025、0.05、0.1、0.2、0.5、1.0 、3.0、5.0、7.0 μmol/L)进行处理,同时设置阴性对照组和空白对照组,每组6个复孔。37 ℃、5% CO2的细胞培养箱中培养72 h,每孔加入10 μL CCK-8,继续孵育2 h,酶标仪检测450 nm波长处光密度值[D(450)],计算抑制率,细胞抑制率={1-[实验组D(450)值-空白组D(450)值]/[阴性对照组D(450)值-空白组D(450)值]}×100%。实验重复3次。采用SPSS 16.0软件计算半数抑制浓度IC50和耐药指数RI,RI=耐药细胞IC50/亲本细胞IC50。
1.7 流式细胞仪AnnexinV-FITC/PI双染色法检测细胞凋亡将对数生长期的H3122和H3122CR细胞接种于6孔板,待细胞贴壁后分别加入含有克唑替尼0.2 μmol/L和1.0 μmol/L的RPMI1640培养液,培养48 h,收集细胞,加入Annexin V-FITC和PI进行染色,同时设置阴性对照组,流式细胞仪检测细胞凋亡率,实验重复3次。
1.8 细胞周期检测将对数生长期的H3122和H3122CR细胞接种于无血清培养基中常规培养24 h使其同步化;弃掉旧培养液更换为10%胎牛血清新鲜培养液继续培养48 h,收集细胞,离心,加入0.5 mL冷的PBS重悬细胞,并将其加入到1.5 mL 95%冰乙醇中,4 ℃固定过夜,PBS清洗2次,加入RNase A和碘化丙啶染色30 min,流式细胞仪进行检测。
1.9 第二代测序技术检测miRNA及RT-PCR检测取对数生长期的H3122细胞和H3122CR细胞,按照miRNeasy Mini kit试剂盒说明加一定量的细胞裂解液提取总RNA。采用Agilent RNA 6000 Pico Kit试剂盒测定RNA的浓度,Agilent 2100分析仪器检查RNA的完整性。由TruSeq Small RNA Sample Prep Kits构建文库,应用Illumina HiSeq 2500平台的第二代测序技术,检测亲本细胞株和耐药细胞株的miRNAs,并进行数据分析。筛选出的差异表达的miRNAs采用RT-PCR进行验证:按上述方法提取总RNA,加尾法反转录为cDNA,以此为模板进行PCR扩增,反转录和扩增分别按照试剂盒说明书操作,以U6(生工反转录试剂盒)为内参对照,实验中miRNA的下游引物为生工反转录试剂盒中的通用引物,其上游引物序列见表 1。
| 基因 | 上游引物(5′→3′) |
| hsa-miR-30a-5p | CGGCGGTGTAAACATCCTCG |
| hsa-miR-374c-5p | CGGCGGATAATACAACCTGCTA |
| hsa-miR-125b-5p | TGCGGTCCCTGAGACCCT |
| hsa-miR-31-5p | CGGAGGCAAGATGCTGGC |
| hsa-miR-10a-5p | CGGTACCCTGTAGATCCGAA |
| hsa-miR-200c-3p | GCGGTAATACTGCCGGGTAA |
采用SPSS 16.0统计软件。计量数据经检验均符合正态分布,以x±s表示,细胞凋亡率的比较采用两因素析因方差分析,细胞周期以及差异表达miRNA的比较采用独立样本t检验。
2 结果 2.1 克唑替尼耐药细胞株的建立NCI-H3122细胞经小剂量的克唑替尼作用后细胞变化不明显;1周后增加药物浓度至0.1 μmol/L,观察细胞出现明显的死亡,继续作用3周后细胞基本稳定;克唑替尼剂量增加到1 μmol/L时细胞出现大量死亡,剩余的细胞呈蜘蛛状,胞质颗粒增多,少量存活的细胞生长缓慢,2个月后开始克隆生长,历时6个月得到H3122CR细胞系,并将其在含有1 μmol/L的克唑替尼的RPMI1640培养基中长期培养。
2.2 细胞形态观察倒置显微低倍镜下观察NCI-H3122细胞形态不规则(图 1A);药物持续诱导6个月成功构建了H3122CR细胞,其体积增大,长伪足,触角伸长,呈纤维细胞形态(图 1B);H3122CR细胞冻存后重新复苏,细胞形态有恢复亲本细胞的趋势,多呈类圆形或半圆形(图 1C),但是与H3122相比,H3122CR细胞大,胞核清晰可见。耐药细胞形态变大可能与增加药物外排有关。与亲本细胞H3122相比,H3122CR有典型的上皮可塑性,可能有上皮-间质细胞转化的现象,有待进一步的考察。
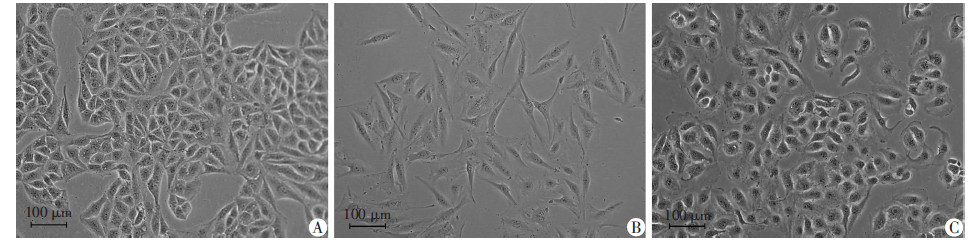 |
| A:H3122细胞;B:H3122CR细胞;C:H3122CR细胞冻存后重新复苏图 1 倒置显微镜观察H3122、H3122CR和H3122CR冻存后重新复苏细胞的形态学变化 |
绘制的H3122细胞和H3122CR生长曲线提示:在相同条件下培养,细胞增殖产生了一定的差异。耐药细胞株H3122CR的生长较亲本细胞H3122缓慢,生长曲线的斜率较小(图 2)。
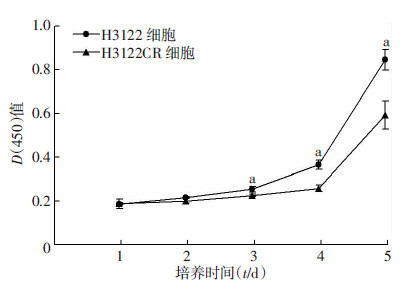 |
| a: P<0.01, 与H3122CR细胞比较图 2 H3122细胞和H3122CR细胞的生长曲线 |
CCK-8法检测结果显示:随着克唑替尼浓度的增加,亲本细胞和耐药细胞的存活率都逐渐降低,提示克唑替尼对两株细胞均有抑制作用,并且克唑替尼对亲本细胞的抑制率明显高于耐药细胞(表 2)。克唑替尼对H3122亲本细胞的IC50值为0.165 μmol/L,对H3122CR耐药细胞的IC50值为1.627 μmol/L,耐药指数约为9.86。经长时间的药物诱导,NCI-H3122细胞对克唑替尼的敏感性逐渐降低,产生了显著的耐药。
| x± s | ||||
| 克唑替尼(μmol/L) | H3122细胞 | H3122CR细胞 | P值 | |
| 0.25 | 9.00±3.68 | - | - | |
| 0.50 | 23.82±4.34 | - | - | |
| 0.10 | 41.97±6.39 | 11.18±7.95 | 0.010 3 | |
| 0.20 | 60.67±6.41 | 14.68±3.97 | 0.000 8 | |
| 0.50 | 66.87±6.51 | 18.26±6.19 | 0.001 3 | |
| 1.00 | 75.33±4.97 | 32.03±5.94 | 0.000 3 | |
| 3.00 | - | 66.12±4.64 | - | |
| 5.00 | - | 80.00±7.53 | - | |
| 7.00 | - | 93.39±1.62 | - | |
根据CCK-8实验结果选用0.2、1.0 μmol/L克唑替尼分别作用于H3122和H3122CR细胞,48 h后流式细胞仪检测细胞凋亡(图 3)。0.2、1.0 μmol/L克唑替尼作用于H3122细胞凋亡率分别为(50.21±4.36)%和(59.92±2.24)%,而作用于H3122CR细胞凋亡率分别为(11.98±1.56)%和(14.73±3.23)%;与H3122细胞比较,H3122CR细胞凋亡率显著降低(P均<0.05)。
 |
| A~C:H3122细胞;D~F:H3122CR细胞;A、D:对照;B、E:0.2 μmol/L克唑替尼;C、F:1.0 μmol/L克唑替尼图 3 流式细胞仪检测不同浓度克唑替尼对亲本H3122细胞和耐药H3122CR细胞凋亡的影响 |
流式细胞仪检测结果(图 4)显示:H3122细胞G1期细胞比例为(54.1±7.23)%,S期为(39.585±6.33)%,G2期为(6.315±2.22)%;H3122CR细胞G1期细胞比例为(67.64±4.74)%,S期为(23.09±3.75)%,G2期为(9.268±1.23)%。与H3122细胞比较,H3122CR细胞G1期和G2期细胞比例增加,S期比例减少,差异均有统计学意义(P<0.05)。
 |
| A:H3122细胞;B:H3122CR细胞图 4 流式细胞仪检测H3122和H3122CR细胞周期 |
第二代基因测序结果发现41个差异表达的miRNAs(差异倍数大于3),其中17个上调,24个下调。选择其中的部分miRNAs采用RT-PCR进行验证,miR-30a-5p、miR-374c-5p和miR-125b-5p表达上调;miR-31-5p、miR-10a-5p和miR-200c-3p表达下调(图 5)。
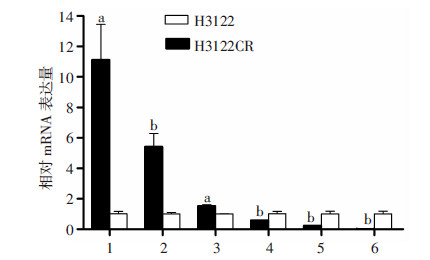 |
| 1:miR-30a-5p;2:miR-374c-5p;3:miR-125b-5p;4:miR-31-5p;5:miR-10a-5p;6:miR-200c-3p; a:P<0.01,b:P<0.05,与H3122细胞比较图 5 H3122细胞和H3122CR细胞中miRNAs的表达 |
近年来随着靶向药物的开发与应用,肺癌患者的生存期得到明显的改善,从中获益。然而,许多患者服药一段时间后最终会产生耐药,且绝大多数属于获得性耐药,使靶向药物治疗在肺癌中的应用陷入困境。通过体外药物剂量逐渐递增的方法建立耐药模型可以模拟临床患者的获得性耐药,因此,本实验采用克唑替尼剂量逐渐递增的方法,成功构建了克唑替尼耐药细胞H3122CR模型。实验中耐药细胞在1.0 μmol/L的克唑替尼药物中维持培养,耐药性相对保持稳定,同时考察了撤药后即耐药细胞在不含药物的完全培养液中连续培养1、2周和3周对克唑替尼敏感性的变化,结果发现在不含药物的完全培养液中连续培养2周耐药性几乎不发生变化,保持相对的稳定,但是3周后耐药性减弱,说明了耐药细胞株H3122CR在不含药物的培养液中在短时间内能够保持稳定的耐药性。细胞周期检测实验结果显示,耐药后细胞周期分布发生了变化,与亲本细胞相比,耐药细胞H3122CR处于G1期的比例增加,同时S期比例减少,表明细胞增殖活力有所下降,与细胞生长曲线耐药细胞株生长缓慢结果一致。
有研究报道miRNAs在肺癌中对于抗癌药物的耐药调控具有潜在的作用,某些miRNA可以作为生物标志物来预测或调节肺癌的治疗[11, 12]。miRNAs与细胞的增殖、周期调控、凋亡等信号转导通路有关。在胶质瘤干细胞替莫唑胺耐药机制研究中发现miR-125b-5p表达上调,通过抑制其表达能够促进细胞凋亡,一定程度的消弱耐药性[13];在白血病柔红霉素耐药细胞中miR-125b-5p能够下调G蛋白偶联受体激酶2和上调p53蛋白表达,调节细胞凋亡[14];在顺铂耐药的肺癌A549/DDP细胞中miR-10a能够调节caspase3/8基因的表达影响细胞凋亡[15]。本研究初步筛选耐药细胞与亲本细胞差异表达的miRNAs,寻找耐药相关的miRNAs,同时进行了相关的生物信息学分析,结果中包括凋亡相关基因BCL2-antagonist/killer 1(BAK1)、E2F transcription factor 3(E2F3)和BCL2-modifying factor(BMF),因此,推测本研究中miR-125b-5p和miR-10a-5p表达变化很有可能是通过影响肺癌细胞的凋亡介导克唑替尼的耐药,有待进一步进行实验验证。
上述细胞形态学实验中发现细胞耐药后,形态发生明显改变,呈纤维状,耐药细胞有上皮-间质细胞转化(epithelial-mesenchymal transition,EMT)的可能,推测EMT很可能也是克唑替尼的一种耐药机制[16]。Adam等[17]研究miRNA在EMT诱导的EGFR靶向治疗耐药过程中的作用时,通过对比膀胱敏感细胞和耐药细胞,筛选出一些相关的miRNAs,其中miR-200家族成员可以调控EMT,恢复EGFR敏感,推测本研究中H3122细胞对克唑替尼耐药后miR-200c下调很可能是与EMT有关。
本研究成功构建了克唑替尼耐药模型,并且从miRNA入手,初步预测了其耐药机制,但是筛选出的miRNA是通过哪种功能(凋亡、周期,或是迁移和侵袭)变化介导耐药,以及究竟是通过哪种分子调控机制参与耐药还需要进一步的考察。本研究中只构建了1种耐药细胞株,如果能同时采用2株或者3株EML4-ALK阳性的克唑替尼耐药细胞株,并且同时增加体内试验结果会更具说服力。
| [1] | Jemal A, Tiwari R C, Murray T, et al. Cancer statistics, 2004[J]. CA Cancer J Clin, 2004. 54(1): 8-29. |
| [2] | Jemal A, Center M M, DeSantis C, et al. Global patterns of cancer incidence and mortality rates and trends[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(8): 1893-1907. DOI: 10.1158/1055-9965.EPI-10-0437 |
| [3] | 钱健, 秦超, 殷长军. 肿瘤靶向药物疗效及毒性与基因多态性间相关性的研究进展[J]. 中国肿瘤外科杂志, 2012, 4(3): 161-163, 168. DOI: 10.3969/j.issn.1674-4136. 2012.03.011 |
| [4] | Zhang X, Zhang S, Yang X, et al. Fusion of EML4 and ALK is associated with development of lung adenocarcinomas lacking EGFR and KRAS mutations and is correlated with ALK expression[J]. Mol Cancer, 2010, 9: 188. DOI: 10.1186/1476-4598-9-188 |
| [5] | Gandhi L, Janne P A. Crizotinib for ALK-rearranged non-small cell lung cancer: a new targeted therapy for a new target[J]. Clin Cancer Res, 2012, 18(14): 3737-3742. |
| [6] | Doebele R C, Pilling A B, Aisner D L, et al. Mechanisms of resistance to crizotinib in patients with ALK gene rearranged non-small cell lung cancer[J]. Clin Cancer Res, 2012, 18(5): 1472-1482. |
| [7] | Qi J, McTigue M A, Rogers A, et al. Multiple mutations and bypass mechanisms can contribute to development of acquired resistance to MET inhibitors[J]. Cancer Res, 2011, 71(3): 1081-1091. DOI: 10.1158/0008-5472. CAN-10-1623 |
| [8] | Katayama R, Shaw A T, Khan T M, et al. Mechanisms of acquired crizotinib resistance in ALK-rearranged lung Cancers[J]. Sci Transl Med, 2012, 4(120): 120ra17. DOI: 10.1126/scitranslmed.3003316 |
| [9] | Yamaguchi N, Lucena-Araujo A R, Nakayama S, et al. Dual ALK and EGFR inhibition targets a mechanism of acquired resistance to the tyrosine kinase inhibitor crizotinib in ALK rearranged lung cancer[J]. Lung Cancer, 2014, 83(1): 37-43. DOI: 10.1016/j.lungcan.2013.09.019 |
| [10] | Sang J, Acquaviva J, Friedland J C, et al. Targeted inhibition of the molecular chaperone Hsp90 overcomes ALK inhibitor resistance in non-small cell lung cancer[J]. Cancer Discov, 2013, 3(4): 430-443. DOI: 10.1158/2159- 8290.CD-12-0440 |
| [11] | Kosaka N, Iguchi H, Ochiya T. Circulating microRNA in body fluid: a new potential biomarker for cancer diagnosis and prognosis[J]. Cancer Sci, 2010, 101(10): 2087-2092. DOI: 10.1111/j.1349-7006.2010.01650.x |
| [12] | Aushev V N, Zborovskaya I B, Laktionov K K, et al. Comparisons of microRNA patterns in plasma before and after tumor removal reveal new biomarkers of lung squamous cell carcinoma[J]. PLoS One, 2013, 8(10): e78649. DOI: 10.1371/journal.pone.0078649 |
| [13] | Chen J, Fu X, Wan Y, et al. miR-125b inhibitor enhance the chemosensitivity of glioblastoma stem cells to temozolomide by targeting Bak1[J]. Tumour Biol, 2014, 35(7): 6293-6302. DOI: 10.1007/s13277-014-1821-4 |
| [14] | Zhou L, Bai H, Wang C, et al. microRNA-125b promotes leukemia cell resistance to daunorubicin by inhibiting apoptosis[J]. Mol Med Rep, 2014, 9(5): 1909-1916. DOI: 10.3892/mmr.2014.2011 |
| [15] | Sun W, Ma Y, Chen P, et al. MicroRNA-10a silencing reverses cisplatin resistance in the A549/cisplatin human lung cancer cell line via the transforming growth factor-β/Smad2/STAT3/STAT5 pathway[J]. Mol Med Rep, 2015, 11(5): 3854-3859. DOI: 10.3892/mmr.2015.3181 |
| [16] | Kim H R, Kim W S, Choi Y J, et al. Epithelial-mesenchymal transition leads to crizotinib resistance in H2228 lung cancer cells with EML4-ALK translocation[J]. Mol Oncol, 2013, 7(6): 1093-1102. DOI: 10.1016/j.molonc.2013.08.001 |
| [17] | Adam L, Zhong M, Choi W, et al. miR-200 expression regulates epithelial-to-mesenchymal transition in bladder cancer cells and reverses resistance to epidermal growth factor receptor therapy[J]. Clin Cancer Res, 2009, 15(16): 5060-5072. DOI: 10.1158/1078-0432.CCR-08-2245 |



