2. 401120 重庆,重庆润泽医药有限公司 ;
3. 611731 成都,四川省食品药品检测院 ;
4. 401147 重庆,武警重庆总队机关门诊部口腔科
2. Chongqing Runze Pharmaceutical Co., Ltd. Chongqing, 401120 ;
3. Sichuan Institute for Food and Drug Control, Chengdu, Sichuan Province, 611731 ;
4. Department of Stomatology, Authority Clinic of Chongqing Armed Police Force, Chongqing, 401147, China
由外伤、肿瘤、手术切除及感染等原因导致的骨缺损,目前主要采用自体骨移植、同种异体骨移植、异源性骨粉充填和金属及其合金等方法进行治疗[1]。由于骨源有限及免疫排斥等问题,金属材料在骨缺损修复中扮演着越来越重要的角色。前期实验已证实多孔钽颗粒具有骨诱导和塑形作用,对骨缺损有良好的修复效果,有望取代钛作为新型牙科植入材料[2]。但纯钽无法提供成骨所需生长因子,多孔钽移植物存在着缺少血管化的缺点[3]。转化生长因子-β1(transforming growth factor-β1,TGF-β1)能促进新骨生成,刺激骨小梁及微血管的增长[4],研究证实它能显著提高种植体周围新骨生成,增加种植体与周围骨组织结合的稳定性[5]。但作为一种多肽物质,TGF-β1在体内易扩散或被分解,单独作用于靶细胞的时间较短,故需与一种载体复合以形成类缓释系统。因此,我们开发了一种新型的生物活性多孔钽修复材料,该材料利用钽颗粒的多孔性作为TGF-β1的类缓释载体,具有生物相容性佳、吸附能力强、机械强度高、可塑性好等优点,本研究通过观察不同时间点各组骨缺损区新骨生成面积及新生微血管密度,探讨该生物材料促骨生长的生物活性,为多孔钽材料更好地应用于临床奠定基础。
1 材料与方法 1.1 实验动物12月龄雄性比格犬6只,体质量10~12 kg(四川省食品药品检测中心提供)。
1.2 主要实验试剂及实验器材Human TGF-β1 10 μg(美国Pepro Tech公司);荧光四环素(成都华夏试剂公司);直径1 mm左右、孔径约300 μm,孔隙率为70%的多孔钽颗粒若干(重庆润泽公司提供);种植机1台(Implantoloy system RZ11-YZ);德国EXACT切磨片系统;倒置相差显微镜(Olympus,日本)。
1.3 TGF-β1与纳米多孔钽的复合将TGF-β1用生理盐水稀释至5 ng/mL,将消好毒的多孔钽颗粒和配制好的溶液混合放入无菌离心管中,于振荡器上4 ℃过夜,冷冻干燥备用。
1.4 实验方法 1.4.1 动物模型的制备将比格犬静注5%戊巴比妥钠(0.5 mL/kg)和陆眠宁Ⅱ(0.07 mL/kg),麻醉后拔除双侧第1~4前臼齿。3个月后,剥离牙龈,用种植下颌机头在其第1~4前臼齿区域制作直径为4.0 mm, 深7.0 mm的骨缺损,骨缺损之间的间距为5 mm。单侧建立3个骨缺损,分别为单纯多孔钽颗粒修复组(对照组)、TGF-β1+多孔钽颗粒修复组(实验组)和无干预组(空白对照组)。共36个骨缺损。多孔钽放入完备后,用骨引导再生膜覆盖骨缺损区。逐层对位缝合,肌注陆醒宁、氯胺酮和头孢之后将比格犬放回饲养笼。
1.4.2 检测方法及指标术后30、60、90 d分别处死2只比格犬,取得比格犬下颌骨标本。
1.4.2.1 大体观察肉眼观察骨组织愈合情况及金属钽颗粒与骨组织结合情况。
1.4.2.2 X线观察将取得的标本用Sirona牙片机拍片(曝光条件70 kV,0.12 s)。
1.4.2.3 硬组织切片观察生理盐水冲洗标本后,置10%甲醛溶液中固定24 h,而后脱水、渗透、包埋,EXACT硬组织切片机切片,切出将多孔钽完整暴露的平面,切片厚度70 μm,磨片至20~30 μm。
甲苯胺蓝染色观察:光镜下观察骨缺损区及多孔钽颗粒与骨组织交界处的新骨生成及矿化情况。
四环素荧光标记检测:动物处死前1周,按50 mg/kg 剂量肌注荧光四环素。将硬组织切片采用ZEISS LSM 780激光共聚焦显微镜观察,检测波长为493~630 nm,激光强度百分比为2.6%。每张切片随机选取3个视野进行采图,将采得的图片用Image J图像处理软件设定统一灰度值,测量黄绿色荧光标记区域的面积,用以代表新骨生成面积。
CD31相关抗原抗体染色:采用免疫组化的方法,将切片进行CD31相关抗原染色,以棕黄色标记的血管内皮为标准,直径大于8个红细胞者不纳入计数。先在100×倍镜下挑选血管密度最高区域,再到400×倍镜下计数,求取3个视野平均值作为该切片血管密度。
1.5 统计学处理采用SPSS 17.0统计软件,计量结果以x±s表示,采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 大体观察术后伤口愈合佳,未见炎症表现。各时间点多孔钽材料均与周围骨组织结合良好,剖面显示新生骨组织与原有骨组织延续;空白对照组骨缺损区稍凹陷,且凹陷随时间延长而变浅(图 1)。
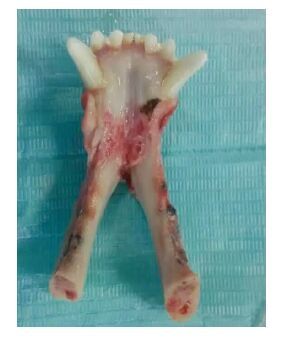
|
| 图 1 术后30 d下颌骨大体标本观察 |
2.2 X线观察
结果显示不同时间点多孔钽颗粒均与周围骨组织耦合良好,无骨吸收,实验组与周围骨组织延续情况优于对照组。空白对照组术后30 d骨缺损区见大量低密度投射区,60 d时低密度投射区减少,形成云雾状的纤维样结构,90 d时骨密度较60 d有所增高,但仍低于周围正常骨(图 2)。

|
| A:30 d;B:60 d;C:90 d 每张图片从左至右分别为:空白对照组、对照组、实验组 图 2 X线观察各组术后不同时间骨密度 |
2.3 硬组织切片观察 2.3.1 甲苯胺蓝染色
术后30 d,实验组见大量深蓝色未矿化类骨质将多孔钽颗粒包绕,多孔钽颗粒之间及其内部均有深蓝色组织长入,多孔钽颗粒与周围骨组织耦合佳;对照组蓝染区域较实验组少,空白组骨 缺损区大部分为染色阴性区域。 60 d时,实验组见骨小梁及骨陷窝等结构,多孔钽颗粒周围被成熟骨组织包绕,对照组蓝染区域较实验组多,空白组被大量空泡样脂肪组织充填。90 d时,实验组多孔钽颗粒与蓝紫色矿化骨组织紧密结合,对照组多孔钽颗粒与正常骨组织延续欠佳,空白组见大量染色阴性区域(图 3)。

|
| A:60 d实验组;B:60 d对照组;C:90 d实验组;D:90 d对照组;E:90 d空白对照组 图 3 甲苯胺蓝染色观察术后各组骨缺损修复情况 |
2.3.2 四环素荧光标记检测
术后30 d,实验组标记率高,骨矿化沉积活跃,新骨生成面积大于对照组和空白对照组,差异有统计学意义(P <0.05)。60 d时,实验组荧光减弱,对照组荧光标记率增高且高于实验组和空白对照组,差异有统计学意义(P <0.05)。90 d时,实验组仅见微弱荧光,对照组标记率有所下降,空白对照组黄绿荧光较前期有所减少,3组新骨生成面积差异无统计学意义(图 4、表 1)。此外,实验组和对照组均有黄绿色荧光条带向多孔钽颗粒内部延伸,可见明亮的黄绿色荧光呈片状分布于多孔钽颗粒中心,说明多孔钽颗粒与骨组织结合良好,新生骨组织可沿多孔钽颗粒生长,且能长入其孔隙内部。
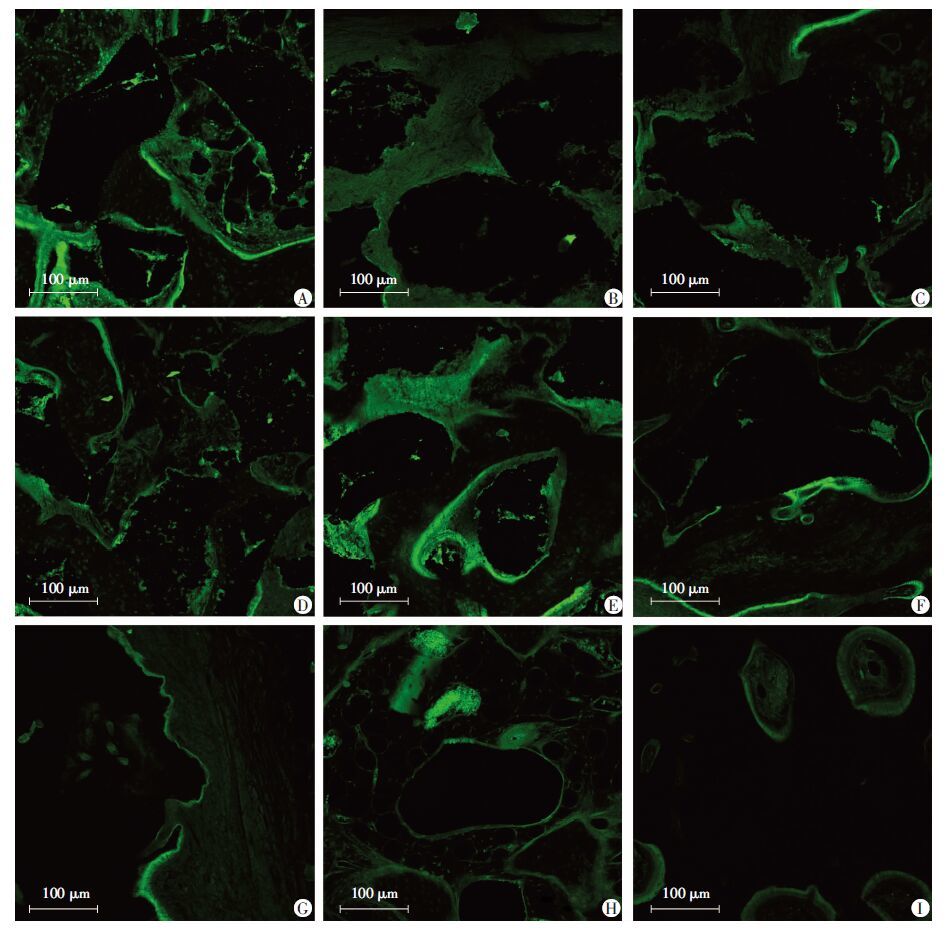
|
| A:实验组30 d;B:实验组60 d;C:实验组90 d;D:对照组30 d;E:对照组60 d;F:对照组90 d;G:空白组30 d;H:空白组60 d;I:空白组90 d 图 4 各组术后不同时间点四环素荧光标记观测新骨生成面积 (激光共聚焦显微镜) |
| 组别 | 30 d | 60 d | 90 d |
| 实验组 | 27.01±2.86ab | 22.42±2.68ab | 12.71±1.89 |
| 对照组 | 20.88±2.02 | 25.34±2.51 | 13.03±2.09 |
| 空白对照组 | 13.40±1.55a | 16.93±1.72a | 11.87±1.96 |
| a:P <0.05,与对照组比较; b:P <0.05,与空白对照组比较 | |||
2.3.3 CD31相关抗原抗体染色
术后30 d,实验组棕黄色标记率高,血管表达强,其新生微血管密度大于对照组和空白对照组,差异有统计学意义(P <0.05)。60 d时,对照组肉芽组织较多,新生微血管密度大于实验组和空白对照组,差异有统计学意义(P <0.05)。90 d时,实验组微血管数目减少至正常骨水平,对照组微血管数目较60 d时有所减少,空白组微血管数目较60 d时也有所减少,3组新生微血管密度无统计学差异(图 5、表 2)。此外,多孔钽颗粒内部有血管长入,血管长入深度可达76 μm左右。
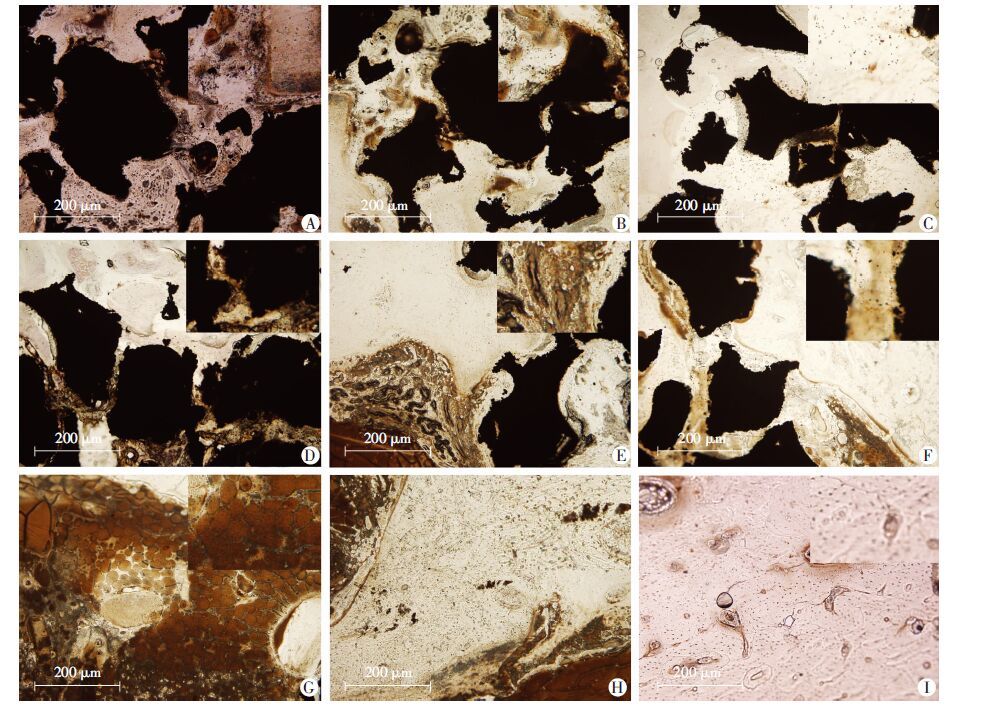
|
| A:实验组30 d;B:实验组60 d;C:实验组90 d;D:对照组30 d;E:对照组60 d;F:对照组90 d;G:空白对照组30 d;H:空白对照组60 d;I:空白对照组90 d 每张图片右上角为该图片局部放大图 图 5 各组术后不同时间CD31相关抗原抗体染色情况 |
| 组别 | 30 d | 60 d | 90 d |
| 实验组 | 108.49±3.35ab | 89.51±2.15ab | 66.12±3.24 |
| 对照组 | 86.75±1.89 | 95.91±1.98 | 67.67±3.20 |
| 空白对照组 | 78.53±1.68a | 85.92±2.33a | 68.66±2.75 |
| a:P <0.05,与对照组比较;b:P <0.05,与空白对照组比较 | |||
3 讨论
多孔钽有“小梁金属”之称,弹性模量与人体骨接近,可塑性好,耐腐蚀性极强,被视作理想的骨植入材料[6]。Moen等[7]研究发现,多孔钽金属髋臼杯用于髋臼翻修,10年之后仍无骨质溶解现象发生。Hanzlik等[8]证明多孔钽具有良好的生物相容性、骨传导性及骨诱导性。然而多孔钽和其他金属材料一样,存在着无法提供成骨所需生长因子的缺陷;作为一种不可吸收材料,其内部营养物质和氧气供应的不足可能会限制新骨生成,从而影响多孔钽与周围骨组织的生物性结合。本实验旨在将TGF-β1与多孔钽颗粒复合,制备生物活性多孔钽修复材料。
TGF-β1是一种多肽物质,能促进成骨细胞增殖和分化,刺激骨小梁骨化及微血管形成,从而对骨缺损修 复起到一定的引导作用。Ferreira等[4]研究发现TGF-β1 能促进牙槽骨缺损的愈合。Khan等[9]认为TGF-β1能刺激血管平滑肌细胞的增殖和迁移,对血管的生成及修复起一定调节作用。在TGF-β1诱导成骨的过程中,微血管的生成亦具有重要意义,新生血管不仅是氧气、营养物质和代谢产物的运输通道,还能传导信号、促进血管内皮的生长及成骨细胞的增殖和分化[10]。目前主要通过检测新生骨密度、新生骨面积、新生骨体积、新骨成熟分化程度及新生微血管数目等指标判断骨缺损修复情况,血管生成及骨再生是骨缺损修复的两个重要环节[11]。本实验通过X线观察新生骨密度,四环素免疫荧光染色标记新骨生成面积,甲苯胺蓝 染色观察新骨矿化程度,CD31标记新生微血管数目,对不同时期的骨缺损修复情况进行了较为全面的评价。
本实验将TGF-β1与多孔钽颗粒复合作为实验组,单纯多孔钽颗粒组作为对照组,统计结果示:30 d时,实验组新骨生成面积及新生微血管密度均大于对照组,差异有统计学意义(P <0.05)。60 d时,对照组新骨生成面积及新生微血管密度均大于实验组,差异有统计学意义(P <0.05)。90 d时,实验组与对照组新骨生成面积及新生微血管密度差异无统计学意义。以上结果说明TGF-β1复合多孔钽生物材料能加速骨缺损区域的早期成骨及成血管进程,对多孔钽颗粒与周围骨组织的早期生物性结合起促进作用,从而增强材料的初期稳定性,缩短骨缺损愈合时间。此研究有力验证了该材料的高促骨活性。
多孔钽颗粒良好的力学性能及生物学适应性不仅使其成为成骨细胞黏附和生长的优良支架,也让其成为充当TGF-β1载体的理想材料;TGF-β1与之复合亦解决了多孔钽颗粒修复骨缺损时不能提供成骨因子的缺陷。目前国内外尚少见TGF-β1与多孔钽颗粒联合运用于骨缺损修复的报道,本实验将两者结合运用,为临床骨缺损修复材料的研究提供相应的依据;此外,本研究证实了血管能长入多孔钽颗粒内部,并测得其长入深度可达76 μm左右。本实验不足:未进行力学实验及TGF-β1复合多孔钽生物材料促骨机制方面的研究,后续研究中需进一步观察其远期疗效,使之能更好运用于临床。
| [1] | 路建, 郑小平, 王志强. 多孔金属钽假体在骨缺损修复中 的应用[J]. 中国修复重建外科杂志,2012, 26 (2) : 244 –247. |
| [2] | 钟建鑫, 节云峰, 罗金英, 等. 多孔钽颗粒在下颌骨缺损修复中的作用[J]. 第三军医大学学报,2015, 37 (12) : 1277 –1280. DOI:10.16016/j.1000-5404.201502120 |
| [3] | Zhao D, Liu B, Wang B, et al. Autologous bone marrow mesenchymal stem cells associated with tantalum rod implantation and vascularized iliac grafting for the treatment of end-stage osteonecrosis of the femoral head[J]. Biomed Res Int,2015, 2015 : 240506 . DOI:10.1155/2015/240506 |
| [4] | Ferreira C L, Abreu F A, Silva G A, et al. TGF-β1 and BMP-4 carried by liposomes enhance the healing process in alveolar bone[J]. Arch Oral Biol,2013, 58 (6) : 646 –656. DOI:10.1016/j.archoralbio.2012.11.013 |
| [5] | 袁晟, 张志宏. 转化生长因子-β对牙种植体骨结合的影响[J]. 医学研究生学报,2012, 25 (2) : 212 –214. DOI:10.3969/j.issn.1008-8199.2012.02.025 |
| [6] | 耿丽鑫, 李琪佳. 多孔钽的生物学特性与关节重建[J]. 实用医学杂志,2014, 30 (14) : 2328 –2330. DOI:10.3969/j.issn.1006-5725.2014.14.056 |
| [7] | Moen T C, Ghate R, Salaz N, et al. A monoblock porous tantalum acetabular cup has no osteolysis on CT at 10 years[J]. Clin Orthop Relat Res,2011, 469 (2) : 382 –386. DOI:10.1007/s11999-010-1500-8 |
| [8] | Hanzlik J A, Day J S, Acknowledged Contributors: Ingrowth Retrieval Study Group. Bone ingrowth in well-fixed retrieved porous tantalum implants[J]. J Arthroplasty,2013, 28 (6) : 922 –927. DOI:10.1016/j.arth.2013.01.035 |
| [9] | Khan R, Agrotis A, Bobik A. Understanding the role of transforming growth factor-beta1 in intimal thickening after vascular injury[J]. Cardiovasc Res,2007, 74 (2) : 223 –234. DOI:10.1016/j.cardiores.2007.02.012 |
| [10] | 李守宏, 庞光明, 陈建钢. TGF-β1复合物诱导颌骨成骨过程中微血管的形成与表达[J]. 临床口腔医学杂志,2007, 23 (3) : 137 –139. DOI:10.3969/j.issn.1003-1634.2007.03.003 |
| [11] | Costa C, Soares R, Schmitt F. Angiogenesis: now and then[J]. APMIS,2004, 112 (7/8) : 402 –412. DOI:10.1111/j.1600-0463.2004.apm11207-0802.x |



