骨拟态是指肿瘤细胞转移至骨后,在骨组织中能够模拟成骨细胞并获得成骨细胞特异性表型的能力。骨转移是乳腺癌的常见并发症之一,而乳腺肿瘤较容易转移到骨组织的原因目前尚不清楚。研究发现转移至骨的乳腺癌细胞会高表达成骨细胞的部分特异性表型并且分泌骨保护素(osteoprotegerin,OPG)[1]、骨桥蛋白(osteopontin,OPN)[2]、骨钙蛋白(osteocalcin,OCN)[3]等成骨细胞所表达的骨基质蛋白,以此获得类似成骨细胞功能的特性。研究表明,肿瘤细胞骨拟态的特性能使转移至骨的肿瘤细胞逃避免疫系统的识别,给肿瘤细胞更多机会在骨组织中生存、增殖,从而让获得骨拟态表型的肿瘤细胞更容易在骨组织中定居[4]。但是肿瘤细胞骨拟态的原因一直存在争议,主要在于肿瘤细胞究竟是在肿瘤原发灶获得了骨拟态的特性所以才更容易转移至骨?还是肿瘤细胞转移至骨后在骨微环境的刺激下才获得了骨拟态的特性使之更容易在骨组织中定居?骨是前列腺癌及乳腺癌最偏好转移的部位,目前已有研究将成骨细胞与前列腺癌细胞共培养,发现成骨细胞能够促使前列腺癌细胞的骨拟态,所以我们推测肿瘤细胞的骨拟态是由骨微环境中的成骨细胞所诱导的,因此通过建立成骨细胞与乳腺癌细胞共培养体系探讨肿瘤细胞骨拟态的发生部位十分必要。其次,目前肿瘤细胞为什么能在骨组织中稳定的增殖,有研究指出,将成骨细胞MC3T3-E1与乳腺癌MDA-MB-231细胞等量共同注入小鼠股骨内,其成瘤速度及大小均优于单纯股骨内注射等量的MDA-MB-231乳腺癌细胞[5],因此我们推测成骨细胞可能对乳腺癌细胞的增殖也有一定影响。本实验通过将MC3T3-E1成骨细胞与乳腺癌MDA-MB-231细胞进行transwell共培养,观察MC3T3-E1成骨细胞是否也是促使溶骨型乳腺癌MDA-MB-231细胞骨拟态的诱因,以及成骨细胞对乳腺癌细胞增殖及集落形成的影响,旨在探讨成骨细胞在溶骨型乳腺癌细胞骨拟态过程中的作用以及对肿瘤细胞增殖的影响,为全面研究骨拟态的生物学效应及探讨肿瘤细胞的增殖奠定基础。
1 材料与方法 1.1 细胞株来源人乳腺癌MDA-MB-231细胞、小鼠MC3T3-E1成骨前体细胞购自中国科学院上海生命科学研究院细胞资源中心。
1.2 主要试剂及仪器0.25%胰酶、DMEM、α-MEM购自美国HyClone公司,胎牛血清购自美国Gibic公司,0.4 μm transwell共培养小室购自美国Millipore公司,RNAiso Plus、PrimeScript® 反转录试剂盒以及荧光染料SYBR® Premix Ex TaqTM试剂盒购自日本TaKaRa公司。CCK-8(cell counting kit-8)、BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所,OCN、OPN、OPG及GAPDH抗体购自Abcam公司。
1.3 方法 1.3.1 细胞培养成骨细胞MC3T3-E1株采用含有10%胎牛血清以及1%双抗(100 U/mL青霉素和100 μg/mL链霉素)的α-MEM培养基培养,人乳腺癌细胞株MDA-MB-231细胞采用含有10%胎牛血清以及1%双抗(100 U/mL青霉素和100 μg/mL链霉素)DMEM高糖培养基培养。两种细胞均置于37 ℃、5% CO2细胞培养箱培养,每2天换液1次,等到细胞生长至对数生长期时用0.25%胰酶消化,备用。
1.3.2 细胞共培养采用0.4 μm Transwell小室置于6孔板上构建共培养体系,并分为实验组和对照组。取1.3.1步骤中对数生长期的MC3T3-E1及MDA-MB-231细胞,实验组上层接种1.5×105 MC3T3-E1并用配好的α-MEM培养基培养,下层接种1.5×105 MDA-MB-231细胞并用配好的DMEM高糖培养基培养,对照组上、下室均接种相同数量的MDA-MB-231细胞并用DMEM高糖培养基培养。将接种好的细胞 置于恒温箱中培养,每2天更换培养基1次,共培养5 d 后进行后续实验,将实验组及对照组下层的乳腺癌细胞取出并分别标记为231-OB及231。
1.3.3 实时荧光定量PCR检测2组OPN、OPG、OCN mRNA表达将2组MDA-MB-231细胞提取RNA,采用RNAiso Plus将2组总的RNA提出后在微量核酸仪DM-2000测定其浓度和纯度,选取符合条件的样本[D(260)/D(280)为1.8~2.0],采用PrimeScript® 反转录试剂盒以及荧光染料SYBR® Premix Ex TaqTM试剂盒进行反转录及扩增,OPG、OPN、OCN mRNA引物由宝生物(大连)工程有限公司合成,选用GAPDH作为内参,所选目的基因及内参基因序列见表 1。检测时每个样本设置3个复孔。实验重复3遍,最终数据以2-ΔΔCt表示目的基因mRNA水平并绘制柱状图。
| 基因 | 引物序列(5′→3′) | 退火温度 |
| GAPDH | 上游:TGGCAAAGTGGAGATTGTTGCC 下游: AAGATGGTGATGGGCTTCCCG | 60 ℃ |
| OCN | 上游:TGACGAGTTGGCTGACCACATC 下游:AGGAAAGAAGGGTGCCTGGAGA | 60 ℃ |
| OPG | 上游:GCACGCACTAAAGCACTCAAAGAC 下游:TGTGAAGCTGTGAAGGAACCTGATG | 60 ℃ |
| OPN | 上游:ACAGCCGTGGGAAGGACAGTTA 下游:ACATCGGAATGCTCATTGCTCTCA | 60 ℃ |
| OPG:骨保护素;OPN:骨桥蛋白;OCN:骨钙蛋白 | ||
收集1.3.2步骤中2组细胞,使用RIPA裂解液提取2组蛋白并分别标记为231-OB及231。BCA试剂盒测定蛋白浓度后,取出蛋白并加入等体积的上样缓冲液后煮沸5 min。将变性后的蛋白溶液50 μg/孔等量上样,行SDS-PAGE(10%分离胶和4%浓缩胶)电泳,然后用电转膜仪将蛋白转移至PVDF膜上,放入5%脱脂奶粉中封闭,加入一抗体(鼠抗OPN,1 :1 000;鼠抗OCN,1 :1000;兔抗OPG,1 :1 000;鼠抗GAPDH,1 :3 000)4 ℃过夜,TBST缓冲液清洗3次,加二抗(山羊抗小鼠IgG,山羊抗兔IgG),37 ℃ 孵育2 h,行免疫印迹检测后ECL发光试剂盒发光并胶片曝光,常规显影、定影后行灰度值分析。
1.3.5 细胞集落实验检测2组细胞集落形成能力共培养5 d后将2组细胞的培养板取出并弃去上层小室,吸去下层小室培养MDA-MB-231细胞的培养液,并用PBS溶液洗涤下层细胞贴壁2次,每孔加1 mL 10%甲醇溶液固定细胞30 s。吸去甲醇溶液,每孔加1 mL结晶紫染液,室温中放置20 min。轻轻吸去染色液,用蒸馏水洗涤各孔3次,将培养板倒置于吸水纸上将水分吸干,自然干燥,100倍视野下选取5个视野观察肿瘤细胞集落形成数量及大小。
1.3.6 CCK-8法检测2组细胞的增殖差异实验组采用Transwell共培养体系将MDA-MB-231细胞接 种于24孔板下室,加入含有1.0×104/mL MDA-MB-231的DMEM培养基1 mL,上室接种含有1.0×104/mL MC3T3-E1的α-MEM培养基1 mL。对照组上、下室均接种含有1.0×104/mL乳腺癌细胞的DMEM培养基1 mL。分别继续培养24、48、72 h后,取出2组上层小室并加入CCK-8反应试剂100 μL/孔,置于37 ℃细胞培养箱中反应2 h后取出,2组各取100 μL反应液加入96孔板中,每组设6个复孔。酶联免疫检测仪检测450 nm波长处各孔的光密度值[D(450)],以时间为横坐标,D(450)值为纵坐标绘制细胞增殖曲线,实验重复3次。
1.4 统计学方法采用SPSS 16.0统计软件,计量数据以x±s表示,行t检验分析。检验标准α=0.05。
2 结 果 2.1 共培养5 d后2组OCN、OPN、OPG的基因表达差异实验组将与MC3T3-E1共培养5 d的MDA-MB-231细胞与对照组未和MC3T3-E1细胞共培养的MDA-MB-231细胞进行PCR检测,实验组成骨相关基因OCN、OPN、OPG的表达水平显著高于对照组,差异具有统计学意义(P<0.05,图 1)。
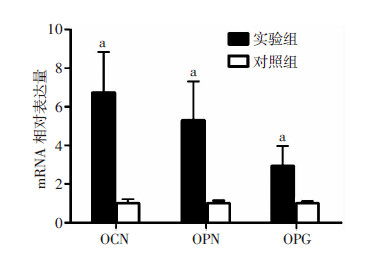 |
| a:P<0.05,与对照组比较 图 1 实时荧光定量PCR法检测2组成骨相关基因的表达差异(n=3, x±s) |
共培养5 d后实验组OCN(0.89±0.07)、OPN(1.19±0.08)、OPG(0.30±0.05)的表达显著高于对照组[OCN(0.42±0.04)、OPN(0.51±0.05)、OPG (0.16±0.03)],差异具有统计学意义(P<0.05,图 2)。
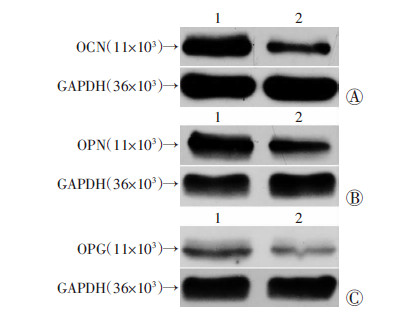 |
| 1:实验组;2:对照组 A:OCN;B:OPN;C:OPG 图 2 Western blot法检测2组OCN、OPN、OPG的蛋白表达差异 |
实验组在集落形成数量及大小上均优于对照组,证实成骨前体细胞MC3T3-E1与乳腺癌MDA-MB-231共培养后有明显刺激乳腺癌细胞集落形成及增殖的作用(图 3)。
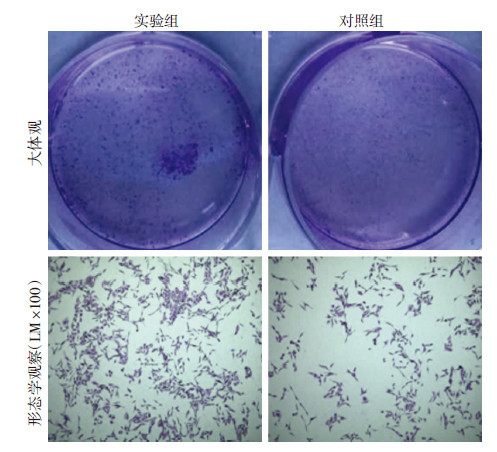 |
| 图 3 结晶紫染色法观察实验组及对照组的乳腺癌细胞集落形成能力 |
CCK-8法检测显示,实验组与对照组MDA-MB-231细胞24 h增殖差异无统计学意义(P>0.05),48、72 h MC3T3-E1具有明显促进MDA-MB-231细胞增殖的作用(P<0.01,图 4)。
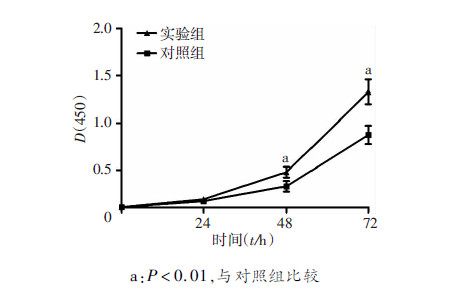 |
| a:P<0.01,与对照组比较 图 4 CCK-8法检测实验组与对照组MDA-MB-231细胞的增殖能力差异 (n=3, x±s) |
乳腺癌及前列腺癌细胞转移至骨后在骨组织中均会发生骨拟态的改变,其原因尚不清楚,但目前可以肯定的是肿瘤细胞这种骨拟态特性使肿瘤细胞更容易在骨微环境中生存[4, 6]。成骨细胞可引起前列腺癌细胞的骨拟态[7],骨又是前列腺癌以及乳腺癌最偏好转移的部位,且有研究表明将成骨细胞与具有肿瘤干细胞相似特性的乳腺癌侧群细胞共培养后能够高表达Wnt-1及Runx2等成骨分化相关转录因子,乳腺癌细胞一旦高表达这些转录因子其骨转移能力增强[8, 9]。所以我们推测成骨细胞也可以诱导乳腺癌细胞高表达成骨相关的基因及蛋白(如OCN、OPN、OPG),并以此表现出骨拟态的特性使其在骨组织中稳定生存。其次,乳腺癌细胞转移至骨组织后能在骨微环境中快速增殖,这与肿瘤细胞转移至骨后激活破骨细胞并破坏骨组织释放一些肿瘤生长因子相关,如转化生长因子(transforming growth factor-β,TGF-β)、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)、成纤维细胞生长因子(fibroblast growth factors,FGFs)及血小板衍生生长因子(platelet-derived growth factor,PDGF)等[10, 11],而这些生长因子反过来能够刺激肿瘤细胞的生长,从而形成著名的“恶性循环”理论。然而动物实验表明,将MC3T3-E1成骨细胞与乳腺癌MDA-MB-231细胞共同注入小鼠股骨内,其肿瘤形成速度、大小均有明显的促进作用[5],这提示了我们肿瘤细胞在骨微环境中的增殖除了经典的“恶性循环”理论外,成骨细胞也可能直接促进肿瘤细胞的增殖。
本实验通过将MC3T3-E1与MDA-MB-231细胞共培养,检测实验组及对照组乳腺癌MDA-MB-231细胞OCN、OPN及OPG的表达差异,以此探讨乳腺癌细胞骨拟态的可能发生部位。实验结果表明共培养后乳腺癌细胞OCN、OPN及OPG的表达均有明显上调,证明了成骨细胞可促使乳腺癌细胞表达骨拟态的特性。近些年的研究表明OPG在乳腺癌细胞中的表达与肿瘤细胞的克隆及归巢相关,并且能够保护肿瘤细胞不被TRAIL介导的凋亡所伤害[12]。OPN在肿瘤细胞中过表达有助于肿瘤细胞的增殖及侵袭,并且OPN的表达增高在肿瘤细胞的转移过程中也扮演着重要角色[13, 14],所以肿瘤细胞一旦在骨组织中高表达OPG及OPN后转移能力增强,更多的肿瘤细胞转移至骨后又会在成骨细胞的诱导下发生骨拟态以此恶性循环,这也可能是肿瘤细胞在骨微环境中增殖较快的原因之一,但进一步的研究仍需动物实验的支持。其次,本实验证明了在成骨细胞的诱导下乳腺癌细胞的增殖能力及集落形成能力增强,其作用机制可能为PDGF是肿瘤细胞的重要生长因子,MDA-MB-231乳腺癌细胞本身能够自分泌PDGF。有研究报道成骨细胞条件培养基可促使MDA-MB-231细胞高表达PDGF受体[15],这可能是成骨细胞促进乳腺癌细胞增殖的原因之一,值得进一步研究。
综上所述,在与成骨细胞共培养的条件下,乳腺癌细胞的增殖能力增强说明了成骨细胞可直接促进肿瘤细胞增殖。这也提醒我们,以往将肿瘤细胞在骨微环境中增殖的注意力过多地集中在破骨细胞上,然而成骨细胞同样能够促进肿瘤细胞增殖。 其次本实验通过共培养模型,从细胞层面探讨MC3T3-E1成骨前体细胞对乳腺癌MDA-MB-231细胞表达骨拟态特征的正向调控现象,证实乳腺癌细胞的骨拟态也是由成骨细胞引起的,进一步支持肿瘤细胞骨拟态特性可能是在骨微环境中形成的理论,为深入探讨肿瘤细胞骨拟态的生物学效应奠定基础。目前骨拟态相关研究仍然处于初步阶段。有研究表明前列腺癌骨拟态的发生机制可能和Notch 及ERK信号通路有关[16],那么在骨微环境中,成骨细胞是否也能激活乳腺癌细胞的Notch及ERK通路并由此表现出骨拟态的特性,值得进一步研究。
| [1] | Weichhaus M, Segaran P, Renaud A, et al. Osteoprotegerin expression in triple-negative breast cancer cells promotes metastasis[J]. Cancer Med, 2014, 3(5): 1112-1125. DOI: 10.1002/cam4.277 |
| [2] | Rose A A, Siegel P M. Breast cancer-derived factors facilitate osteolytic bone metastasis[J]. Bull Cancer, 2006, 93(9): 931-943. |
| [3] | Salem A M, Zohny S F, Abd-El-Wahab M M, et al. Predictive value of osteocalcin and beta-CrossLaps in metastatic breast cancer[J]. Clin Biochem, 2007, 40(16/17): 1201-1208. DOI: 10.1016/j.clinbiochem.2007.07.006 |
| [4] | Rucci N, Teti A. Osteomimicry: how tumor cells try to deceive the bone[J]. Front Biosci (Schol Ed), 2010, 2: 907-915. |
| [5] | Bodenstine T M, Beck B H, Cao X, et al. Pre-osteoblastic MC3T3-E1 cells promote breast cancer growth in bone in a murine xenograft model[J]. Chin J Cancer, 2011, 30(3): 189-196. |
| [6] | Cox R F, Jenkinson A, Pohl K, et al. Osteomimicry of mammary adenocarcinoma cells in vitro; increased expression of bone matrix proteins and proliferation within a 3d collagen environment[J]. PLoS One, 2012, 7(7): e41679. DOI: 10.1371/journal.pone.0041679 |
| [7] | Knerr K, Ackermann K, Neidhart T, et al. Bone metastasis: Osteoblasts affect growth and adhesion regulons in prostate tumor cells and provoke osteomimicry[J]. Int J Cancer, 2004, 111(1): 152-159. DOI: 10.1002/ijc.20223 |
| [8] | 杨晓宁, 周艳, 齐晓伟, 等. 成骨细胞诱导乳腺癌侧群细胞获得骨模拟特性的研究[J]. 第三军医大学学报, 2013, 35(11): 1102-1106. |
| [9] | Baniwal S K, Khalid O, Gabet Y, et al. Runx2 transcriptome of prostate cancer cells: insights into invasiveness and bone metastasis[J]. Mol Cancer, 2010, 9: 258. DOI: 10.1186/1476-4598-9-258 |
| [10] | Chappard D, Bouvard B, Basle M F, et al. Bone metastasis: histological changes and pathophysiological mechanisms in osteolytic or osteosclerotic localizations. A review[J]. Morphologie, 2011, 95(309): 65-75. DOI: 10.1016/j.morpho.2011.02.004 |
| [11] | Zhang Y, Ma B, Fan Q. Mechanisms of breast cancer bone metastasis[J]. Cancer Lett, 2010, 292(1): 1-7. DOI: 10.1016/j.canlet.2009.11.003 |
| [12] | Kapoor P, Suva L J, Welch D R, et al. Osteoprotegrin and the bone homing and colonization potential of breast cancer cells[J]. J Cell Biochem, 2008, 103(1): 30-41. DOI: 10.1002/jcb.21382 |
| [13] | Hou X, Wu X, Huang P, et al. Osteopontin is a useful predictor of bone metastasis and survival in patients with locally advanced nasopharyngeal carcinoma[J]. Int J Cancer, 2015, 137(7): 1672-1678. DOI: 10.1002/ijc.29540 |
| [14] | Kruger T E, Miller A H, Godwin A K, et al. Bone sialoprotein and osteopontin in bone metastasis of osteotropic cancers[J]. Crit Rev Oncol Hematol, 2014, 89(2): 330-341. DOI: 10.1016/j.critrevonc.2013.08.013 |
| [15] | Brama M, Basciani S, Cherubini S, et al. Osteoblast-conditioned medium promotes proliferation and sensitizes breast cancer cells to imatinib treatment[J]. Endocr Relat Cancer, 2007, 14(1): 61-72. DOI: 10.1677/erc.1.01307 |
| [16] | Zayzafoon M, Abdulkadir S A, McDonald J M. Notch signaling and ERK activation are important for the osteomimetic properties of prostate cancer bone metastatic cell lines[J]. J Biol Chem, 2004, 279(5): 3662-3670. DOI: 10.1074/jbc.M308158200 |



