肾素-血管紧张素系统(renin-angiotensin system,RAS)是人体重要的调节系统。RAS的异常与众多心血管疾病的发生、发展有着密切的关系[1]。血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)是RAS最重要的组成部分,它的受体为血管紧张素受体(angiotensin Ⅱ receptor),其中最主要的受体是AT1和AT2。AngⅡ主要与AT1结合,具有促进细胞增殖、增强氧化应激、收缩血管等作用[2]。Ang1-7在1988年被首次发现。研究证明Ang1-7在诸多方面与AngⅡ作用相反[3]。在体内,AngⅠ和AngⅡ经酶切作用转化为Ang1-7。Ang1-7的内源性属性以及对心血管系统全面的保护作用使其有成为临床药物的潜力[4]。但是,Ang1-7的作用机制目前仍不清楚。本研究旨在探索AngⅡ存在条件下,Ang1-7对心室成纤维细胞的作用,探讨其可能机制,为Ang1-7的进一步研究及临床应用提供理论基础。
1 材料与方法 1.1 主要试剂及动物清洁级新生1~3 d SD乳鼠购自重庆医科大学实验动物中心,体质量12~20 g,雌雄不限。主要试剂:DMEM高糖培养基、胎牛血清(美国Gibco公司),CCK-8(日本同仁公司),Ⅱ型胶原酶(美国Invitrogen公司),AngⅡ、Ang1-7、胰蛋白酶、Rad抗体(美国Sigma-Aldrich公司),波形蛋白抗体、Rac1抗体、CTGF抗体(美国Santa Cruz公司),P65抗体、Nox2抗体(美国Proteintech公司),Tubulin抗体、FITC标记的山羊抗兔抗体、辣根过氧化物酶HRP标记的抗体(碧云天公司),RT-PCR试剂盒(日本TaKaRa公司)。
1.2 原代心室成纤维细胞的培养与鉴定取SD大鼠15只,在无菌条件下开胸取出心脏,分离出心室,用0.01 mol/L PBS清洗心室(冰上)。将心室剪成1 mm3大小的组织块,加入0.08%Ⅱ型胶原酶和0.125%胰蛋白酶,37 ℃水浴消化10 min,吸出上清液。在上清液中加入等体积含10%胎牛血清(FBS)的DMEM中和并离心,所得细胞用10%FBS DMEM重悬。向剩余组织加入胶原酶和胰蛋白酶消 化,共消化5次。最终将所得细胞混匀,接种于培养瓶,于37 ℃、 5%CO2培养90 min,更换培养液。实验采用第2~3代细胞。采用波形蛋白免疫荧光法鉴定成纤维细胞,并设置对照组,对照组不加波形蛋白一抗。
1.3 CCK-8法检测AngⅡ、Ang1-7对成纤维细胞增殖的影响取成纤维细胞以9 000个/孔的密度接种于96孔板,待细胞贴壁后,全部细胞无血清处理12 h。完全随机化分组为对照组、AngⅡ组、Ang1-7组和AngⅡ+Ang1-7组。 对照组不予处理。 AngⅡ组与Ang1-7组分 别加入Ang Ⅱ、Ang1-7,AngⅡ+Ang1-7组先加Ang1-7 处理30 min,再加入 AngⅡ 处理。药物终浓度为10-6 mol/L,共处理12 h。然后加入配好的CCK-8,于37 ℃、5%CO2孵育2 h。用酶标仪在450 nm波长下检测各孔的[D(450)]值,按公式计算细胞活性。细胞活 性=[实验组平均D(450)值-阴性对照组D(450)值]/[对照组平均D(450)值-阴性对照组D(450)值]。
1.4 Western blot 检测Rac1、Rad、Nox2、CTGF、P65的表达各组细胞先用无血清DMEM处理12 h,再加入各组对应药物处理24 h。收集各组细胞,弃去培养基,用预冷0.01 mol/L PBS洗涤。加入细胞裂解液在冰上裂解并提取各组细胞蛋白。取等质量上述蛋白进行SDS-PAGE电泳,采用湿转法转移至PVDF膜上,室温封闭90 min,加一抗4 ℃过夜,PBST漂洗3次,加含有辣根过氧化物酶HRP标记的二抗于37 ℃孵育60 min。采用ECL化学发光法显色,采用Qunatity One软件分析结果,用Tubulin蛋白进行校正。
1.5 荧光定量PCR检测Ⅰ型、Ⅲ型胶原蛋白和纤维连接蛋白mRNA的表达用RNA提取试剂(RNAiso plus)提取各组细胞总RNA,并逆转录为cDNA。引物序列:Ⅰ型胶原蛋白,上游5′-ATCTCCTGGTGCTGATGGAC-3′,下游5′-GCC-TCTTTCTCCTCTCTGACC-3′,109 bp; Ⅲ型胶原蛋白,上游5′-AAGGGCAGGGAACAACTGAT-3′,下游5′-AG-CAGGGTGAGAAGAAACCA-3′,136 bp;纤维连接蛋白,上游5′-ACAACCAGAGGAGGCACAAG-3′,下游5′-CC-GTGTAAGGGTCAAAGCAT-3′,108 bp;GAPDH,上游5′- CAGGAGGCATTGCTGATGAT-3′,下游 5′-GAAGG-CTGGGGCTCATTT-3′,138 bp。反应体系25 μL。PCR反应条件:95 ℃预变性30 s,95℃变性5 s,60 ℃退火30 s,共40个循环。
1.6 统计学分析采用SPSS 20.0统计软件,结果以x ±s表示。多组数据间比较采用单因素方差分析。两两比较采用LSD检验。
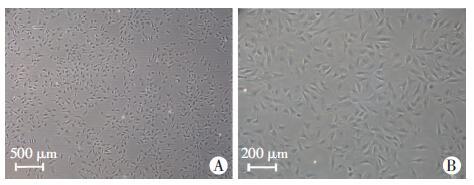
2 结果 2.1 SD大鼠心室成纤维细胞的分离培养细胞悬液培养90 min后,成纤维细胞贴壁,呈圆形,黑点状。培养24 h后,细胞向外伸出突起,呈不规则三角形或长梭形,细胞质透光性高,中央有卵原核(图 1A)。3~4 d后,细胞密集排列,成铺路石样(图 1B)。
|
| A:24 h;B:72 h 图 1 倒置显微镜下观察SD大鼠心室成纤维细胞 |
2.2 SD大鼠心室成纤维细胞波形蛋白的鉴定
心肌细胞增殖能力差,在培养过程中大多从瓶壁脱落。差速贴壁法培养所剩细胞为成纤维细胞、少量平滑肌细胞和内皮细胞。波形蛋白免疫荧光鉴定显示,细胞均能发绿光。对照组仅有极为微弱的荧光,为抗体非特异性结合所致。DAPI染核呈深蓝色(图 2)。阳性率>97%。

|
| A:波形蛋白;B:DAPI;C:波形蛋白+DAPI 图 2 免疫荧光观察SD大鼠心室成纤维细胞波形蛋白及DAPI定位 |
2.3 AngⅡ、Ang1-7对成纤维细胞增殖的影响
药物作用12 h后,与对照组(0.488 9±0.016 4) 比较,AngⅡ组(0.593 4±0.037 4)细胞数量明显增加(P<0.05),Ang1-7组(0.491 1±0.020 9)变化不明显(P>0.05)。与AngⅡ组比较,AngⅡ+Ang1-7组细胞数量减少(0.495 5±0.018 4,P<0.05)。
2.4 AngⅡ、Ang1-7对成纤维细胞Rac1、Rad蛋白表达的影响AngⅡ、Ang1-7作用24 h后,与对照组比较,AngⅡ组Rac1蛋白表达升高,Rad蛋白表达下降(P<0.05),Ang1-7组两种蛋白表达量改变不明显(P>0.05)。与AngⅡ组比较,AngⅡ+Ang1-7组Rac1表达下降,Rad蛋白表达升高(P<0.05,图 3)。

|
| A:Western blot检测;B:半定量分析 Rac1:n=6;Rad:n=5; a:P<0.05,与对照组比较;b:P<0.05,与AngⅡ组比较 图 3 Western blot检测各组成纤维细胞Rac1、Rad蛋白的表达 |
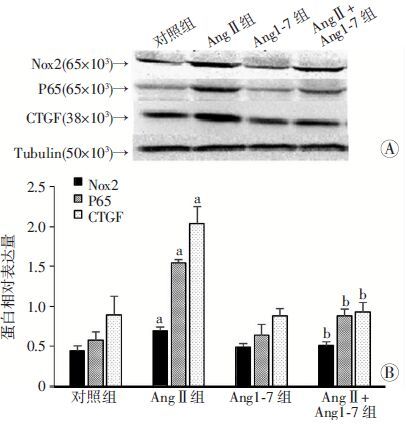
2.5 AngⅡ、Ang1-7对成纤维细胞Nox2、P65、CTGF蛋白表达的影响
AngⅡ、Ang1-7作用24 h后,与对照组比较,AngⅡ组Nox2、P65、CTGF蛋白表达均明显升高(P<0.05),Ang1-7组Nox2、P65、CTGF蛋白表达与对照组相似(P>0.05)。与AngⅡ组比较,AngⅡ+Ang1-7组3种蛋白表达均下降(P<0.05,图 4)。
|
| A:Western blot检测;B:半定量分析 Nox2:n=5;P65、CTGF: n=6;a:P<0.05,与对照组比较;b:P<0.05,与Ang Ⅱ 组比较 图 4 Western blot检测各组成纤维细胞Nox2、P65、CTGF蛋白的表达 |
2.6 AngⅡ、Ang1-7对成纤维细胞Ⅰ型、Ⅲ型胶原蛋白及纤维连接蛋白mRNA表达的影响
与对照组比较,AngⅡ组Ⅰ型、Ⅲ型胶原蛋白和纤维连接蛋白的mRNA表达分别增加了1.07、0.73、1.33倍(P<0.05,n=3)。Ang1-7组与对照组比较,差异无统计学意义(P>0.05)。与AngⅡ组比较,AngⅡ+Ang1-7组Ⅰ型、Ⅲ型胶原蛋白和纤维连接蛋白的mRNA表达分别下降了25.6%、34.1%、31.8%(P<0.05,n=3)。
3 讨论高血压、冠心病、心肌梗死等常见心血管疾病往往造成心肌原发性损伤,加重心脏负荷。此时,机体激活RAS,心脏进入代偿状态。活化的RAS能增强心脏收缩力,收缩外周血管,调节血液再分配。RAS在心脏代偿过程中发挥了重要作用。但是,RAS持续激活也带来一系列副反应:心肌细胞肥大,细胞外基质堆积,心肌间质纤维化,心室肥厚,心腔扩大。这些改变统称为心室重塑。心室重塑作为心脏的代偿性表现,随着基础疾病不断进展,最终导致心力衰竭。因此,调节RAS的状态成为治疗各种心血管疾病的常用策略。在RAS系统中,血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)水解AngⅠ生成Ang1-9,Ang1-9进一步被血管紧张素转换酶(angiotensin converting enzyme,ACE)水解为Ang1-7。ACE2也能直接水解AngⅡ,生成Ang1-7[5]。大量研究表明Ang1-7作为RAS的组成部分,能对抗AngⅡ的作用,对RAS起负性调节作用[6]。Qi等[7]的研究证明:使用慢病毒在心室过表达Ang1-7,能有效减轻心肌梗死后的心室重塑,改善各项心功指标。McCollum等[8]的研究发现Ang1-7能够抑制由AngⅡ诱导的细胞增殖,下调胶原蛋白表达。表明Ang1-7参与了细胞外基质合成的调节。目前,越来越多的研究关注于Ang1-7的功能,试图将其用于临床心血管疾病治疗,本研究的结果补充了Ang1-7的作用机制。
Rac1蛋白是Rho GTP酶家族的一员。Rac1与动脉粥样硬化、高血压、心脏重构等均有关系[9]。研究显示:房颤患者的心房组织Rac1活性普遍升高。 Adam等[10]进一步使用转基因老鼠实验,发现高表达Rac1的老鼠更容易出现房颤。现已阐明:Rac1能与gp91phox (Nox2)、gp65phox结合,共同构成还原性辅酶Ⅱ氧化酶复合体(NADPH oxidase),进而增强结缔组织生长因子(CTGF)的表达[11]。另一方面,Rac1组成NADPH氧化酶后,还能激活下游的NF-kB因子[12-13]。CTGF与NF-kB是心室重塑的关键因子。本研究中,AngⅡ组成纤维细胞Rac1、Nox2、P65和CTGF蛋白表达明显升高。而当Ang1-7存在时,这4种蛋白表达显著下降。 提示:Ang1-7能对抗AngⅡ对成纤维细胞的刺激作用,Ang1-7通过下调Rac1蛋白表达,进而减少NADPH 氧化酶形成,抑制P65和CTGF生成,减少细胞外基质的合成。
Rad是相对分子质量为35×103的GTP酶,属于RGK GTP酶家族。RGK家族还包括Rem1、Rem2、Gem/Kir。Rad普遍存在于细胞膜、细胞质、细胞核,并且可以在胞质与胞核间穿梭[14]。Rad在心脏组织表达较高,提示其与心脏功能之间关系紧密[15]。最新研究证实:心衰患者和心脏肥大患者心脏组织中Rad的量显著减少,敲除Rad基因的老鼠更易出现心脏肥大[16]。本研究中,AngⅡ抑制心室成纤维细胞表达Rad蛋白。Ang1-7能减弱AngⅡ对成纤维细胞的抑制作用,回调Rad的表达。回升的Rad能够在细胞核结合活化的P65,阻止其结合DNA,抑制下游基因的表达[17]。同时,Rad抑制了CTGF的转录[18]。Ang1-7通过上述作用抑制成纤维细胞表达胶原蛋白和纤维连接蛋白。
综上所述,本研究证明Ang1-7能减弱AngⅡ对心室成纤维细胞的作用。Ang1-7可通过两种途径产生作用:①Ang1-7下调Rac1的表达,进而抑制NADPH氧化酶形成,抑制P65、CTGF表达;②Ang1-7上调Rad的表达,增多的Rad能够抑制P65与DNA结合,同时抑制CTGF转录。Ang1-7通过影响上述两条信号通路,使成纤维细胞合成细胞外基质减少。这一机制可能是Ang1-7在体内产生保护作用的机制之一。但是,当单独作用于成纤维细胞时,Ang1-7对上述各蛋白的调节并不明显。目前普遍认为Ang1-7主要通过结合Mas受体产生作用。本研究中Ang1-7产生的作用是否由Mas受体介导仍需研究证实。
| [1] | Mansur S J, Hage F G, Oparil S. Have the renin-angiotensin-aldosterone system perturbations in cardiovascular disease been exhausted?[J]. Curr Cardiol Rep,2010, 12 (6) : 450 –463. DOI:10.1007/s11886-010-0140-7 |
| [2] | Underwood P C, Adler G K. The renin angiotensin aldosterone system and insulin resistance in humans[J]. Curr Hypertens Rep,2013, 15 (1) : 59 –70. DOI:10.1007/s11906-012-0323-2 |
| [3] | Iwai M, Horiuchi M. Role of the ACE2/angiotensin1-7/Mas axis in the cardiovascular system[J]. Hypertens Res,2010, 33 (11) : 1108 –1109. DOI:10.1038/hr.2010.164 |
| [4] | Westermeier F, Bustamante M, Pavez M, et al. Novel players in cardioprotection: Insulin like growth factor-1, angiotensin-(1-7) and angiotensin-(1-9)[J]. Pharmacol Res,2015, 101 : 41 –55. DOI:10.1016/j.phrs.2015.06.018 |
| [5] | Lee V C, Lloyd E N, Dearden H C, et al. A systematic review to investigate whether Angiotensin-(1-7) is a promising therapeutic target in human heart failure[J]. Int J Pept,2013, 2013 : 260346 . DOI:10.1155/2013/260346 |
| [6] | McKinney C A, Fattah C, Loughrey C M, et al. Angiotensin-(1-7) and angiotensin-(1-9): function in cardiac and vascular remodelling[J]. Clin Sci (Lond),2014, 126 (12) : 815 –827. DOI:10.1042/CS20130436 |
| [7] | Qi Y, Shenoy V, Wong F, et al. Lentivirus-mediated overexpression of angiotensin-(1-7) attenuated ischaemia-induced cardiac pathophysiology[J]. Exp Physiol,2011, 96 (9) : 863 –874. DOI:10.1113/expphysiol.2011.056994 |
| [8] | McCollum L T, Gallagher P E, Tallant E A. Angiotensin-(1-7) abrogates mitogen-stimulated proliferation of cardiac fibroblasts[J]. Peptides,2012, 34 (2) : 380 –388. DOI:10.1016/j.peptides.2012.01.020 |
| [9] | Elnakish M T, Hassanain H H, Janssen P M, et al. Emerging role of oxidative stress in metabolic syndrome and cardiovascular diseases: important role of Rac/NADPH oxidase[J]. J Pathol,2013, 231 (3) : 290 –300. DOI:10.1002/path.4255 |
| [10] | Adam O, Frost G, Custodis F, et al. Role of Rac1 GTPase activation in atrial fibrillation[J]. J Am Coll Cardiol,2007, 50 (4) : 359 –367. |
| [11] | Adam O, Lavall D, Theobald K, et al. Rac1-induced connective tissue growth factor regulates connexin 43 and N-cadherin expression in atrial fibrillation[J]. J Am Coll Cardiol,2010, 55 (5) : 469 –480. DOI:10.1016/j.jacc.2009.08.064 |
| [12] | Hong D, Bai Y P, Shi R Z, et al. Inhibitory effect of reinioside C on vascular smooth muscle cells proliferation induced by angiotensin Ⅱ via inhibiting NADPH oxidase-ROS-ENK1/2-NF-kappaB-AP-1 pathway[J]. Pharmazie,2014, 69 (9) : 698 –703. |
| [13] | Higuchi Y, Otsu K, Nishida K, et al. The small GTP-binding protein Rac1 induces cardiac myocyte hypertrophy through the activation of apoptosis signal-regulating kinase 1 and nuclear factor-kappa B[J]. J Biol Chem,2003, 278 (23) : 20770 –20777. |
| [14] | Buraei Z, Lumen E, Kaur S, et al. RGK regulation of voltage-gated calcium channels[J]. Sci China Life Sci,2015, 58 (1) : 28 –38. DOI:10.1007/s11427-014-4788-x |
| [15] | Reynet C, Kahn C R. Rad: a member of the Ras family overexpressed in muscle of type Ⅱ diabetic humans[J]. Science,1993, 262 (5138) : 1441 –1444. |
| [16] | Chang L, Zhang J, Tseng Y H, et al. Rad GTPase deficiency leads to cardiac hypertrophy[J]. Circulation,2007, 116 (25) : 2976 –2983. |
| [17] | Hsiao B Y, Chang T K, Wu I T, et al. Rad GTPase inhibits the NFkappaB pathway through interacting with RelA/p65 to impede its DNA binding and target gene transactivation[J]. Cell Signal,2014, 26 (7) : 1437 –1444. DOI:10.1016/j.cellsig.2014.03.003 |
| [18] | Zhang J, Chang L, Chen C, et al. Rad GTPase inhibits cardiac fibrosis through connective tissue growth factor[J]. Cardiovasc Res,2011, 91 (1) : 90 –98. DOI:10.1093/cvr/cvr068" |



