基因治疗在许多疾病如肿瘤、先天性免疫缺陷、心血管病、先天性失明和神经系统退行性病变中具有广阔的应用前景[1]。基因载体的选择是基因治疗成功的关键。基因载体分为病毒载体和非病毒载体两大类。病毒载体具有较高的转染效率,因而在生物医学研究中应用广泛。然而,病毒载体具有免疫原性、致癌和致突变等潜在安全威胁,且构建造价昂贵,故而限制了其在临床治疗中的应用[2]。与病毒载体相比较,非病毒类载体如阳离子脂质体、高分子聚合物和纳米颗粒等具有低免疫原性、低细胞毒性、价格低廉、制备简易和较好的生物相容性等优点而成为当今基因治疗研究的热点[3, 4]。其中,纳米颗粒具有小尺寸效应、表面效应等优势,可以包裹、浓缩、保护核酸分子,使其免受核酸酶降解;通过表面修饰功能化,能够连接特异性靶向分子,并具有在体内循环时间明显长于普通颗粒的优点[5, 6, 7]。基于此,我们拟设计、制备合适的基因载体,使其能够高效输送基因进入靶细胞,有效地发挥基因治疗的作用。
粒径在1~100 nm的纳米金(Au nanoparticles)是惰性物质,制备方法简易,具有良好的生物相容性和表面易于功能化等优点,是良好的药物输送载体[8, 9, 10]。1995年Boussif[11]等首次报道了聚乙烯亚胺(polyethyleneimine,PEI)可作为基因载体用于体外和体内实验研究。聚乙烯亚胺是迄今为止转染效率最高的阳离子聚合物之一。PEI单体中含有2个碳原子和1个氮原子,因此分支状的PEI分子中可含有伯胺、仲胺和叔胺,且每个氨基都能质子化[12]。聚乙烯亚胺富含氨基,具有“质子海绵效应”,带正电荷的氨基基团能与DNA分子中带负电荷的磷酸基团通过静电吸附作用相互结合,所形成的复合物能被细胞内吞[13]。该复合物的转染效率是基于PEI具有较强的结合和压缩DNA能力,能使DNA逃脱体内溶酶体的吞噬,免受核酸酶降解。但PEI作为基因载体还存在一定的缺陷。PEI随着分子量增大转染效率升高,细胞毒性也随之增加。此外,采用直接结合法难以制备稳定的PEI-DNA给药系统[12, 14]。
为此,本研究采用化学还原法[15, 16, 17],制备以纳米金颗粒为核,表面包裹聚乙烯亚胺的聚乙烯亚胺修饰的纳米金基因载体。通过静电吸附将含绿色荧光蛋白报告基因pAcGFP-N1质粒DNA吸附在其表面,形成DNA-PEI纳米金复合物,用透射电镜观察纳米颗粒的形态特征,用激光粒度分析仪测定其粒径分布、表面电位(Zeta电位),1%琼脂糖凝胶电泳实验检测PEI-纳米金基因载体与DNA结合的稳定性,用CCK-8细胞增殖及凋亡试剂盒检测PEI-纳米金基因载体及DNA-纳米金复合物对HEK293的细胞毒性作用,用体外转染的实验评价纳米粒的转染活性,并通过荧光显微镜观察测定转染效率。最后,通过考察纳米金与质粒DNA按不同质量比结合的PEI-纳米金基因复合体的转染效率,寻找本递送系统最佳的转染条件。
1 材料与方法 1.1 材料聚乙烯亚胺(PEI ,Sigma-Aldrich公司,相对分子质量25×103),氯金酸(HAuCl4·3H2O,Sigma-Aldrich公司,相对分子质量394),含绿色荧光蛋白报告基因质粒pAcGFP-N1(购自华大基因),Lipofenctamine2000转染试剂盒(InvitrogenTM),高糖培养基DMEM,胎牛血清FBS,青-链霉素双抗,胰酶(Gibco公司),CCK-8法细胞增殖检测试剂盒(ATGene公司),HEK293细胞由本实验室提供,其余试剂均为国产分析纯,由西南医院肝胆外科实验室提供。
智能数控温控磁力加热搅拌器(型号ZNCL-BS,重庆东悦仪器有限公司),紫外分光光度仪(Thermo,美国),琼脂糖凝胶电泳仪(Bio-Rad公司,美国),激光粒度分析仪(Nano 90,英国Malwern公司),透射电镜(JEOL-1400 Plus,日本株式会社),荧光显微镜(日本Nikon公司)。
1.2 方法 1.2.1 聚乙烯亚胺-纳米金基因载体的制备采用化学还原法制备PEI-纳米金复合物。取25 mL浓度为 0.056%的氯金酸溶液于50 mL锥形瓶中,加入0.8 mL 质量浓度为1%的聚乙烯亚胺溶液,室温下(25 ℃)持续搅拌24 h,搅拌转速为500 r/min,待充分反应后用220 nm的针式过滤器除去大颗粒,然后用蒸馏水恢复到原来的体积,得到PEI修饰纳米金溶液,保存于4 ℃冰箱中。
1.2.2 聚乙烯亚胺-纳米金复合物的表征参数测定用紫外分光光度仪进行全波长扫描(400~800 nm)分析其吸收光谱及最大吸收峰的波长λmax,并测定D(520) 计算其浓度。透射电镜观察PEI-纳米金颗粒的形态特征,激光粒度分析仪测定该纳米粒的粒径分布及表面电位(Zeta电位)。
1.2.3 聚乙烯亚胺-纳米金复合物与质粒DNA结合稳定性检测因为聚乙烯亚胺既是还原剂参与反应,又是纳米金的修饰物,稳定纳米金颗粒防止出现聚集现象,故聚乙烯亚胺浓度未知。而纳米金(Au nanoparticle,AuNP)的浓度恒定,按不同质量比结合pAcGFP-N1质粒DNA,AuNP/DNA(w/w)比值分别为0:1、0.1:1、0.2:1、0.3:1、0.4:1、0.5:1、0.75:1、1.0:1。配制1%的琼脂糖凝胶,核酸染料用低毒性的Gelred替代EB。取1 μL质粒DNA(浓度为500 ng/μL),按上述质量比加入不同体积的纳米金溶液,每孔DNA上样缓冲液(6×)1 μL,双蒸水配平总体积6 μL,充分混匀PEI-纳米金与DNA结合的复合物,室温孵育10 min。在Bio-Rad电泳槽中进行1%琼脂糖凝胶电泳,120 V 35 min后置于254 nm紫外灯下观察并照相。
1.2.4 聚乙烯亚胺-纳米金复合物细胞毒性实验取对数期生长的HEK293细胞分别按1×104个/孔的密度接种到96孔板上,37 ℃、5% CO2恒温孵育箱中培养24 h。考察聚乙烯亚胺-纳米金对HEK293的细胞毒性时,不加pAcGFP-N1质粒DNA分为6组:空白对照组、lipofectamine 2 000组(lipofectamine 2 000浓度为4 μg/mL)、不同浓度AuNP组(纳米金的浓度分别为5、10、15、20 μg/mL)。考察DNA-纳米金复合物对HEK293的细胞毒性,也分为6组:DNA空白对照组,DNA-lipofectamine 2000组(lipofectamine 2000浓度 为4 μg/mL),AuNP与DNA按不同质量比结合的DNA-纳 米金复合物AuNP/DNA(w/w) 2.5:1、5:1、7.5:1、10:1组(纳米金的浓度分别为5、10、15、20 μg/mL)。与单独基因载体组比较,每孔需加入0.2 μg pAcGFP-N1质粒DNA。待细胞贴壁后,按上述分组分别加入不同浓度的基因载体、DNA-基因载体复合物及DMEM培养基共100 μL,每个浓度均设置3个复孔。置于37 ℃、5% CO2恒温孵育箱中,孵育24 h后取出96孔板,每孔加入10 μL CCK-8检测试剂,孵育2 h后用酶标仪检测D(450),评价聚乙烯亚胺-纳米金及DNA-纳米金复合物的细胞毒性。计算公式为:细胞存活率(%)=[D(450)加药细胞-D(450)空白]/[D(450) 对照细胞-D(450)空白]×100%。根据CCK-8实验结果计算细胞生存率:细胞生存率=D(450)实验组均值/D(450)对照细胞均值×100%。以未加DNA的空白对照组为100%,计算各组细胞存活率。
1.2.5 聚乙烯亚胺-纳米金复合物的体外转染实验取对数生长期的HEK293细胞按5×104个/孔的密度接种到24孔板上,37 ℃ 5% CO2恒温孵育箱中培养24 h,待细胞贴壁程度达到90%以上,即可进行体外转染实验。AuNP与携带绿色荧光蛋白报告基因的pAcGFP-N1质粒DNA按不同质量比2.5:1、5:1、7.5:1、10:1混合(聚乙烯亚胺-纳米金浓度依次为5、10、15、20 μg/mL),对照组用lipofectamine 2000(浓度为4 μg/mL)转染。每孔转染1 μg pAcGFP-N1质粒。48 h后荧光显微镜下观察绿色荧光蛋白表达情况。选取6个不同的视野观察GFP表达阳性率,分析各组的转染效率。
1.3 统计学处理计量资料的数据采用x±s表示。采用SPSS 18.0进行统计学分析,各组细胞存活率及转染效率比较采用t检验分析,以α=0.05为显著性水平。
2 结果 2.1 聚乙烯亚胺-纳米金溶液的形态特征及紫外吸收光谱通过化学还原法合成的纳米金溶液呈酒红色,澄清,未见大颗粒聚集沉淀。4 ℃保存6个月后观察颜色仍为酒红色澄清溶液,说明合成的纳米金溶液比较稳定。紫外分光光度计全波长扫描(400~800 nm)可见纳米金溶最大吸收峰波长λmax≈520 nm,CAuNP=280 μg/mL,D(520)≈0.8(图 1)。
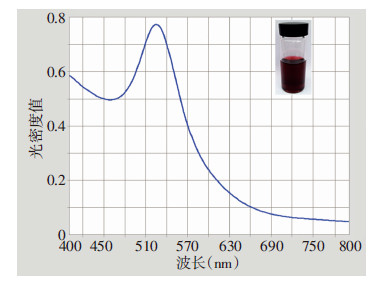 |
| 图 1 聚乙烯亚胺修饰纳米金溶液的外观及紫外-可见吸收光谱 |
经透射电镜观察PEI-纳米金呈现单分散球形分布,未出现颗粒团聚现象(图 2)。通过激光粒度分析仪检测PEI-纳米金颗粒的粒径分布及其分散状态,可知PEI-纳米金颗粒的分散系数为0.206,说明纳米金颗粒的分散状况良好。粒径为(12.3±3.3)nm。测得PEI-纳米金复合物的Zeta电位为+(29.7±5.1)mV。
 |
| 图 2 透射电镜观察聚乙烯亚胺-纳米金复合物的粒径分布 |
因为聚乙烯亚胺修饰可使纳米金表面带有大量正电荷,上述实验Zeta电位为+(29.7±5.1)mV已证实。质粒DNA带负电荷可通过静电吸附作用结合到带正电荷的纳米金表面。1%琼脂糖凝胶电泳实验结果表明: 随着聚乙烯亚胺-纳米金的量逐渐增加,结合到纳米金载体表面的质粒DNA增多。结合后DNA-纳米金复合物仍带正电,停留在加样孔处。而游离的质粒DNA逐渐减少,直至最后向正极电泳的条带消失。当AuNP/DNA≥0.5时,DNA可通过静电吸附作用完全结合到纳米金的表面(图 3)。
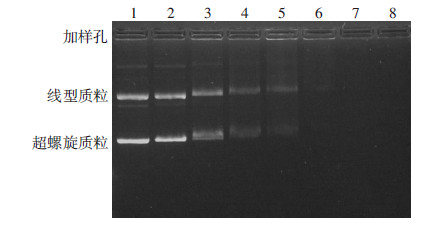 |
| 1~8分别为AuNP/DNA(w/w)比值:0:1、0.1:1、0.2:1、0.3:1、0.4:1、0.5:1、0.75:1、1.0:1 图 3 DNA凝胶电泳阻滞实验检测PEI-纳米金与DNA结合稳定性 |
本实验应用CCK-8法检测不同浓度纳米金基因载体及DNA-纳米金复合物对HEK293细胞的细胞毒性,以确定其用于基因转染的可行性及可用剂量(图 4)。随着纳米金浓度增加,细胞毒性随之增强。加入质粒DNA后,DNA-纳米金复合物对细胞的毒性作用减弱,这可能与纳米金表面正电荷减少有关。当纳米金浓度为10 μg/mL 时,AuNP组与lipofectamine 2000组细胞存活率比较,差异无统计学意义(P>0.05)。加入DNA后,AuNP/DNA(w/w)5.0组与lipofectamine 2000组细胞存活率比较仍无统计学差异(P>0.05)。 CCK-8实验与显微镜下形态学观察基本吻合。
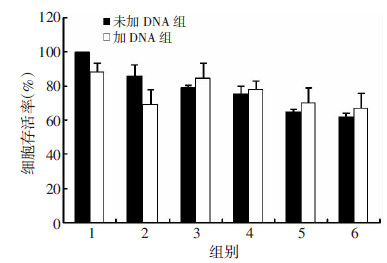 |
| 1:空白对照组;2:lipofectamine 2000组;3:AuNP 5 μg/mL组;4:AuNP 10 μg/mL组;5:AuNP 15 μg/mL组;6:AuNP 20 μg/mL组 图 4 不同浓度的纳米金颗粒及DNA-纳米金复合物对HEK293细胞的毒性 |
将转染48 h后的HEK293细胞置于荧光显微镜下观察,可见纳米金组、lipofectamine 2000组均有绿色荧光蛋白表达,但纳米金组绿色荧光点的数目比lipofectamine 2000组少,而阴性对照组则无绿色荧光表达(图 5)。AuNP/DNA按不同质量浓度混合后转染效率有差异。荧光显微镜观察各组转染效率结果表明,当AuNP/DNA(w/w)=5(即PEI-纳米金载体浓度为10 μg/mL)时,转染效率最高[转染效率为(24.9± 1.9)%],低于lipofectamine 2000组[(50.3±2.2)%],差异有统计学意义(P<0.05)。
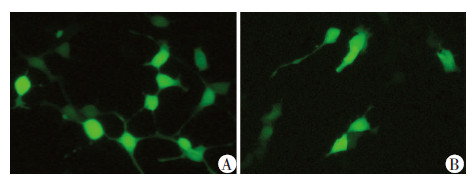 |
| A:lipofectamine 2000组;B:纳米金组 图 5 荧光显微镜下观察纳米金基因载体的体外转染结果(×100) |
纳米基因载体具有合成简单、成本低廉、低免疫原性和低细胞毒性等优点,是目前基因载体研究的热点之一[1]。通过控制反应条件,能够合成不同粒径范围的纳米金颗粒,合成的纳米金溶液性质稳定、具有良好的生物相容性,还可以通过对纳米金进行表面修饰增加其在体内循环的时间,增强其对肿瘤细胞靶向性,从而广泛地应用于药物输送系统[6, 8, 18]。
本研究采用化学还原法制备的聚乙烯亚胺修饰的纳米金颗粒合成条件温和,方法简便。通过紫外光谱分析、透射电镜观察、激光粒度仪动态光散射等对合成的纳米金颗粒的等离子吸收光谱、形貌特征、粒径分布及分散度、Zeta电位进行检测,结果表明我们合成的聚乙烯亚胺-纳米金基因载体粒径为12 nm左右,粒子呈单分散球形分布,分散状态较好,这与大多数文献报道结果一致[15, 17, 19, 20]。聚乙烯亚胺包被的纳米金颗粒具有巨大的表面积,且表面带正电荷,可通过静电吸附带负电荷的质粒DNA形成稳定的复合体。此外,本研究还考察了不同质量浓度的聚乙烯亚胺-纳米金溶液的细胞毒性及其转染效率。发现该纳米载体与PEI分子相比,不仅保持了PEI分子作为基因载体的优点,即包裹、浓缩和保护DNA,经内吞作用进入细胞后可逃避溶酶体的吞噬,并将DNA释放到细胞质中,还能够通过调整与DNA结合的质量比,降低PEI分子的细胞毒性,得到较为理想的转染效率[21]。AuNP/DNA质量比为5时,转染效率最高,仍低于商品化的阳离子脂质体转染试剂lipofectamine 2000。限于本实验室条件,本研究未能准确测定反应后PEI的浓度,因而不能研究不同N/P对转染效率的影响[22]。聚乙烯亚胺-纳米金基因载体的转染效率受到多种因素影响,调整溶液pH、血清含量、转染时间等转染条件以达到最优的转染效率仍有待研究[13]。
本研究结果表明,聚乙烯亚胺-纳米金基因载体能够介导基因转染HEK293细胞并表达。纳米金载体具有巨大表面积,通过聚乙烯亚胺可使其表面带正电荷,不仅能结合DNA介导细胞转染,还能与siRNA结合介导基因沉默,甚至还可与特异性抗体结合介导肿瘤分子靶向治疗和靶向化疗药物输送[9, 23, 24]。但其对细 胞的选择性、各种细胞不同的转染条件、细胞毒性及剂量效应关系、最佳转染条件等需要进一步的探索[2, 25, 26]。
| [1] | Xu H, Li Z, Si J. Nanocarriers in gene therapy: a review[J]. J Biomed Nanotechnol, 2014, 10(12): 3483-3507. |
| [2] | Chira S, Jackson C S, Oprea I, et al. Progresses towards safe and efficient gene therapy vectors[J]. Oncotarget, 2015, 6(31): 30675-30703. DOI: 10.18632/oncotarget.5169 |
| [3] | Yin H, Kanasty R L, Eltoukhy A A, et al. Non-viral vectors for gene-based therapy[J]. Nat Rev Genet, 2014, 15(8): 541-555. DOI: 10.1038/nrg3763 |
| [4] | Jafari M, Soltani M, Naahidi S, et al. Nonviral approach for targeted nucleic acid delivery[J]. Curr Med Chem, 2012, 19(2): 197-208. |
| [5] | Kafshdooz T, Kafshdooz L, Akbarzadeh A, et al. Applications of nanoparticle systems in gene delivery and gene therapy[J]. Artif Cells Nanomed Biotechnol, 2016, 44(2): 581-587. DOI: 10.3109/21691401.2014.971805 |
| [6] | Urbiola K, Blanco-Fernandez L, de-Ilarduya C T. Nanoparticulated Polymeric Systems for Gene Delivery[J]. Curr Pharm Des, 2015, 21(29): 4193-4200. |
| [7] | Sun T, Zhang Y S, Pang B, et al. Engineered nanoparticles for drug delivery in cancer therapy[J]. Angew Chem Int Ed Engl, 2014, 53(46): 12320-12364. DOI: 10.1002/anie.201403036 |
| [8] | Rana S, Bajaj A, Mout R, et al. Monolayer coated gold nanoparticles for delivery applications[J]. Adv Drug Deliv Rev, 2012, 64(2): 200-216. DOI: 10.1016/j.addr.2011.08.006 |
| [9] | Ghosh P, Han G, De M, et al. Gold nanoparticles in delivery applications[J]. Adv Drug Deliv Rev, 2008, 60(11): 1307-1315. DOI: 10.1016/j.addr.2008.03.016 |
| [10] | Dykman L, Khlebtsov N. Gold nanoparticles in biomedical applications: recent advances and perspectives[J]. Chem Soc Rev, 2012, 41(6): 2256-2282. DOI: 10.1039/c1cs15166e |
| [11] | Boussif O, Lezoualc’h F, Zanta M A, et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine[J]. Proc Natl Acad Sci USA, 1995, 92(16): 7297-7301. |
| [12] | Godbey W T, Wu K K, Mikos A G. Poly(ethylenimine) and its role in gene delivery[J]. J Control Release, 1999, 60(2/3): 149-160. |
| [13] | Akinc A, Thomas M, Klibanov A M, et al. Exploring polyethylenimine-mediated DNA transfection and the proton sponge hypothesis[J]. J Gene Med, 2005, 7(5): 657-663. DOI: 10.1002/jgm.696 |
| [14] | Kichler A, Leborgne C, Coeytaux E, et al. Polyethylenimine-mediated gene delivery: a mechanistic study[J]. J Gene Med, 2001, 3(2): 135-144. DOI: 10.1002/jgm.173 |
| [15] | Kim K, Lee H B, Lee J W, et al. Self-assembly of poly(ethylenimine)-capped Au nanoparticles at a toluene-water interface for efficient surface-enhanced raman scattering[J]. Langmuir, 2008, 24(14): 7178-7183. DOI: 10.1021/la800733x |
| [16] | Cebrian V, Martin-Saavedra F, Yague C, et al. Size-dependent transfection efficiency of PEI-coated gold nanoparticles[J]. Acta Biomater, 2011, 7(10): 3645-3655. DOI: 10.1016/j.actbio.2011.06.018 |
| [17] | Song W J, Du J Z, Sun T M, et al. Gold nanoparticles capped with polyethyleneimine for enhanced siRNA delivery[J]. Small, 2010, 6(2): 239-246. DOI: 10.1002/smll.200901513 |
| [18] | Duncan B, Kim C, Rotello V M. Gold nanoparticle platforms as drug and biomacromolecule delivery systems[J]. J Control Release, 2010, 148(1): 122-127. DOI: 10.1016/j.jconrel.2010.06.004 |
| [19] | Zhao X, Cui H, Chen W, et al. Morphology, structure and function characterization of PEI modified magnetic nanoparticles gene delivery system[J]. PLoS One, 2014, 9(6): e98919. DOI: 10.1371/journal.pone.0098919 |
| [20] | Guo S, Huang Y, Jiang Q, et al. Enhanced gene delivery and siRNA silencing by gold nanoparticles coated with charge-reversal polyelectrolyte[J]. ACS Nano, 2010, 4(9): 5505-5511. DOI: 10.1021/nn101638u |
| [21] | Sharma A, Tandon A, Tovey J C, et al. Polyethylenimine-conjugated gold nanoparticles: Gene transfer potential and low toxicity in the cornea[J]. Nanomedicine, 2011, 7(4): 505-513. DOI: 10.1016/j.nano.2011.01.006 |
| [22] | Zhao Q Q, Chen J L, Lv T F, et al. N/P ratio significantly influences the transfection efficiency and cytotoxicity of a polyethylenimine/chitosan/DNA complex[J]. Biol Pharm Bull, 2009, 32(4): 706-710. |
| [23] | Lim Z Z, Li J E, Ng C T, et al. Gold nanoparticles in cancer therapy[J]. Acta Pharmacol Sin, 2011, 32(8): 983-990. DOI: 10.1038/aps.2011.82 |
| [24] | Jain S, Hirst D G, O'Sullivan J M. Gold nanoparticles as novel agents for cancer therapy[J]. Br J Radiol, 2012, 85(1010): 101-113. DOI: 10.1259/bjr/59448833 |
| [25] | Alkilany A M, Murphy C J. Toxicity and cellular uptake of gold nanoparticles: what we have learned so far?[J]. J Nanopart Res, 2010, 12(7): 2313-2333. DOI: 10.1007/s11051-010-9911-8 |
| [26] | Han N, Yang Y Y, Wang S, et al. Polymer-based cancer nanotheranostics: retrospectives of multi-functionalities and pharmacokinetics[J]. Curr Drug Metab, 2013, 14(6): 661-674. |



