葡萄膜炎是世界范围内重要致盲眼病[1],不仅病因复杂、类型繁多和治疗棘手,而且常因其慢性化和复发性病程导致患者视力的严重损害或盲目。实验性自身免疫性葡萄膜炎(experimental autoimmune uveoretinitis,EAU)是一种T细胞介导、靶器官特异的自身免 疫相关的疾病,由大鼠、小鼠所诱导的EAU模型是研究人类葡萄膜炎的经典动物模型[2-3]。多种视网膜抗原,尤其是由完全弗氏佐剂(complete Freund’s adjuvant,CFA)乳化的光感受器维生素A类结合蛋白161-180肽段(interphotoreceptor retinoid-binding protein,IRBP161-180)免疫B10.RⅢ小鼠诱导的EAU,其发生的病理学特征和免疫机制与人类葡萄膜炎近似,是最经典和最广泛使用的葡萄膜炎动物模型[4-5],但具有单向自限性的病程[6]。因此,在公认的 B10.RⅢ小鼠诱导EAU模型的研究基础之上,探讨其炎症慢性化和复发的条件和特点,寻求更接近于人类葡萄膜炎的发生及其特点的动物模型,将为人类葡萄膜炎研究提供更为理想的动物模型。本研究应用CFA乳化的IRBP161-180诱导B10.RⅢ小鼠建立EAU小鼠模型,在免疫后7、14、21、28、35 d进行炎症的临床表现和病理组织学特征研究,评价小鼠眼部的炎症发生、发展及转归的过程及其特征;待炎症完全消失后,再次免疫小鼠,评价小鼠葡萄膜炎炎症的复发条件、过程、特点及转归。
1 材料与方法 1.1 复发性 EAU小鼠模型的诱导选择SPF级6~8周龄B10.RⅢ小鼠(来源于美国Jackson实验室,由重庆医科大学附属第一医院杨培增教授友情赠送),饲养于重庆医科大学实验动物中心SPF环境系统[生产许可证号:SCXK(渝)2012-0001,使用许可证号:SYXK(渝)2012-0001]。由CFA(美国Sigma公司)充分乳化的包含50 μg IRBP161-180多肽(SGIPYIISYLHPGNTILHVD,上海生工生物工程公司合成)PBS溶液200 μL,依据文献[7]的方法经皮下依次注射于B10.RⅢ小鼠尾根部和两侧大腿内侧共35只(每部位注射体积分别对应为100、50 μL和 50 μL)。为评价EAU模型眼部炎症的复发情况,在首次免疫后观察到眼部炎症基本消失时,按上述方式再次免 疫B10.RⅢ小鼠。仅用CFA-PBS乳化物200 μL免疫6只B10.RⅢ小鼠作为正常对照组,注射部位、注射用量及方式与诱导组相同。所有动物实验遵行重庆医 科大学医学伦理原则和赫尔辛基宣言的各项要求执行。
1.2 EAU小鼠模型的发生及眼部炎症临床评价模型诱导组和正常对照组小鼠,分别于免疫后隔天进行裂隙灯显微镜眼前段观察炎症发生和临床表现,首次诱导后7、14、21、28、35 d记录眼部临床炎症评分。EAU小鼠眼部炎症复发模型里,在再次免疫后隔日进行临床裂隙灯显微镜眼前段检查。根据Tian等[8]研究团队报道的方法进行眼部临床炎症评价,即按照角膜水肿、睫状充血、前房炎症以及虹膜后粘连划分标准,每个标准根据炎症情况分为轻微(+)、中度(+ +)和严重(+ + +),结合所有标准,采用双盲法对EAU小鼠眼部炎症的严重程度进行0~5等级的临床评分。
1.3 EAU小鼠模型眼部炎症病理组织学评价模型诱导组小鼠首次诱导后7、14、21、28、35 d和复发炎症最高峰以及复发炎症消失时牺牲小鼠摘取眼球,4%戊二醛缓冲液固定1 h后,10%中性福尔马林固定。石蜡包埋切片,HE染色,光学显微镜观察玻璃体、脉络膜和视网膜等病理组织改变。根据Chan等[9]报道的方法进行眼部病理组织学的炎症评价,具体评分标准为非肉芽肿病灶,脉络膜、睫状体、视网膜的单核细胞浸润评分0.5分;视网膜血管周和玻璃体的单核细胞浸润,评分1分;葡萄膜和视网膜的肉芽性肿形成,视网膜血管炎,光感受器层紊乱及破坏评分2分;视网膜色素上皮细胞肉芽肿形成,视网膜下新生血管形成评分3分;根据病灶损伤的严重情况评定4分;采用双盲法对上述EAU小鼠炎症的严重程度进行病理组织评分。
2 结果 2.1 小鼠EAU初发炎症和复发炎症的发生及其临床表型评价裂隙灯显微镜观察结果显示,IRBP161-180多肽首次免疫B10.RⅢ小鼠后7 d小鼠双眼均开始出现炎症(6/6),表现为轻微睫状充血;随后炎症逐渐加重,14 d均达到炎症高峰期,临床表现为睫状充血、角膜混浊、前房纤维素性渗出物、瞳孔不规则和破裂缺损,瞳孔边缘纤维素性物渗出;随后炎症迅速消退,诱导第21天临床表现转归为轻微睫状充血;28 d炎症进一步减轻,直至免疫后35 d炎症完全消失。在首次免疫后第35天进行再次免疫,首次免疫后36 d(再次免疫后1 d)均出现复发炎症(5/5),表现为轻微睫状充血;随后炎症加重,42 d(再次免疫后7 d)复发炎症均达到高峰,临床表现睫状充血,角膜水肿,瞳孔不规则以及前房渗出物;随后炎症消退,48 d(再次免疫后13 d)可见睫状充血,部分可见瞳孔不规则;炎症进一步消退,50 d(再次免疫后15 d)部分鼠(1/5)复发炎症完全消退(图 1),观察至96 d(再次免疫后61 d)部分鼠(4/5)的炎症完全消退,部分鼠(1/5)保持复发性炎症,表现为睫状充血。正常对照组未见明显炎症改变。
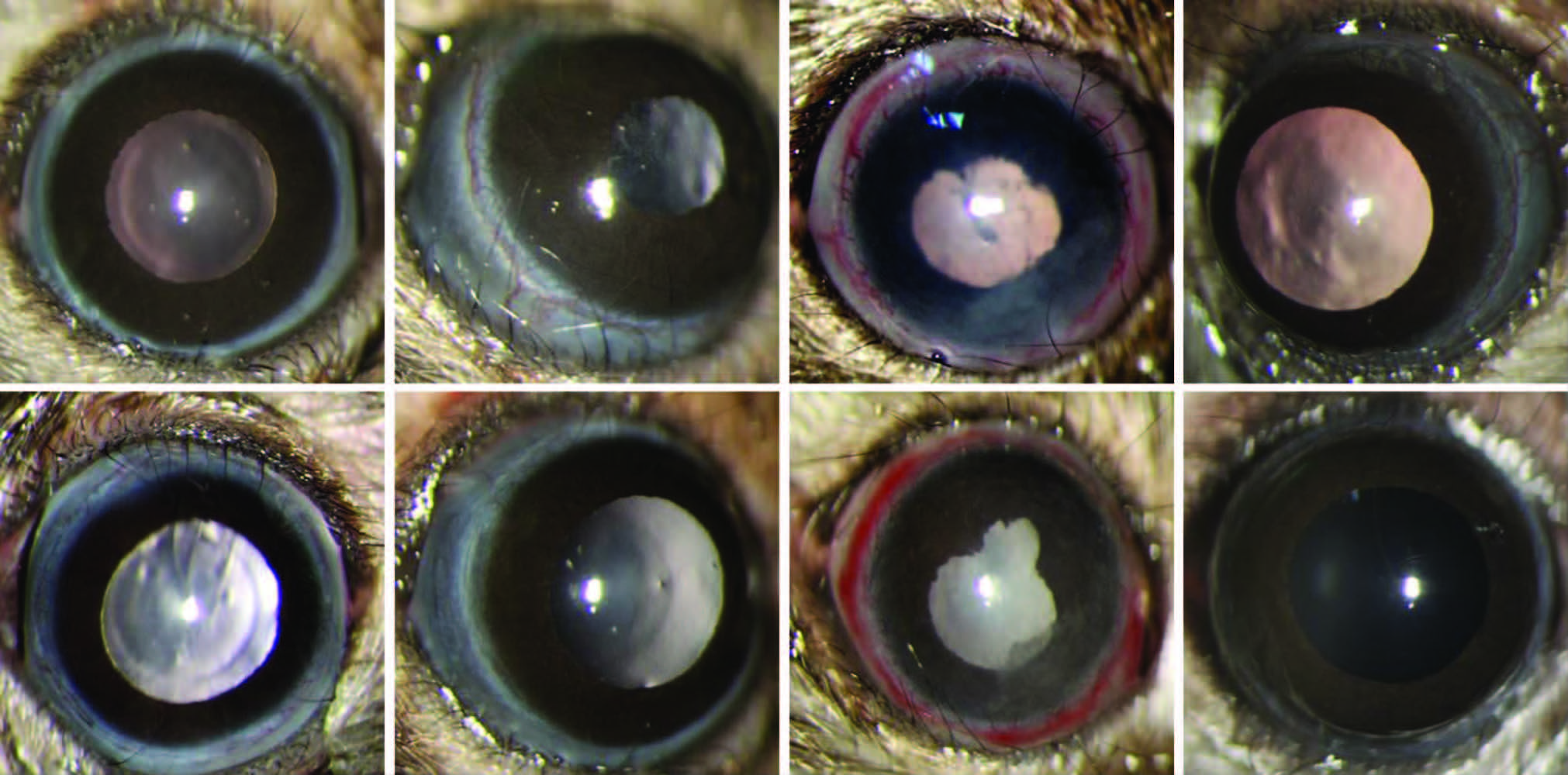
|
| A:对照组,未见明显炎症;B:首次诱导7 d,轻微睫状充血;C:首次诱导14 d,睫状充血、角膜水肿、前房炎症见纤维素性渗出物、结膜充血、瞳孔不规则和缺损;D:首次诱导21 d,炎症消退,轻微睫状充血;E:首次诱导28 d,轻微睫状充血;F:首次诱导35 d,未见炎症;G:再次诱导后7 d,睫状充血,角膜水肿,瞳孔不规则以及前房渗出物;H:再次诱导后15 d,部分鼠炎症完全消失 图 1 裂隙灯显微镜观察EAU小鼠眼前段临床表现 |
临床炎症评分结果显示,诱导组首次免疫后7 d为(0.67±0.51)分,14 d升高为(3.00±0.63)分,随后评分下降,至35 d炎症评分降为0。在初次免疫后第35天再 次进行免疫,36 d复发临床炎症评分为(1.00± 0.00)分,42 d复发炎症评分为(2.80±0.84)分,随后 评分下降,但到观察期96 d仍维持至(0.20±0.45)分。见图 2。
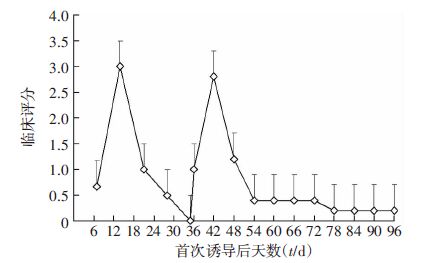
|
| 图 2 EAU小鼠临床炎症评分 |
2.2 小鼠EAU初发和复发炎症的病理组织学改变
IRBP161-180多肽首次免疫B10.RⅢ小鼠后7 d,病 理学观察结果显示,视网膜巨噬细胞浸润;炎症高峰期(14 d)可见大量巨噬细胞和中性粒细胞浸润脉络膜、视网膜及视网膜下,可见血管炎和渗出物,视网膜结构紊乱,光感受器细胞层和双极细胞层弯曲折叠、破损;免疫后21 d,炎症明显减轻,但仍可见光感受器层不规则;诱导后28 d,可见少许巨噬细胞,35 d未见明显病理改变。首次诱导后42 d达复发炎症高峰期,病理观察结果显示,视网膜层可见肉芽肿性炎,视网膜结构紊乱,光感受器细胞层和双极细胞层弯曲以及脉络膜增厚,首次诱导后50 d,部分鼠炎症消退,未见明显炎症(图 3)。
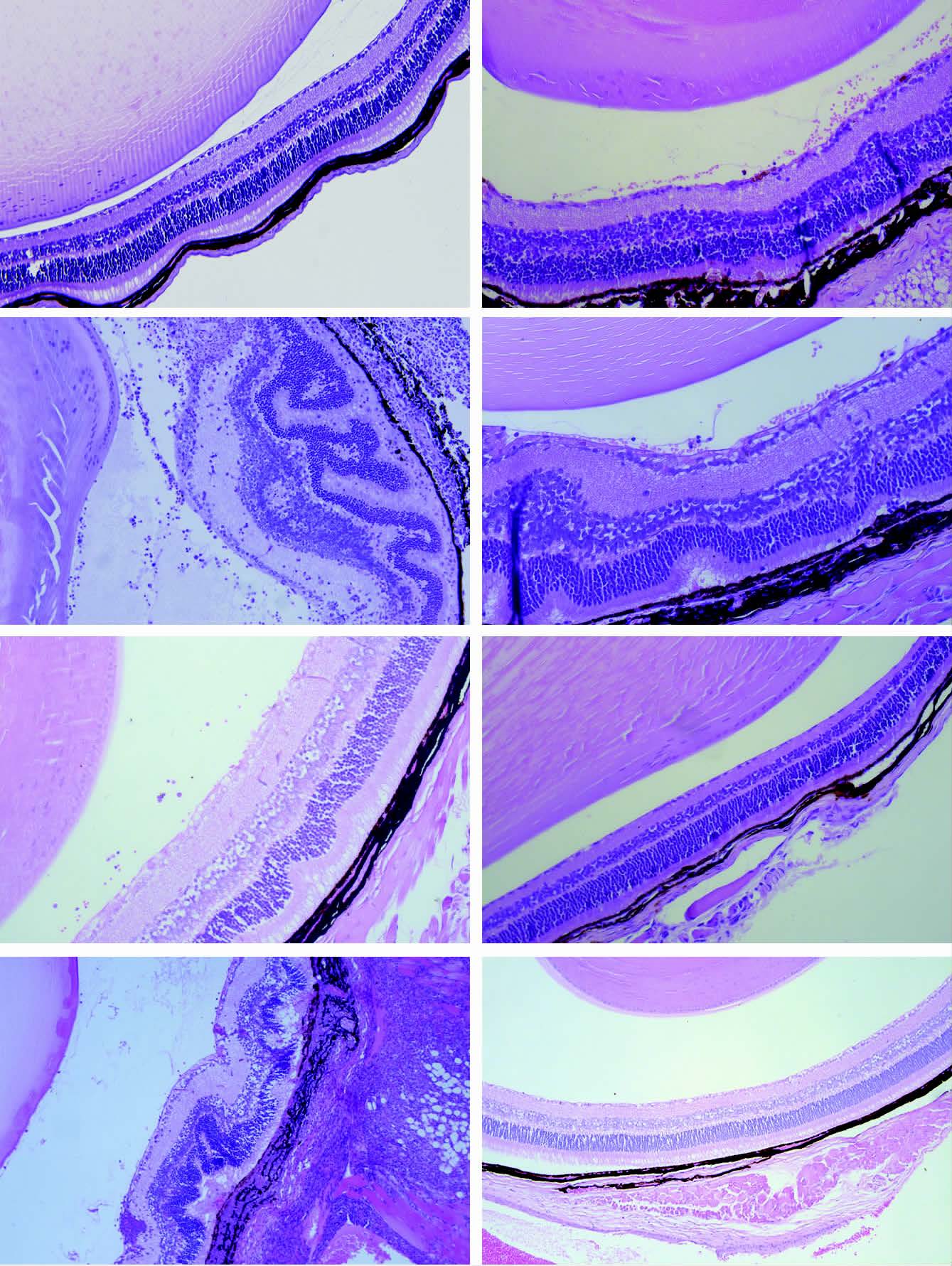
|
| A:对照组(v:玻璃体;g:神经节细胞层;p:光感受器层;r:视网膜色素上皮细胞;c:脉络膜;s:巩膜);B:首次诱导后7 d,视网膜有单核细胞的浸润;C:首次诱导后14 d,炎性细胞浸润至视网膜各层、视网膜肉芽肿、视网膜光感受器细胞层折叠变曲甚至破坏、血管炎及视网膜下新生血管形成;D:首次诱导后21 d,单核细胞浸润视网膜及玻璃体;E:首次诱导后28 d,视网膜可见少许单核巨噬细胞;F:诱导后35 d,未见明显炎症;G:首次诱导后42 d,视网膜层可见肉芽肿性炎,视网膜结构紊乱,光感受器细胞层弯曲以及脉络膜增厚;H:首次诱导后50 d,部分鼠未见明显炎症 图 3 EAU小鼠眼组织病理学变化 (HE ×200) |
病理组织炎症评分结果显示,首次免疫后7 d炎症评分为(0.33±0.25)分,14 d时炎症评分达到最高 (2.83±0.75)分,21 d炎症评分降低至(0.67±0.28)分,28 d炎症评分进一步降低为(0.17±0.25)分,至35 d评分为0。对照组未见明显异常病理改变。
3 讨论基于CFA中包含热灭活结核杆菌成分可以触发天然免疫反应进而产生获得性免疫反应以及IRBP多肽的致葡萄膜炎活性,本研究选择含50 μg 的IRBP161-180- CFA首次免疫B10.RⅢ易感小鼠,在免疫后7 d炎症 开始出现,14 d炎症达高峰期,随后炎症消退,35 d基本消失;在初次免疫后35 d应用含50 μg 的IRBP161-180-CFA 再次进行免疫,再次免疫后1 d出现复发性炎症,7 d达高峰期,随后炎症消退,15 d部分鼠(1/5)复发性炎症出现消失,直至再次免疫后观察至61 d仍有部分鼠(1/5)维持炎症,初发炎症和复发炎症完全发生。在病程上,复发炎症较初发炎症发生急、到达炎症高峰期经历时间短、炎症消退快,但炎症消退表现具有异质性,部分鼠长期保持慢性温和炎症状态。虽然Chan等[9]早在1990年应用IRBP通过两次诱导经环磷酰胺预处理的B10.BR小鼠,通过病理组织学观察发现,在初次免疫后第2周出现初次炎症(发生率28.5%),到第5周炎症达到高峰(发生率85.6%),第7周炎症完全消退,随后第8周又出现复 发炎症,到第10周复发炎症达高峰期(发生率82.9%),但初发炎症和复发炎症的发生率都未能达到100%。除此,Shao等[10]研究团队过继转移R16(源于IRBP1177-1191的抗原肽)致敏的T细胞诱导的Lewis大鼠眼组织复发性炎症,但复发率仅为75%。另外,Diedrichs-Mohring等[11]应用CFA乳化的R14(源于IRBP1169-1191抗原肽)单独或联合其致敏的T细胞诱导出Lewis大鼠眼组织的复发炎症,其复发率从85.7%到100%不等。
我们通过裂隙灯观察发现,初发炎症和复发炎症的临床评分皆经历由低到高,再由高至低的过程;两次炎症的发生期、高峰期和消退期的平均临床评分和临床表现较为一致,其中在高峰期两次炎症的平均临床评分均超过2.8分,且主要表现前房炎症,如睫状充血、角膜混浊、前房纤维素性渗出物、瞳孔不规则和破裂缺损,瞳孔边缘纤维素性物渗出等。同时我们也发现,两次炎症的演变过程存在差异,即复发炎症在再次诱导后第1天开始发生,随后炎症加重至7 d达高峰,然后炎症消退,至15 d部分鼠炎症完全消退,至观察期61 d仍有部分鼠维持低度炎症;而初发炎症在首次诱导后7 d发生,随后炎症加重至14 d达高峰,然后炎症消退至第35天完全消退。因此,本研究按两次免疫B10.RⅢ小鼠共诱导出两次炎症,在病程上具有反复发生、慢性化的特性。
另外,本研究病理组织学观察发现,初发炎症主要以血管炎、纤维素性渗出物以及巨噬细胞弥漫性浸润脉络膜、视网膜及视网膜下各层,视网膜结构紊乱,光感受器细胞层和双极细胞层弯曲折叠、破损为主要特征。复发炎症以肉芽肿性炎、视网膜结构紊乱,光感受器细胞层和双极细胞层弯曲以及脉络膜增厚为主要特征。两次炎症病理组织学特征与Chan诱导的慢性复发性EAU B10.BR小鼠模型以及人类慢性葡萄膜炎的病理组织学特征较为一致[9]。
有关葡萄膜炎的发生及复发机制,前期研究表明,CD4+CD25high调节性T细胞(Tregs)细胞数量和功能的降低是人类葡萄膜炎发生的重要机制[12],而在EAU小鼠模型里,脾脏和淋巴结来源的CD4+CD25+ Treg细胞数量和功能的增强是疾病迅速消退重要机制[13]。新近Silver等[14]发现小鼠眼组织内的IRBP抗原肽特异的CD4+Foxp3+Treg细胞是促使EAU疾病消退和维持疾病不复发的重要机制。在EAU Lewis大鼠模型里,R14抗原特异T细胞产生高水平的IFN-γ是诱导葡萄膜炎复发的重要机制[15]。在本研究中何种因素通过何种方式诱导了EAU的慢性复发性炎症以及这种慢性复发性炎症在发生机制上是否与单相自限性炎症的存在异同,将是下一步要研究的内容。
综上所述,本研究通过IRBP161-180多肽经两次诱导B10.RⅢ小鼠,建立了慢性复发性EAU小鼠模型,在临床表现和病理组织学特征方面与目前经典应用的单相自限性EAU B10.RⅢ小鼠模型相似,并且具有慢性复发性炎症,将可能成为一种能较好模拟人类慢性复发性葡萄膜炎的新型动物模型。
| [1] | Foster C S, Kothari S, Anesi S D, et al. The Ocular Immunology and Uveitis Foundation preferred practice patterns of uveitis management[J]. Surv Ophthalmol,2016, 61 (1) : 1 –17. DOI:10.1016/j.survophthal.2015.07.001 |
| [2] | Agarwal R K, Silver P B, Caspi R R. Rodent models of experimental autoimmune uveitis[J]. Methods Mol Biol,2012, 900 : 443 –469. DOI:10.1007/978-1-60761-720-4_22 |
| [3] | Yang H, Zheng S, Qiu Y, et al. Activation of liver X receptor alleviates ocular inflammation in experimental autoimmune uveitis[J]. Invest Ophthalmol Vis Sci,2014, 55 (4) : 2795 –2804. DOI:10.1167/iovs.13-13323 |
| [4] | Wei R, Dong L, Xiao Q, et al. Engagement of Toll-like receptor 2 enhances interleukin (IL)-17+ autoreactive T cell responses via p38 mitogen-activated protein kinase signalling in dendritic cells[J]. Clin Exp Immunol,2014, 178 (2) : 353 –363. DOI:10.1111/cei.12405 |
| [5] | Bansal S, Barathi V A, Iwata D, et al. Experimental autoimmune uveitis and other animal models of uveitis: An update[J]. Indian J Ophthalmol,2015, 63 (3) : 211 –218. DOI:10.4103/0301-4738.156914 |
| [6] | Choi J H, Roh K H, Oh H, et al. Caffeic acid phenethyl ester lessens disease symptoms in an experimental autoimmune uveoretinitis mouse model[J]. Exp Eye Res,2015, 134 : 53 –62. DOI:10.1016/j.exer.2015.03.014 |
| [7] | Caspi R R. Experimental autoimmune uveoretinitis in the rat and mouse[J]. Curr Protoc Immunol,2003 (Chapter 15) . DOI:10.1002/0471142735.im1506s53 |
| [8] | Tian L, Yang P, Lei B, et al. AAV2-mediated subretinal gene transfer of hIFN-alpha attenuates experimental autoimmune uveoretinitis in mice[J]. PLoS One,2011, 6 (5) : e19542 . DOI:10.1371/journal.pone.0019542 |
| [9] | Chan C C, Caspi R R, Ni M, et al. Pathology of experimental autoimmune uveoretinitis in mice[J]. J Autoimmun,1990, 3 (3) : 247 –255. |
| [10] | Shao H, Shi H, Kaplan H J, et al. Chronic recurrent autoimmune uveitis with progressive photoreceptor damage induced in rats by transfer of IRBP-specific T cells[J]. J Neuroimmunol,2005, 163 (1/2) : 102 –109. |
| [11] | Diedrichs-Mohring M, Hoffmann C, Wildner G. Antigen-dependent monophasic or recurrent autoimmune uveitis in rats[J]. Int Immunol,2008, 20 (3) : 365 –374. DOI:10.1093/intimm/dxm148 |
| [12] | Chen L, Yang P, Zhou H, et al. Diminished frequency and function of CD4+CD25high regulatory T cells associated with active uveitis in Vogt-Koyanagi-Harada syndrome[J]. Invest Ophthalmol Vis Sci,2008, 49 (8) : 3475 –3482. DOI:10.1167/iovs.08-1793 |
| [13] | Sun M, Yang P, Du L, et al. Contribution of CD4+CD25+ T cells to the regression phase of experimental autoimmune uveoretinitis[J]. Invest Ophthalmol Vis Sci,2010, 51 (1) : 383 –389. DOI:10.1167/iovs.09-3514 |
| [14] | Silver P B, Horai R, Chen J, et al. Retina-specific T regulatory cells bring about resolution and maintain remission of autoimmune uveitis[J]. J Immunol,2015, 194 (7) : 3011 –3019. DOI:10.4049/jimmunol.1402650 |
| [15] | Wildner G, Kaufmann U. What causes relapses of autoimmune diseases? The etiological role of autoreactive T cells[J]. Autoimmun Rev,2013, 12 (11) : 1070 –1075. DOI:10.1016/j.autrev.2013.04.001 |



