低氧是实体肿瘤组织内部普遍存在的现象,且肿瘤细胞的缺氧可能是恶性肿瘤进展的启动因子之一[1, 2],低氧使癌细胞更具侵袭性,而上皮-间充质化(epithelial mesenchymal transition,EMT)在肿瘤的侵袭与转移过程中发挥了关键的作用,在这个过程中原发灶的癌细胞由静止的上皮细胞转变成具有迁移能力的间充质细胞从而具有了极强的侵袭性[3, 4, 5, 6],近年研究表明EMT的发生与肿瘤所处的微环境密切相关[7]。缺氧是结直肠癌最重要的微环境特点之一,HIF-1α是缺氧反应最关键的转录因子。大量的研究表明HIF-1α存在异常表达和患者的术后生存率有关[8]。HIF-1α作为有效的肿瘤预后标记物[9],在肿瘤的发生、发展中可能起关键作用。同时,在肿瘤中非编码小RNA即MicroRNAs(miRNAs)也参与了EMT的过程,并且在EMT中发挥了关键的作用,尤其是MicroRNA-200家族,MicroRNA-200家族在侵袭性肿瘤中表达下调,成为EMT、肿瘤细胞黏附、迁移、侵袭和转移的抑制物,是一种典型的肿瘤抑制基因[10]。关于MicroRNA-200家族调控转录因子及靶蛋白的研究有大量文献报道,但其本身在转录水平如何被调控缺乏深入研究。故本研究探讨结肠癌中HIF-1α和miR-200b之间的联系,为确立HIF-1α-miR-200b肿瘤调节通路提供依据。
1 材料与方法 1.1 主要试剂DMEM培养基、胎牛血清和胰蛋白酶(购于HyClone公司);总RNA提取试剂TRIzol、逆转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser和实时定量PCR试剂SYBR Ⅱ(购于TaKaRa公司),氯化钴CoCl2·6H2O(购于Sigma公司);兔抗人HIF-1α(proteintech,20960-1-AP)、小鼠抗人β-actin(proteintech,60008-1-lg)、HRP标记的山羊抗兔IgG(中杉金桥,ZB-2301)、HRP标记的山羊抗小鼠IgG(碧云天,A0216)。
1.2 组织标本结直肠癌标本的采集及处理详见文献[11]报道的方法。
1.3 细胞培养及缺氧处理结肠癌细胞株Caco-2购自美国ATCC公司,培养于DMEM高糖培养液中,每100 mL培养基加入20 mL胎牛血清,100 U/mL青霉素、0.1 mg/mL链霉素,置于37 ℃、5% CO2培养箱进行培养。细胞生长至80%,加入300 μmol/L浓度的CoCl2,分别缺氧处理0、2、4、8、12 h和16 h。
1.4 实时定量PCR检测HIF-1α和miR-200b的表达实时定量PCR检测方法、miRNA-200b的逆转录引物及定量PCR引物详见文献[11]。内参18 s上游引物:5′-CGGACAGGATTGACAGATTGATAGC-3′,下游引物:5′-TGCCAGAGTCTCGTTCGTTATCG-3′;HIF-1α上游引物:5′-TGATTGCATCTCCATCTCCTACC-3′,下游引物:5′-GACTCAAAGCGACAGATAACACG-3′;U6上游引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物:5′-CGCTTCACGAATTTGCGTGTCAT-3′;miRNA-200b上游引物:5′-GGGGTAATACTGCCTGGT-3′,下游引物:5′-TGCGTGTCGTGGCGTC-3′。实验结果采用2-△△Ct法进行分析处理。
1.5 Western blot分析经不同时间点(0、2、4、8、12、16 h)CoCl2缺氧诱导后,加入2×SDS裂解液,收集裂解后的细胞于100 ℃变性5 min,再用8%聚丙烯酰胺凝胶电泳进行分离。经半干转膜、封闭后,加入一抗HIF-1α(1 :1 000)、 β-actin(1 :4 000),4 ℃孵育过夜。加HRP标记的二抗IgG,37 ℃孵育70 min后,加ECL显色液进行显色反应。利用Quantity one软件进行灰度值分析。
1.6 统计学分析采用统计学软件SPSS 13.0处理数据。配对t检验分析HIF-1α和miRNA-200b在结肠癌和癌旁组织中的表达差异,Pearson相关性分析方法分析癌组织中HIF-1α和miRNA-200b表达的相关性。
2 结果 2.1 结肠癌组织中HIF-1α的mRNA与miRNA-200b的表达及相关性实验选取50例结肠癌患者标本,包括癌组织及正常组织,利用实时定量PCR的方法检测结肠癌及癌旁组织中HIF-1α的表达,分别为(0.620 8±0.580 9)和(0.291 9±0.187 3),癌组织中HIF-1α的表达明显高于正常癌旁组织(P<0.01);miRNA-200b在结肠癌及癌旁组织的表达分别为(0.812 6±0.409 0)和(1.277 0±0.806 5),miRNA-200b在癌组织中的表达明显低于正常癌旁组织(P<0.01)。利用SPSS软件分析50例结肠癌组织的实时定量PCR检测结果,Pearson相关性分析HIF-1α与miRNA-200b的表达,如图 1所示,两者在结肠癌组织中的表达存在明显的负相关(r=-0.32,P<0.05)。
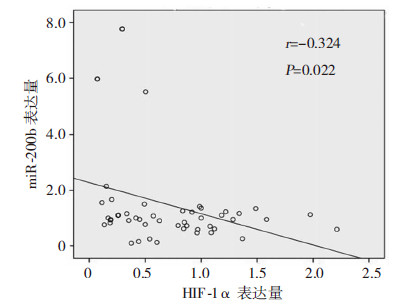 |
| 图 1 HIF-1α和miRNA-200b在结肠癌组织中的表达 |
通过RT-PCR检测常氧环境下5种结肠癌细胞系(Ls174t、HT-29、 Caco-2、Lovo和SW480)HIF-1α mRNA水平的表达。如图 2所示,5种结肠癌细胞中HIF-1α mRNA均有表达,且在Caco-2及Lovo细胞中表达相对较高,在Ls174t、HT-29及SW480细胞中表达较低。利用Western blot检测常氧环境下5种结肠癌细胞系中HIF-1α蛋白情况,其蛋白水平的表达在所有的细胞系几乎检测不到。由于缺氧环境能稳定HIF-1α的蛋白水平,为了检测HIF-1α蛋白在结肠癌细胞系中的表达,利用CoCl2模拟缺氧环境,在不同缺氧时间下观察细胞中HIF-1α的表达情况。
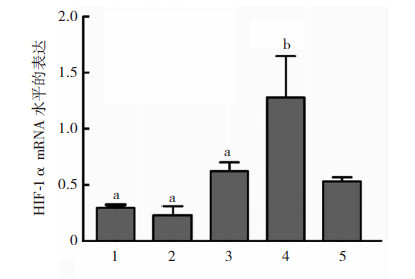 |
| 1:Ls174t细胞; 2:HT-29细胞; 3 :Caco-2细胞;4:Lovo细胞: 5:SW480细胞 a: P<0.05; b: P<0.01,5种不同细胞系中HIF-1α mRNA表达水平的比较图 2 不同结肠癌细胞系中HIF-1α mRNA的表达水平 |
Caco-2细胞用300 μmol/L CoCl2处理不同的时间(0、2、4、8、12 h和16 h),诱导细胞缺氧。用实时定量PCR方法检测不同缺氧时间(0、2、4、8、12 h和16 h)Caco-2细胞内HIF-1α mRNA的表达水平。如图 3所示,缺氧2~8 h HIF-1α的mRNA表达下降,8 h后其表达量增加,12 h达到高峰,随后于16 h下降恢复至8 h表达水平。Western blot检测结果显示,HIF-1α蛋白在缺氧各时间点(2、4、8、12 h和16 h)的表达均高于常氧(0 h);缺氧2 h,HIF-1α蛋白表达迅速升高,随后缓慢下降,至12 h表达降至最低;缺氧延长至16 h,HIF-1α蛋白表达恢复且达到高峰(图 4),表明HIF-1α mRNA和蛋白随着缺氧时间延长均呈现先降低后升高的趋势。之后我们利用实时定量PCR方法检测Caco-2细胞中miRNA-200b的表达。如图 5所示,缺氧处理后(2~16 h),miRNA-200b的表达较常氧环境下(0 h),均有所降低;缺氧2 h后,随着缺氧时间的延长,miRNA-200b表达缓慢升高,至12 h恢复至常氧的表达量;缺氧16 h,表达量减少至与2 h相当。处于缺氧环境下的Caco-2细胞,miRNA-200b在12 h表达量最高,2 h和16 h最低;而HIF-1α在12 h表达量降至最低,16 h达到顶峰,提示HIF-1a和miRNA-200b在缺氧Caco-2细胞中的表达呈现相反的趋势。
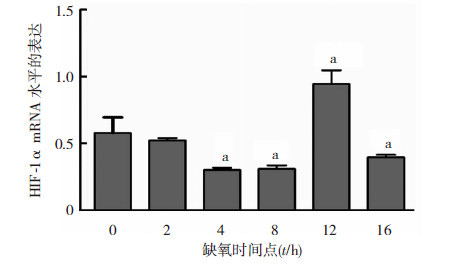 |
| a: P<0.05,与常氧0 h细胞中HIF-1α mRNA表达水平的比较 图 3 Caco-2细胞在不同缺氧时间点其HIF-1α mRNA的表达水平 |
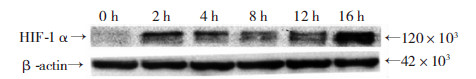 |
| 图 4 Western blot检测Caco-2细胞在不同缺氧时间点其HIF-1α 蛋白的表达水平 |
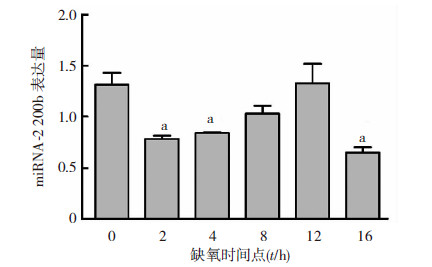 |
| a: P<0.01,与常氧0 h细胞中miRNA-200b水平的比较图 5 Caco-2细胞在不同缺氧时间点其miRNA-200b的表达水平 |
已证明结肠癌组织中HIF-1α与miRNA-200b的表达存在负相关(r=-0.32,P<0.05),为探讨缺氧处理的结肠癌细胞中HIF-1α与miRNA-200b的相关性,利用Pearson相关性分析方法检验HIF-1α与miRNA-200b在不同缺氧时间点的表达呈负相关(r=-0.8166,P<0.05,图 6)。
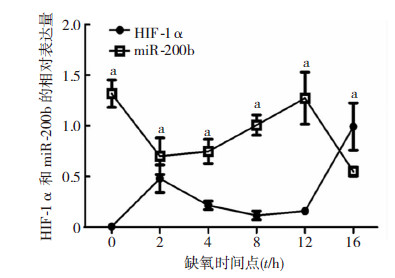 |
| a: P<0.05,与常氧0 h细胞中miRNA-200b水平的比较 图 6 不同缺氧时间点Caco-2细胞中HIF-1α与miRNA-200b的表达 |
结直肠癌是我国常见的消化系统恶性肿瘤,预后差,且肿瘤血供丰富,易发生远处转移及复发,致使患者死亡。研究表明[12, 13, 14],缺氧可以促进肿瘤细胞侵袭、转移及肿瘤细胞EMT过程。其中缺氧诱导因子HIF-1为缺氧主要的应答因子,活性基团为HIF-1α[15]。HIF-1α能够影响肿瘤细胞EMT指标蛋白的转录,促使肿瘤EMT转化,从而参与肿瘤转移过程。肿瘤细胞为了适应缺氧微环境,使得HIF-1α表达异常,进而调控如血管内皮生长因子(vascular endothelial growth factor,VEGF);促红细胞生成素(erythropoietin,EPO)等基因的转录和表达,从而使肿瘤细胞耐受缺氧环境并促进其生长、侵袭和远处转移。上述基因的启动子、增强子或者其他调控区域均含有低氧反应元件(hypoxia response element,HRE),其保守序列为:5-RCGTG-3 [16],HIF-1α转录因子可与HRE元件结合从而调控基因的表达。
关于miRNAs与肿瘤相关性的研究有大量的报道,其中miR-200家族主要参与肿瘤EMT的调控过程,miR-200家族由miR-200a、miR-200b、miR-429、miR-200c、miR-141五个成员构成。其中miRNA-200b可以抑制肿瘤的形成与转移[17]维持肿瘤细胞的上皮特性[18],通过作用于EMT转录因子ZEB1和ZEB2阻滞细胞的侵袭转移。目前,对于常氧条件下MicroRNA-200家族的肿瘤抑制功能及调节机制研究较多,而缺氧条件下对MicroRNA-200家族调控及其功能的研究则较少。
本实验通过研究HIF-1α与miRNA-200b在50例结肠癌组织及缺氧条件下结直肠癌细胞中的表达,发现HIF-1α与miRNA-200b在结肠癌组织中的表达存在明显的负相关(r=-0.32,P<0.05)。利用CoCl2模拟化学缺氧并检测结直肠癌细胞Caco-2中HIF-1α及miRNA-200b的表达,发现缺氧2 h的HIF-1α蛋白水平升高,而后随缺氧时间的延长蛋白表达缓慢下降(2~12 h),最后在16 h表达量最高;之前的研究表明,miRNA-200b的表达可受到缺氧的影响,缺氧处理微血管内皮细胞24 h或转染携带HIF-1α的过表达病毒质粒,均导致miRNA-200b的表达受到抑制[19],我们检测到miRNA-200b在缺氧2 h的Caco-2细胞中表达量最低,2~12 h表达逐渐上升,16 h的表达量下降至2 h水平,这与HIF-1α蛋白水平的表达趋势恰恰相反,因此推测,在结直肠癌中HIF-1α可能抑制miRNA-200b的表达。并且我们发现在缺氧早期2~8 h,HIF-1α mRNA的表达逐渐下降而miRNA-200b表达水平的逐渐上升,缺氧8~16 h,miRNA-200b与HIF-1α mRNA水平表达一致,均呈上升趋势。表明缺氧早期和后期,HIF-1α mRNA水平和miRNA-200b之间可能存在不同的调控机制。相关研究表明,miRNA-200家族能结合至HIF-1α和脯氨酰羟化酶(prolyl hydroxylase,PHD)的mRNA 3'端非编码区(3′-untranslational region,3′UTR)从而降解mRNA[20, 21],因此推测结肠癌细胞内可能存在以下3种调节机制:(1)miRNA-200b能结合至HIF-1α mRNA 3'端非编码区,导致HIF-1α mRNA的降解进而影响结肠癌组织的血管的新生;(2)miRNA-200b可能结合至PHD mRNA 3′端非编码区,阻碍PHD蛋白的翻译,从而遏制PHD对HIF-1α的降解作用;(3)HIF-1α通过直接或间接的机制转录遏制miRNA-200b的表达,从而影响miRNA-200b-Zeb1/2的负性调节环而达到影响结肠癌细胞的上皮-间充质化转化的可塑性。上述研究为我们通过HIF-1α-miRNA-200b-EMT途径实现对肿瘤的调节提供依据,这将可能为肿瘤的耐药性以及靶向性治疗提供可行的方案。而在结肠癌中,HIF-1α通过何种机制调控miRNA-200b进而影响EMT发生,需要做进一步的研究。
| [1] | Wouters B G, Weppler S A, Koritzinsky M, et al. Hypoxia as a target for combined modality treatments[J]. Eur J Cancer, 2002, 38(2): 240-257. |
| [2] | Xu R H, Pelicano H, Zhou Y, et al. Inhibition of glycolysis in cancer cells: a novel strategy to overcome drug resistance associated with mitochondrial respiratory defect and hypoxia[J]. Cancer Res, 2005, 65(2): 613-621. |
| [3] | Fidler I J. The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited[J]. Nat Rev Cancer, 2003, 3(6): 453-458. |
| [4] | Christiansen J J, Rajasekaran A K. Reassessing epithelial to mesenchymal transition as a prerequisite for carcinoma invasion and metastasis[J]. Cancer Res, 2006, 66(17): 8319-8326. |
| [5] | Gao D, Vahdat L T, Wong S, et al. Microenvironmental regulation of epithelial-mesenchymal transitions in cancer[J]. Cancer Res, 2012, 72(19): 4883-4889. |
| [6] | Thiery J P. Epithelial-mesenchymal transitions in development and pathologies[J]. Curr Opin Cell Biol, 2003, 15(6): 740-746. |
| [7] | Yan W, Fu Y, Tian D, et al. PI3 kinase/Akt signaling mediates epithelial-mesenchymal transition in hypoxic hepatocellular carcinoma cells[J]. Biochem Biophys Res Commun, 2009, 382(3): 631-636.DOI:10.1016/j.bbrc.2009.03.088 |
| [8] | Semenza G L. HIF-1 and tumor progression: pathophysiology and therapeutics[J]. Trends Mol Med, 2002, 8(4 Suppl): S62-S67. |
| [9] | 郭小毛, 梅欣, 朱国培, 等. 食管癌常规放疗与三维适形放疗比较及4种不同设野技术的剂量学研究[J]. 中国癌症杂志, 2005, 15( 5) : 462-465. |
| [10] | Zhu R, Yang Y, Tian Y, et al. Ascl2 knockdown results in tumor growth arrest by miRNA-302b-related inhibition of colon cancer progenitor cells[J]. PLoS One, 2012, 7(2): e32170. |
| [11] | 李姗姗, 钟小莉, 尚阳阳, 等. Ascl2和microRNA-200家族在结肠癌组织和癌旁组织中的定量表达及二者的相关性分析[J].第三军医大学学报, 2014, 36(23): 2377-2379. |
| [12] | Le QT, Denko NC, Giaccia AJ. Hypoxic gene expression and metastasis[J]. Cancer Metastasis Rev. 2004; 23(3-4): 293-310. |
| [13] | Guo J, Wang B, Fu Z, et al. Hypoxic Microenvironment Induces EMT and Upgrades Stem-Like Properties of Gastric Cancer Cells[J]. Technol Cancer Res Treat, 2015. . |
| [14] | Harten S K, Shukla D, Barod R, et al. Regulation of renal epithelial tight junctions by the von Hippel-Lindau tumor suppressor gene involves occludin and claudin 1 and is independent of E-cadherin[J]. Mol Biol Cell, 2009, 20(3): 1089-1101.DOI:10.1091/mbc.E08-06-0566 |
| [15] | Kaelin W G Jr. How oxygen makes its presence felt[J]. Genes Dev, 2002, 16(12): 1441-1445. |
| [16] | Semenza G L, Jiang B H, Leung S W, et al. Hypoxia response elements in the aldolase A, enolase 1, and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxia-inducible factor 1[J]. J Biol Chem, 1996, 271(51): 32529-32537.DOI:10.1371/journal.pone.0083991 |
| [17] | Williams L V, Veliceasa D, Vinokour E, et al. miR-200b inhibits prostate cancer EMT, growth and metastasis[J]. PLoS One, 2013, 8(12): e83991. |
| [18] | Tian Y, Pan Q, Shang Y, et al. MicroRNA-200 (miR-200) cluster regulation by achaete scute-like 2 (Ascl2): impact on the epithelial-mesenchymal transition in colon cancer cells[J]. J Biol Chem, 2014, 289(52): 36101-36115.DOI:10.1074/jbc.M114.598383 |
| [19] | Chan Y C, Khanna S, Roy S, et al. miR-200b targets Ets-1 and is down-regulated by hypoxia to induce angiogenic response of endothelial cells[J]. J Biol Chem, 2011, 286(3): 2047-2056. |
| [20] | Bartoszewska S, Kochan K, Piotrowski A, et al. The hypoxia-inducible miR-429 regulates hypoxia-inducible factor-1alpha expression in human endothelial cells through a negative feedback loop[J]. FASEB J, 2015, 29(4): 1467-1479.DOI:10.1096/fj.14-267054 |
| [21] | Lee S T, Chu K, Jung K H, et al. MicroRNAs induced during ischemic preconditioning[J]. Stroke, 2010, 41(8): 1646-1651.DOI:10.1161/STROKEAHA.110.579649 |



