2. 400038 重庆,第三军医大学高原军事医学系高原生理学与高原生物学教研室,高原医学教育部重点实验室,全军高原医学重点实验室
2. Department of High Altitude Physiology and High Altitude Biology, College of High Altitude Military Medicine, Key Laboratory of High Altitude Medicine of Ministry of Education, Key Laboratory of High Altitude Physiology and High Altitude Disease, Third Military Medical University, Chongqing, 400038, China
高原心脏病是威胁高原人群的重要疾病。高原低压缺氧引起肺动脉高压,增加右心室负荷,引起心肌肥大,甚至心力衰竭。低压缺氧暴露时,心肌肥大的重要病理特征之一就是右心室心肌纤维化。心肌纤维化发生发展的过程中,主要表现为细胞外基质(extracellular matrix,ECM)的合成与降解间的失衡[1],心脏成纤维细胞(cardiac fibroblast,cFB)大量增生。cFB是ECM产生和维持的重要细胞,在病理刺激下,cFB可发生增殖、迁移、合成和分泌胶原,以及一些细胞因子,从而引起心肌纤维化[2]。细胞因子在cFB增殖、分泌等方面发挥广泛作用,是纤维化的重要环节[3]。其中转化生长因子β(transforming growth factor β,TGF-β)、结缔组织生长因子(connective tissue growth factor,CTGF)是两种重要的促纤维化因子,与多种器官的纤维化有关。例如,在血管紧张素刺激下引起的心肌纤维化模型中,这两个细胞因子发挥了重要作用[4]。但是,在低压缺氧导致心肌纤维化过程中,TGF-β、CTGF的变化与作用尚少见报道。本研究利用大鼠低压缺氧模型,旨在研究低压缺氧条件下TGF-β与CTGF表达的变化特点,及其与心肌纤维化、心肌肥大之间的关系,为揭示高原心脏病的发生机制以及寻求有效的治疗靶点提供线索和依据。
1 材料与方法 1.1 实验动物及分组50只8周龄SD雄性大鼠由第三军医大学实验动物中心提供,体质量(188.6±19.3) g。将50只雄性SD大鼠随机分为常氧喂养对照组与低压缺氧喂养3、7、14和28 d实验组,每组10 只,低压缺氧大鼠置于模拟海拔6 000 m的低压舱内饲养,动物常规分笼饲养,自由饮水。
1.2 右心肥厚指数测定处死大鼠,完整取出心脏,剪去心房组织,沿室间隔边缘剪下右心室,用生理盐水将血冲洗干净后,用滤纸吸干水分,分别称取右心室(right ventricle,RV)、左心室(left ventricle,LV)和室间隔(interventricular septum,S)质量,并计算右心室肥厚指数(right ventricular hypertrophy index,RVHI),即RV:(LV+S)。
1.3 反转录实时荧光定量PCR(real-time PCR,RT-PCR)将各组获得的右心室,剪取一定量提取右心室心肌组织总RNA(Omega总RNA提取试剂盒),用逆转录试剂盒(TaKaRa)反转录RNA,PCR使用SYBR Green real-time PCR试剂盒(TaKaRa),CTGF 的上游引物为5′-TCAACCTCAGACACTGGTTTCG -3′,下游引物为5′-TAGAGCAGGTCTGTCTGCAAGC-3′;TGF-β的上游引物5′-GTCTCCCAAGGAAAGGTAGG-3′,下游引物为5′-CTCTTGAGTCCCTCGCATCC-3′;COL-Ⅰ的上游引物为5′-CAACAGTCGCTTCACCTACAGC-3′,下游引物为5′-GTGGAGGGAGTTTACACGAAGC-3′;内参照18S的上游引物为5′-TGAGAAACGGCTACCACATCC-3′,下游引物为5′-GCACCAGACTTGCCCTCCA-3′。
1.4 Western blot 检测利用全蛋白提取试剂盒提取心脏右心室心肌组织总蛋白,行SDS-PAGE电泳,转移至PVDF膜上,室温封闭2 h,洗膜后加入一 抗Ⅰ型胶原(collagen Ⅰ,COL-Ⅰ,购自ROCKLAND,600-401-103S),TGF-β(购自Abcam,ab60043),CTGF(购自Abcam,ab6992),4 ℃过夜,TBST洗3次,加相应二抗辣根过氧化酶标记山羊抗小鼠(碧云天,A0216)或辣根过氧化酶标记山羊抗兔(碧云天,A0208),ECL显影。内参选用β-actin抗体。用Image J图像分析软件对条带进行分析。
1.5 统计学处理采用SPSS 13.0统计软件对实验数据进行分析,计量资料采用x±s表示,采用单因素方差分析及相关分析。
2 结果 2.1 低压缺氧后右心室肥厚指数变化如图 1所示。随低压缺氧时间增加,右心室心肌组织中低压缺氧各组右心室肥厚指数均升高,低压缺氧7、14、28 d组与常氧组差异具有统计学意义(P < 0.05)。
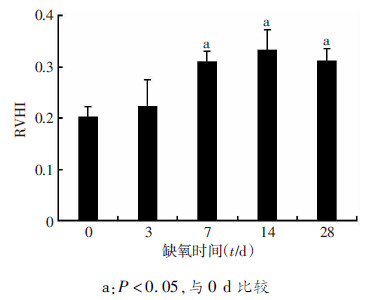 |
| a:P < 0.05,与0 d比较 图 1 低压缺氧时大鼠右心室肥厚指数的变化(n=10,x±s) |
低压缺氧后,COL-Ⅰ表达水平随低压缺氧时间延长而增加,其蛋白水平在低压缺氧7、14、28 d组显著增加,其差异具有统计学意义(P < 0.05,图 2)。
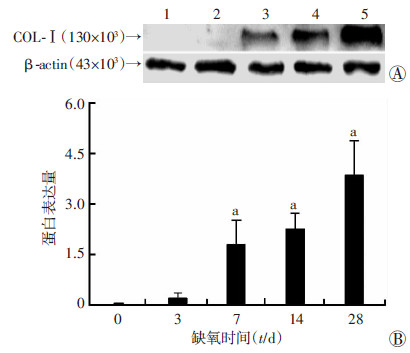 |
| A:Western blot检测 1~5分别为缺氧0、3、7、14、28 d;B:半定量分析(n=10,x±s) a:P < 0.05,与0 d比较 图 2 低压缺氧对大鼠右心室心肌组织中COL-Ⅰ水平的影响 |
在低压缺氧诱导下,心脏右心室中TGF-β表达水平随时间有不同变化(图 3),蛋白水平在低压缺氧3 d组显著增加且差异具有统计学意义(P < 0.05),低压缺氧7、14 d回降,与常氧组相比差异无统计学意义,蛋白水平在低压缺氧28 d组显著增加,与常氧组相比差异具有统计学意义(P < 0.05)。
 |
| A:Western blot检测 1~5分别为缺氧0、3、7、14、28 d;B:半定量分析(n=10, x±s) a: P < 0.05, 与0 d比较 图 3 低压缺氧对大鼠右心室心肌组织中TGF-β表达的影响 |
在低压缺氧诱导下,心脏右心室中CTGF表达水平随时间有不同变化(图 4),蛋白水平在低压缺氧3 d组显著增加且差异具有统计学意义(P < 0.05),低压缺氧7、14 d回降,与常氧组相比差异无统计学意义,蛋白水平在低压缺氧28 d组显著增加,与常氧组相比差异具有统计学意义(P < 0.05)。
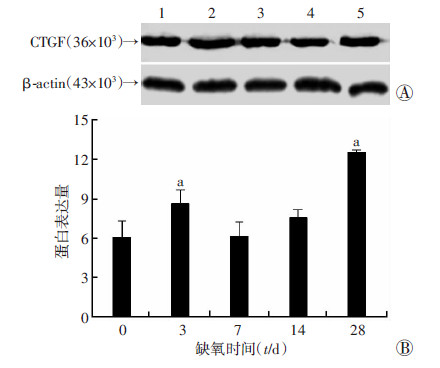 |
| A:Western blot检测 1~5分别为缺氧0、3、7、14、28 d;B:半定量分析(n=10, x±s) a:P < 0.05,与0 d比较 图 4 低压缺氧对大鼠右心室心肌组织中CTGF表达的影响 |
常氧组与低压缺氧3、7和14 d组,COL-Ⅰ与RVHI水平呈显著正相关(P < 0.05),说明COL-Ⅰ表达水平与右室肥大有关。以COL-Ⅰ反映心肌纤维化程度,分析两因子与纤维化的相关关系,发现低压缺氧3、7和14 d内TGF-β、CTGF mRNA水平均与其呈显著正相关(P < 0.05)。分析与RVHI的相关性时,发现低压缺氧3、7、14和28 d组,两因子与之呈显著呈正相关(P < 0.05,表 1)。
| 实验条件 | 0 d | 3 d | 7 d | 14 d | 28 d |
| COL-Ⅰ vs TGFβ | 0.994a | 0.983a | 0.854a | 0.846a | -0.77 |
| COL-Ⅰ vs CTGF | 0.659 | 0.916a | 0.894a | 0.798 | 0.259 |
| RVHI vs TGF | 0.993a | 0.978a | 0.912a | 0.962a | 0.753 |
| RVHI vs CTGF | 0.734 | 0.944a | 0.968a | 0.926a | 0.865 |
| RVHI vs COLI | 0.942a | 0.969a | 0.971a | 0.939a | 0.452 |
| TGF-β vs CTGF | 0.726 | 0.92a | 0.908a | 0.979a | 0.926 |
| a:P < 0.05 | |||||
心肌纤维化是心肌重塑、心肌肥大的重要病理特点,而心肌纤维化是以胶原、弹性蛋白等细胞外基质的大量沉积为基础的病理生理过程。本研究以Ⅰ型胶原表达水平反映低压缺氧时心肌组织纤维化程度,结果发现,随着低压缺氧时间延长,右心室心肌组织中Ⅰ型胶原含量逐渐增多,而且与右心室肥厚指数在各组内均呈现显著正相关,提示低压缺氧右心室心肌纤维化与其肥大有关。
组织纤维化由多种细胞因子参与作用形成。其中TGF-β可调节细胞生长和分化,并与心肌纤维化作用密切相关。本研究发现,在缺氧早期(3 d)TGF-β即发挥作用。TGF-β不仅可以促进ECM表达与分泌、抑制细胞外基质降解[5],而且可以促进cFB增殖并分化为肌成纤维细胞[5]。TGF-β还可以诱导血管平滑肌细胞分泌成纤维细胞生长因子等其他细胞因子,在组织纤维化中发挥作用[6]。本研究发现,常氧组与低压缺氧3、7和14 d组,TGF-β与Ⅰ型胶原的表达水平均呈显著正相关,而低压缺氧28 d组,TGF-β与Ⅰ型胶原mRNA水平没有显著相关,但其与右心肥厚指数之间存在显著正相关。结果提示,TGF-β在缺氧时心肌重塑中发挥重要作用。另外,缺氧28 d时心肌胶原沉积可能由早期升高的TGF-β作用引起,在低压缺氧 3 d 时显著增高的TGF-β可促进促纤维化细胞浸润、间质细胞增殖以及相关细胞因子的表达与分泌,低压缺氧7、14 d基本恢复到常氧组水平,也支持了这一点。后 期的心肌纤维化也有可能与其他细胞因子的作用有关。
CTGF也是一种重要的促纤维化蛋白,可由成纤维细胞、内皮细胞等多种细胞表达与分泌,调节细胞增殖、ECM的产生,抑制细胞外基质降解酶[7, 8, 9, 10]。本研究发现CTGF表达在不同低压缺氧时间表达量有变化,而且与TGF-β表达变化特点相似,即均在低压缺氧3 d表达显著增多,随后回降,于低压缺氧28 d再次增加。将CTGF与TGF-β进行相关分析,发现两者呈显著正相关,也说明了两因子的表达之间存在相互作用。文献[10, 11]报道,在纤维化的过程中,CTGF被 认为是TGF-β的下游分子。正常情况下,心脏中CTGF 未见大量表达,病理性损伤可刺激成人心脏TGF-β的产生,从而引起CTGF大量增加[11]。CTGF的mRNA 水平与TGF-β呈正相关,验证了TGF-β可促进CTGF产 生[12, 13]。文献[14, 15]报道,在心肌纤维化发生发展的过程中,胶原沉积处检测到CTGF大量增加。结果提示,TGF-β通过影响CTGF的mRNA水平,一起 促进心肌纤维化在低压缺氧引起的心肌肥大中发挥作用,在低压缺氧后期,此两细胞因子尚可能通过其他机 制作用于心肌肥大的形成。也有研究表明,敲除TGF-β、 CTGF,或使其过度表达,心肌纤维化的变化并不显著[11],甚至结果相反[16, 17]。这些不一致的研究结果可能与刺激的方式以及刺激时间有关。
在低压缺氧暴露时,右心室心肌组织中产生大量TGF-β,作用于心肌组织中的各种细胞,进一步产生CTGF,两者刺激间质细胞等多种细胞,促进其增殖、分化、产生细胞外基质等,促进心肌纤维化。针对性适时控制这些细胞因子的作用,延缓心肌纤维化的发生,有望成为控制高原心脏病发生发展的新靶点,对于促进高原习服进程,维护高原人群的健康有十分重要的意义。
| [1] | Martos R, Baugh J, Ledwidge M, et al. Diastolic heart failure: evidence of increased myocardial collagen turnover linked to diastolic dysfunction[J]. Circulation, 2007, 115(7): 888-895. DOI:10.1161/Circulationaha.106.638569 |
| [2] | Banerjee I, Yekkala K, Borg T K, et al. Dynamic interactions between myocytes, fibroblasts, and extracellular matrix[J]. Ann Ny Acad Sci, 2006, 1080(1):76-84. DOI:10.1196/annals.1380.007 |
| [3] | Accornero F, van-Berlo J H, Correll R N, et al. Genetic Analysis of Connective Tissue Growth Factor as an Effector of Transforming Growth Factor beta Signaling and Cardiac Remodeling[J]. Mol Cell Biol, 2015, 35(12): 2154-2164. DOI:10.1128/Mcb.00199-15 |
| [4] | Rosin N L, Falkenham A, Sopel M J, et al. Regulation and role of connective tissue growth factor in AngⅡ-induced myocardial fibrosis[J]. Am J Pathol, 2013, 182(3): 714-726. DOI:10.1016/j.ajpath.2012.11.014 |
| [5] | Leask A. Potential therapeutic targets for cardiac fibrosis: TGFbeta, angiotensin, endothelin, CCN2, and PDGF, partners in fibroblast activation[J]. Circ Res, 2010, 106(11): 1675-1680. DOI:10.1161/CIRCRESAHA.110.217737 |
| [6] | Huntgeburth M, Tiemann K, Shahverdyan R, et al. Transforming growth factor beta(1) oppositely regulates the hypertrophic and contractile response to beta-adrenergic stimulation in the heart[J]. PLoS One, 2011, 6(11): e26628. DOI:10.1371/journal.pone.0026628 |
| [7] | Leask A. Targeting the TGFbeta, endothelin-1 and CCN2 axis to combat fibrosis in scleroderma[J]. Cell Signal, 2008, 20(8): 1409-1414. DOI:10.1016/j.cellsig.2008.01.006 |
| [8] | M’yakush O, Y Verbovyts’kyi, I Saldan, et al. Synthesis and determination of the crystal structure of hydrides of Er(M, V)(2), where M = Fe or Co, compounds[J]. Mater Sci, 2004, 40(6): 781-786. DOI:10.1007/s11003-005-0115-9 |
| [9] | Blaney-Davidson E N, Vitters E L, Mooren F M, et al. Connective tissue growth factor/CCN2 overexpression in mouse synovial lining results in transient fibrosis and cartilage damage[J]. Arthritis Rheum, 2006, 54(5): 1653-1661. DOI:10.1002/art.21795 |
| [10] | Shi-wen X, Stanton L A, Kennedy L et al. CCN2 is necessary for adhesive responses to transforming growth factor-beta1 in embryonic fibroblasts[J]. J Biol Chem, 2006, 281(16): 10715-10726. DOI:10.1074/jbc.M511343200 |
| [11] | Accornero F, van-Berlo J H, Correll R N, et al. Genetic Analysis of Connective Tissue Growth Factor as an Effector of Transforming Growth Factor beta Signaling and Cardiac Remodeling[J]. Mol Cell Biol, 2015, 35(12): 2154-2164. DOI:10.1128/MCB.00199-15 |
| [12] | Igarashi A, Okochi H, Bradham D M, et al. Regulation of connective tissue growth factor gene expression in human skin fibroblasts and during wound repair[J]. Mol Biol Cell, 1993, 4(6): 637-645. |
| [13] | Bradham D M, Igarashi A, Potter R L, et al. Connective tissue growth factor: a cysteine-rich mitogen secreted by human vascular endothelial cells is related to the SRC-induced immediate early gene product CEF-10[J]. J Cell Biol, 1991, 114(6): 1285-1294. |
| [14] | Behnes M, Brueckmann M, Lang S, et al. Connective tissue growth factor (CTGF/CCN2): diagnostic and prognostic value in acute heart failure[J]. Clin Res Cardiol, 2014, 103(2):107-116. DOI: 10.1007/s00392-013-0626-6 |
| [15] | Koshman Y E, Patel N, Chu M, et al. Regulation of Connective Tissue Growth Factor Gene Expression and Fibrosis in Human Heart Failure[J]. J Card Fail, 2013, 19(4): 283-294. DOI:10.1016/j.cardfail.2013.01.013 |
| [16] | Gravning J, Orn S, Kaasboll O J, et al. Myocardial connective tissue growth factor (CCN2/CTGF) attenuates left ventricular remodeling after myocardial infarction[J]. PLoS One, 2012, 7(12): e52120. DOI: 10.1371/journal.pone.0052120 |
| [17] | Gravning J, Ahmed M S, von-Lueder T G, et al. CCN2/CTGF attenuates myocardial hypertrophy and cardiac dysfunction upon chronic pressure-overload[J]. Int J Cardiol, 2013, 168(3): 2049-2056. DOI:10.1016/j.ijcard.2013.01.165 |



