2. 400042 重庆,第三军医大学大坪医院野战外科研究所第一研究室,创伤、烧伤与复合伤国家重点实验室
2. State Key Laboratory of Trauma, Burns and Combined Injury, Department 1, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042, China
氧化应激是指体内氧化与抗氧化作用的失衡,主要由过量产生的活性氧(reactive oxygen species,ROS)引起。正常情况下,体内的抗氧化酶如SOD和CAT会清除多余的ROS,使其维持生理浓度,参与机体的信号转导[1]。但是当细胞遭受脂多糖(lipopolysaccharides,LPS)[2]等外源性刺激时会产生大量的ROS,导致自由基的集聚。自由基的过度产生会直接损伤DNA、蛋白质和细胞器,促进细胞凋亡以及启动炎症介质的产生[3],引发各种疾病,比如糖尿病、神经退行性疾病(帕金森病、阿尔茨海默病)、心血管疾病(动脉粥样硬化和高血压)和各种癌症[4]。因此,阻断ROS过度产生,从而减少炎症介质,能够及时有效地控制相关疾病的发生与发展。胍丁胺(agmatine,AGM)是由精氨酸脱羧形成的生物胺,广泛存在于哺乳动物体内。本课题组前期研究证实,在酵母多糖诱导的小鼠急性肺损伤模型中,AGM能抑制酵母多糖诱导的NF-κB活化,从而抑制炎症因子白介素-1β(IL-1β)、IL-6和TNF-α的产生[5]。然而AGM是否具有抗氧化、抗凋亡等保护作用目前尚不清楚。本研究观察AGM在巨噬细胞的抗氧化作用并分析其机制,为对抗氧化应激和炎症疾病提供新的干预手段。
1 材料与方法 1.1 主要材料AGM酸盐(纯度≥97%)、LPS及DCFH-DA探针购自美国Sigma公司,胰蛋白酶消化液、胎牛血清、RPMI1640培养基、双抗购自美国Gibco公司,BCA蛋白浓度测定试剂盒、核蛋白和细胞质蛋白提取试剂盒及NO试剂盒购自碧云天试剂公司,逆转录和qPCR试剂盒购自TaKaRa公司,兔抗iNOS多克隆抗体及兔抗Nrf2多克隆抗体购自Santa Cruz公司。荧光显微镜为美国OLYMPS产品,流式细胞仪为杭州艾森生物 ACEA NovoCyte产品,酶标仪为美国BioTek产品。荧光定量PCR仪为BioRad公司。
1.2 RAW264.7细胞的体外培养RAW264.7细胞系由第三军医大学大坪医院野战外科研究所提供,培养于含10%胎牛血清、1%双抗的RPMI1640培养液中,置于37 ℃、5% CO2培养箱内,定期换液、传代。
1.3 MTT药物浓度检测取对数生长期的RAW264.7细胞,8 000/孔接种于96孔板,培养8~12 h后,加药物AGM,浓度分别为50、10、2 mmol/L及400、80、16、3.2、0.64、0.128、0 μmol/L(对照),每个浓度3个复孔,作用24 h;每孔加10 μL MTT(5 mg/mL),37 ℃培养4 h;弃上清,加150 μL DMSO/孔溶解沉淀,490 nm测定光密度值[D(490)],以log(AGM浓度)为横坐标,D(490)值为纵坐标,绘制曲线,利用GraphPad Prism软件计算IC50值。
1.4 ROS活性检测取对数生长期的RAW264.7细胞,2×105/孔接种于24孔板,培养8~12 h后用LPS和AGM处理,分为对照组、LPS(10 μg/mL)组、LPS+AGM(1 mmol/L)组、AGM组,作用时间24 h;然后弃培养液,每孔滴加400 μL终浓度为20 μmol/L的DCFH-DA探针(激发波长485 nm,发射波长525 nm,绿色荧光强度与细胞内ROS的产生成正比),37 ℃细胞培养箱内避光孵育30 min;无菌PBS洗涤细胞3次,分别用倒置荧光显微镜、流式细胞仪进行荧光强度的观察和检测。
1.5 NO浓度测定取对数生长期的RAW264.7细胞,2×105/孔接种于24孔板,培养8~12 h后用LPS和AGM处理,分为对照组、LPS(10 μg/mL)组、LPS+AGM(1 mmol/L)组、AGM组,作用时间24 h;收集上清,按照碧云天总NO检测试剂盒操作,通过经典的Griess reagent检测亚硝酸盐从而测定出总NO。
1.6 Western blot检测细胞内iNOS及细胞质、细胞核内Nrf2蛋白的表达取对数生长期的RAW264.7细胞,5×106/孔接种于10 cm培养皿;培养8~12 h后用LPS和AGM处理,分为对照组、LPS(10 μg/mL)组、LPS+AGM(1 mmol/L)组、AGM组,作用时间24 h; PBS洗涤细胞,提总蛋白(检测iNOS蛋白)和细胞质、细胞核蛋白(检测Nrf2蛋白),蛋白定量后,制备蛋白样品,按常规Western blot法电泳、转膜、5%脱脂奶粉封闭、孵育一抗和二抗,ECL显影,凝胶成像系统曝光。
1.7 RT-PCR检测Nrf2下游抗氧化酶HO-1的表达取对数生长期的RAW264.7细胞,1×106/孔接种于6孔板;培养8~12 h后用LPS和AGM处理,分为对照组、LPS(10 μg/mL)组、LPS+AGM(1 mmol/L)组、AGM组,作用30 h;PBS洗涤细胞,加1 mL TRIzol/孔,提取总RNA,测定RNA浓度及D(260)/D(280);按TaKaRa RR047A试剂盒操作,取1 μg RNA反转录成cDNA;按TaKaRa RR820A试剂盒操作,进行qPCR定量分析,引物序列见表 1。扩增条件:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,40个循环。根据得到的Ct值,采用2-ΔCt方法(ΔCt=Ct样品-Ctβ-actin)分别计算基因表达量。
| 基因名 | 5′→3′ | 片段大小(bp) |
| IL-6 | 上游引物:ACCACGGCCTTCCCTACTTC 下游引物:CTCATTTCCACGATTTCCCAG | 134 |
| HO-1 | 上游引物: AAGCCGAGAATGCTGAGTTCA 下游引物: GCCGTGTAGATATGGTACAAGGA | 100 |
| β-actin | 上游引物:GAGACCTCAACACCCCAGC 下游引物:ATGTCACGCACGATTTCCC | 256 |
各实验重复3次。采用SPSS 17.0统计软件,计量资料用x±s表示,行单因素方差分析。
2 结果 2.1 MTT检测AGM无毒性浓度AGM药物的MTT实验结果见图 1,以log(AGM浓度)为横坐标,D(490)为纵坐标,绘制曲线,软件计算半抑制浓度(IC50)=5.4 mmol/L,则1 mmol/L AGM在曲线的上平台期,说明该浓度对细胞无毒害作用。
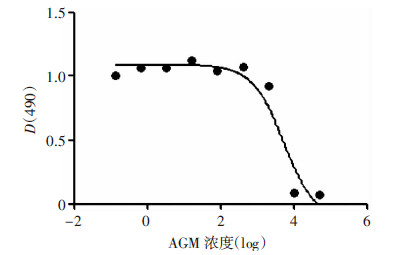 |
| 图 1 胍丁胺的浓度梯度 |
10 μg/mL LPS刺激,1 mmol/L AGM共同作用24 h,用DCFH-DA探针检测AGM对LPS诱导的RAW264.7细胞内ROS的变化。荧光检测(图 2)显示:LPS刺激24 h后,细胞内ROS产生明显增多,而AGM干预后能显著降低ROS的产生。进一步对荧光强度进行定量检测,流式细胞仪检测(图 3)显示,与对照组相比,LPS刺激组平均荧光强度明显增强(P<0.05),AGM干预组平均荧光强度较LPS组明显减少(P<0.05)。3次独立实验获得类似结果。
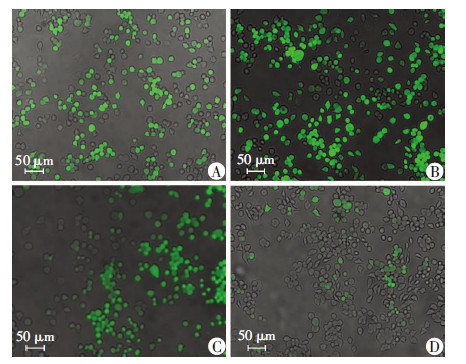 |
| A:对照组;B:LPS 10 μg/mL组;C:LPS 10 μg/mL+AGM 1 mmol/L组;D:AGM组 图 2 倒置荧光显微镜观察药物作用24 h后各组ROS的产生 |
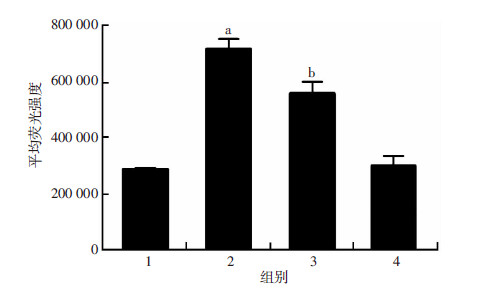 |
| 1:对照组;2:LPS 10 μg/mL组;3:LPS 10 μg/mL+AGM 1 mmol/L组;4:AGM组 a:P<0.05,与对照组比较;b:P<0.05,与LPS 10 μg/mL组比较 图 3 流式细胞仪检测药物作用24 h后各组ROS的产生 (n=3, x±s) |
AGM单独组与对照组NO的产生无明显差异;LPS作用RAW264.7细胞24 h后,NO明显高于对照组;AGM加入后其NO表达量明显降低(P<0.05),说明AGM可抑制LPS诱导的NO的产生。进一步检测NO产生所需要的酶iNOS的变化发现,对照组与AGM单独组iNOS的产生无明显差异;LPS作用24 h后,iNOS 的产生明显高于对照组;AGM干预后其表达量明显降低(P<0.05),说明AGM可通过抑制iNOS蛋白的表达从而减少NO的产生。见图 4。
 |
| 1:对照组;2:LPS 10 μg/mL组;3:LPS 10 μg/mL+AGM 1 mmol/L组;4:AGM组A:定量分析(n=3, x±s) a:P<0.05,与对照组比较;b:P<0.05,与LPS 10 μg/mL组比较;B:Western blot检测 图 4 Griess法测定药物作用24 h后NO的变化及Westernblot检测iNOS蛋白的表达 |
LPS刺激RAW264.7细胞24 h,Western blot检测显示各组细胞质内Nrf2蛋白无明显差异。细胞核内AGM干预组Nrf2水平较LPS组明显增加,AGM单独组较空白对照组明显增加(图 5A)。说明AGM促进转录因子Nrf2入核。PT-PCR结果显示:LPS刺激30 h后,细胞内炎症因子IL-6产生明显增多(图 5B),说明LPS造模成功,同时AGM干预后IL-6显著降低,与本课题组前期报道AGM有抗炎作用相一致[5]。同时检测Nrf2下游抗氧化酶基因HO-1 mRNA的表达,发现AGM干预后HO-1表达明显增加(图 5C)。说明AGM通过活化转录因子Nrf2的入核,促进下游抗氧化酶 HO-1的表达,从而抑制活性氧的产生。
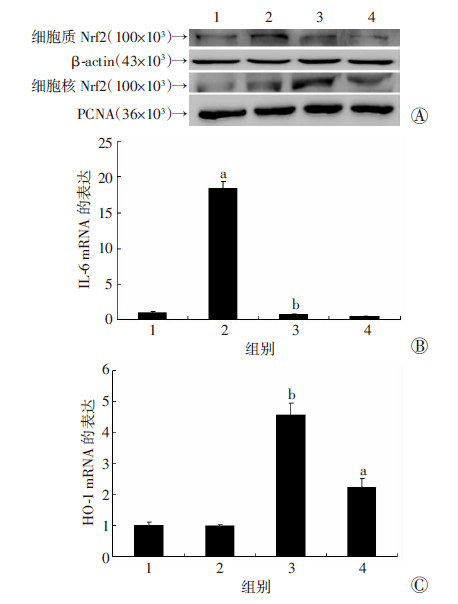 |
| 1:对照组;2:LPS 10 μg/mL组;3:LPS 10 μg/mL+AGM 1 mmol/L组;4:AGM组A:Western blot检测Nrf2蛋白表达;B:半定量分析IL-6 mRNA表达(n=3, x±s);C:半定量分析HO-1 mRNA表达(n=3, x±s) a:P<0.05,与对照组比较;b:P<0.05,与LPS 10 μg/mL组比较 图 5 药物作用24 h后细胞质、细胞核内Nrf2蛋白的表达及药物作用30 h后IL-6、HO-1 mRNA表达 |
AGM是近年发现的一种生物胺类,在体内具有多种生物功能。研究表明AGM在各种损伤和疾病模型中具有抗氧化作用:如在氧化应激损伤的线粒体模型中AGM可清除ROS产生[6, 7];动物模型中,AGM可改善氧化还原失衡状态[8, 9];在氧化应激损伤的细胞模型中,AGM也表现出其抗氧化活性[10, 11, 12]。但是AGM对LPS诱导的巨噬细胞的氧化应激损伤是否有抑制作用及其具体机制尚少见报道。
ROS在LPS诱导的巨噬细胞活化中起重要作用[13]。NO是Nrf2信号通路调节的另一个重要分子,当受到LPS攻击时可产生大量的NO导致氧化应激和炎症[14]。本实验中以LPS模拟RAW264.7细胞氧化应激,LPS刺激24 h后,细胞内ROS、NO产生增多,说明细胞发生明显的脂质过氧化反应。加入AGM干预后能明显降低ROS和NO的产生,提示AGM通过清除ROS和抑制NO生成表现其抗氧化活性。
研究表明核转录因子Nrf2在细胞氧化应激中起关键的保护作用。Nrf2属于 cap′n′collar(CNC)亮氨酸拉链转录激活因子家族。正常情况下,Nrf2与Keap1结合以非活性的形式位于细胞质内,被泛素蛋白酶体途径迅速降解。当受到亲电试剂或活性氧的信号攻击后,Nrf2从Keap1中解离,并从细胞质转位进入细胞核内与ARE结合,从而激活多种抗氧化基因和Ⅱ相酶基因的转录,如HO-1、NOQ-1、γ-GCS等参与ROS的清除[15, 16]。HO-1是广泛存在于人体多种器官和组织的一种抗氧化酶,它可以催化血红素降解为一氧化碳(CO,可诱导血管扩张)、胆绿素(在胆绿素还原酶的作用下,能迅速产生内源性抗氧化剂胆红素)和铁。生理状态下HO-1在细胞内低表达,可被多种因素包 括缺氧和ROS等刺激后迅速增加。HO-1的上调有助于增强细胞对刺激的反应[17]。HO-1因保护巨噬细胞免受ROS的攻击,最近已经成为抗氧化药物的发展目标。
本实验证实AGM可增强Nrf2核转位,并在转录水平上表现对抗氧化酶HO-1的诱导作用。Western blot检测显示:LPS组Nrf2主要在细胞质中表达,而加入AGM干预后细胞核内可见较强的Nrf2的表达,表明AGM可明显促进Nrf2转入细胞核内。RT-PCR结果显示,AGM干预组HO-1 mRNA的表达较LPS组明显增加,AGM单独组HO-1 mRNA的表达较对照组明显增加。综上所述,AGM可能通过影响细胞质中Nrf2-Keap1复合体的分离,使Nrf2被释放出来,并促进其入核,增强与ARE的结合,激活抗氧化酶基因HO-1的表达[18],从而增加CO、胆红素的含量来增强细胞的抗氧化能力。我们做出假设:AGM可能氧化Keap1蛋白上的特定残基,从而使Nrf2活化。需要进一步的研究来验证这一假设。
综上所述,在LPS刺激的巨噬细胞中,AGM可抑制ROS的生成、NO的过量产生。其分子机制是通过促进Nrf2入核,上调抗氧化酶基因HO-1的表达来实现其抗氧化作用。这一发现可能为使用抗氧化药物和化合物对抗氧化应激和组织损伤、脓毒症和内毒素休克等过度炎症疾病提供新的治疗方法。
| [1] | 梁馨予, 张婷, 周永, 等.杨梅素减轻高糖诱导的血管内皮细胞氧化应激损伤[J].第三军医大学学报, 2013, 35(21): 2301-2305. |
| [2] | Mo C, Wang L, Zhang J, et al. The crosstalk between Nrf2 and AMPK signal pathways is important for the anti-inflammatory effect of berberine in LPS-stimulated macrophages and endotoxin-shocked mice[J]. Antioxid Redox Signal, 2014, 20(4): 574-588. DOI: 10.1089/ars.2012.5116 |
| [3] | Kunz A, Dirnagl U, Mergenthaler P. Acute pathophysiological processes after ischaemic and traumatic brain injury[J]. Best Pract Res Clin Anaesthesiol, 2010, 24(4): 495-509. DOI: 10.1016/j.bpa.2010.10.001 |
| [4] | Phaniendra A, Jestadi D B, Periyasamy L. Free radicals: properties, sources, targets, and their implication in various diseases[J].Indian J Clin Biochem, 2015, 30(1): 11-26.DOI: 10.1007/s12291-014-0446-0 |
| [5] | Li X, Liu Z, Jin H, et al. Agmat protects against zymosan-induced acute lung injury in mice by inhibiting NF-κB-mediated inflammatory response[J]. Biomed Res Int, 2014, 2014: 583736.DOI: 10.1155/2014/583736 |
| [6] | Arndt M A, Battaglia V, Parisi E, et al. The arginine metabolite agmatine protects mitochondrial function and confers resistance to cellular apoptosis[J]. Am J Physiol Cell Physiol, 2009, 296(6): C1411-C1419. DOI: 10.1152/ajpcell.00529.2008 |
| [7] | Battaglia V, Grancara S, Satriano J, et al. Agmatine prevents the Ca(2+)-dependent induction of permeability transition in rat brain mitochondria[J]. Amino Acids, 2010, 38(2): 431-437. DOI: 10.1007/s00726-009-0402-0 |
| [8] | Freitas A E, Bettio L E, Neis V B, et al. Agmatine abolishes restraint stress-induced depressive-like behavior and hippocampal antioxidant imbalance in mice[J].Prog Neuropsychopharmacol Biol Psychiatry, 2014, 50: 143-150. DOI: 10.1016/j.pnpbp.2013.12.012 |
| [9] | El-Agamy D S, Makled M N, Gamil N M. Protective effects of agmatine against D-galactosamine and lipopolysaccharide-induced fulminant hepatic failure in mice[J].Inflammopharmacology, 2014, 22(3): 187-194. DOI: 10.1007/s10787-013-0188-2 |
| [10] | Freitas A E, Egea J, Buendia I, et al. Agmatine induces Nrf2 and protects against corticosterone effects in hippocampal neuronal cell line[J]. Mol Neurobiol, 2015, 51(3): 1504-1519. DOI: 10.1007/s12035-014-8827-1 |
| [11] | Condello S, Curro M, Ferlazzo N, et al. Agmatine effects on mitochondrial membrane potential and NF-κB activation protect against rotenone-induced cell damage in human neuronal-like SH-SY5Y cells[J]. J Neurochem, 2011, 116(1): 67-75. DOI: 10.1111/j.1471-4159.2010.07085.x |
| [12] | Iizuka Y, Hong S, Kim C Y, et al. Protective mechanism of agmatine pretreatment on RGC-5 cells injured by oxidative stress[J]. Braz J Med Biol Res, 2010, 43(4): 356-358. DOI: 10.1590/S0100-879X2010007500018 |
| [13] | Menon D, Coll R, O’Neill L A, et al. Glutathione transferase omega 1 is required for the lipopolysaccharide-stimulated induction of NADPH oxidase 1 and the production of reactive oxygen species in macrophages[J]. Free Radic Biol Med, 2014, 73: 318-327. DOI: 10.1016/j.freeradbiomed.2014.05.020 |
| [14] | Itoh T, Koketsu M, Yokota N, et al. Reduced scytonemin isolated from Nostoc commune suppresses LPS/IFNγ-induced NO production in murine macrophage RAW264 cells by inducing hemeoxygenase-1 expression via the Nrf2/ARE pathway[J]. Food Chem Toxicol, 2014, 69: 330-338. DOI: 10.1016/j.fct.2014.04.019 |
| [15] | Niture S K, Kaspar J W, Shen J, et al. Nrf2 signaling and cell survival[J]. Toxicol Appl Pharmacol, 2010, 244(1): 37-42.DOI: 10.1016/j.taap.2009.06.009 |
| [16] | Niture S K, Khatri R, Jaiswal A K. Regulation of Nrf2-an update[J]. Free Radic Biol Med, 2014, 66: 36-44.DOI: 10.1016/j.freeradbiomed.2013.02.008 |
| [17] | Paine A, Eiz-Vesper B, Blasczyk R, et al. Signaling to heme oxygenase-1 and its anti-inflammatory therapeutic potential[J]. Biochem Pharmacol, 2010, 80(12): 1895-1903. DOI: 10.1016/j.bcp.2010.07.014 |
| [18] | 郑宏庭. Nrf2通路在糖尿病中的研究进展[J]. 第三军医大学学报, 2014, 36(15): 1552-1556. |



