除减少药物摄取、增加药物外流、改变药物作用靶点、增强DNA损伤后修复和抑制凋亡等经典途径外,肿瘤干细胞(cancer stem cells,CSCs)和上皮间质化(epithelial mesenchymal transitions,EMT)介导肿瘤治疗抵抗[1-2]的观点逐渐兴起。但以上这些单细胞耐药模型并不能完全解释肿瘤获得性耐药机制。最新研究认为肿瘤微环境在耐药中发挥了重要作用。在放疗存活的肺癌细胞中血小板衍生生长因子受体-β(platelet-derived growth factor receptor-beta,PDGFR-β)和干性相关基因大幅度上调[3],但PDGFR-β信号与耐药的关系尚不明确。
几乎一半的人类肿瘤发生了p53突变。突变型p53(mutant p53,mtp53)广泛参与多种化疗药物耐药 与放疗抵抗,表达mtp53的肿瘤干细胞负责肿瘤耐药与复发[4]。三阴性乳腺癌(triple-negative breast cancer,TNBC,ER/PR/HER阴性)占乳腺癌发病率10%~20%,高度低分化与异质性,因侵袭性强、转移率高等高恶性生物学行为与治疗反应差、病死率较高等不良预后成为近年来乳腺癌研究的热点。阿霉素(doxorubicin,Dox)为高效广谱抗癌药,广泛用于TAC、AC-P、AC-T、FAC等乳腺癌化疗方案。因此,本研究以三阴性乳腺癌MDA-MB-231细胞(含纯合子p53R280K)为实验对象,探讨PDGFR-β在阿霉素耐药中的作用及与突变型p53的关系,力求为优化乳腺癌化疗方案提供实验依据。
1 材料与方法 1.1 细胞与材料MDA-MB-231细胞由重庆医科大学病理学教研室提供,DMEM培养基、胎牛血清来自于HyClone公司。人源重组PDGF-DD粉末(GenScript)和阿霉素粉末(Solarbio)均用ddH2O配置成溶液,Wortmannin(Selleck)用DMSO配置。Cell Titer(一步溶解试剂)来自Promega公司;流式检测试剂由重庆医科大学生命科学院检测中心提供。脂质体2 000来自Invitrogen公司,p53 siRNA与NC RNA由上海吉玛公司设计合成,PCR引物由上海生工合成,反转录试剂盒(含gDNA Eraser)来自TaKaRa公司。WB一抗:p53鼠单抗(DO-1): sc-126(Santa Cruz),PDGFR-β兔多抗(ImmunoWay),TopBP1兔多抗(Bioworld),cdk1、p21、bax、hsp90AA1等兔多抗来自上海生工公司。
1.2 细胞培养MDA-MB-231细胞用含有10%胎牛血清+1%青霉素链霉素的DMEM培养液在37 ℃、5% CO2条件下培养箱中常规培养。
1.3 MTS实验以4×103/孔将对数期细胞接种于96孔板中,加入PDGF-DD(20 ng/mL)或相应体积ddH2O,培养48 h后再分别加入Dox 0.01、0.1、1、10、50 μmol/L,同时设 置空白组,每组设置3个复孔,继续培养48 h 后按20 μL/孔 避光加入MTS溶液,继续孵育2 h,酶联免疫检测仪在490 nm波长处测定各孔光吸收值[D(490)]。计算各个给药组的细胞存活率。细胞存活率=[实验组 D(490)值-空白组D(490)值]/[对照组D(490)值- 空白组D(490)值]×100%。以Dox浓度对数值为横坐标,细胞存活率为纵坐标绘制曲线。
1.4 流式检测细胞周期和凋亡按照5×105/孔接种6孔板,加入PDGF-DD(20 ng/mL),培养24 h后加入Dox(0.2 μmol/L),并设立溶剂对照组,孵育24 h后胰酶消化,充分吹散后1 000×g离心5 min,PBS洗涤2次,弃上清,一边振荡一边加入1 mL于-20 ℃预冷的75%乙醇,4 ℃固定 24 h,PBS再次洗涤2次后离去上清,加入碘化吡啶(PI)和RNaseA至终浓度50 μg/mL,37 ℃ 避光30 min后用流式细胞仪测定细胞周期。在加入Dox(0.2 μmol/L)48 h后胰酶消化、轻微吹打、低速离心收集细胞,PBS洗涤3次后离去上清,依照Annexin-V-FITC 试剂盒说明书用流式细胞仪检测细胞凋亡比例。
1.5 RNA干扰MDA-MB-231细胞以40%比例接种6孔板,贴壁后,将阴性对照RNA(NC)和p53 siRNA按照脂质体2 000 说明书进行转染,4 h后换液,继续培养48 h,提取总蛋白或总RNA进行Western blot或qRT-PCR检测p53表达水平。
| RNA名称 | RNA序列 |
| p53 siRNA 1 | 正义链:5′-CUACUUCCUGAAAACAACG-3′ |
| 反义链:5′-CGUUGUUUUCAGGAAGUAG-3′ | |
| p53 siRNA 2 | 正义链:5′-UGGUUCACUGAAGACCCAG-3′ |
| 反义链:5′-CUGGGUCUUCAGUGAACCA-3′ | |
| p53 siRNA 3 | 正义链:5′-CUACUUCCUGAAAACAACG-3′ |
| 反义链:5′-GUAGAUUACCACUGCAGUC-3′ | |
| 阴性对照RNA | 正义链:5′-UUCUCCGAACGUGUCACGU-3′ |
| 反义链:5′-ACGUGACACGUUCGGAGAA-3′ |
1.6 RNA提取和荧光qPCR
终止培养后,PBS洗涤细胞3次弃上清,采用TRIzol(Invitrogen)法提取细胞总RNA,去DNA后反转录为cDNA。荧光qPCR检测各指标mRNA表达水平; qPCR实验均采用Bio-Rad荧光定量PCR仪(USA)进行信号采集,数据以2-△△Ct法计算对mRNA相对表达量。
| 引物名称 | 引物序列 | 扩增长度 |
| p53 | 上游:5′-GGCGCACAGAGGAAGAGAAT-3′ | 156 bp |
| 下游:5′-CACGGATCTGAAGGGTGAAA-3′ | ||
| p21 | 上游:5′-TTAGCAGCGGAACAAGGAGT-3′ | 116 bp |
| 下游:5′-CGTTAGTGCCAGGAAAGACA-3′ | ||
| cdk1 | 上游:5′-TAGCGCGGATCTACCATACC-3′ | 128 bp |
| 下游:5′-CATGGCTACCACTTGACCTG-3′ | ||
| PDGFR-β | 上游:5′-TGGCCCTCAAAGGCGAGC-3′ | 142 bp |
| 下游:5′-GAACCCGAGCAGGTCAGAAC-3′ | ||
| TOPBP1 | 上游:5′-TCGTACTCTTTCAGATGTCAGCA-3′ | 180 bp |
| 下游:5′-CCGCAAAGATATATCCGACAACC-3′ | ||
| bax | 上游:5′-CCGATTCATCTACCCTGCTG-3′ | 111 bp |
| 下游:5′-TGAGCAATTCCAGAGGCAGT-3′ | ||
| hsp90 | 上游:5′-GCCCAGAGTGCTGAATACCC-3′ | 100 bp |
| 下游:5′-TAACAGGTGCCCTGCTTCTC-3′ | ||
| snail | 上游:5′-TTTACCTTCCAGCAGCCCTA-3′ | 108 bp |
| 下游:5′-GACAGAGTCCCAGATGAGCA-3′ | ||
| FOXC2 | 上游:5′-AGTTCATCATGGACCGCTTC-3′ | 231 bp |
| 下游:5′-TCTCCTTGGACACGTCCTTC-3′ | ||
| twist | 上游:5′-GTCCGCAGTCTTACGAGGAG-3′ | 159 bp |
| 下游:5′-CCAGCTTGAGGGTCTGAATC-3′ | ||
| oct4 | 上游:5′-CCCCTGGTGCCGTGAA-3′ | 97 bp |
| 下游:5′-GCAAATTGCTCGAGTTCTTTCTG-3′ | ||
| nanog | 上游:5′-ATTCAGGACAGCCCTGATTCTTC-3′ | 76 bp |
| 下游:5′-TTTTTGCGACACTCTTCTCTGC-3′ | ||
| β-actin | 上游:5′-AGCGAGCATCCCCCAAAGTT-3′ | 285 bp |
| 下游:5′-GGGCACGAAGGCTCATCATT-3′ |
1.7 蛋白质印迹法(Western blot)
将细胞接种于培养皿中,给药或转染48 h后终止培养,PBS洗涤3次,弃上清,加入适量裂解液(RIPA ∶PMSF=100 ∶1),冰上摇30 min,刮匙快速刮取细胞裂解液,将其转入EP管中,4 ℃ 12 000×g离心20 min,取上清冰上备用;利用BCA试剂盒(碧云天)测定总蛋白浓度;向蛋白样品中加入5×蛋白上样缓冲液置沸水中变性5~10 min;根据待测蛋白相对分子质量配置相应浓度SDS-PAGE胶,电泳分离蛋白,湿转法转至PVDF膜,5%脱脂牛奶或5%牛血清蛋白封闭2~3 h,孵一抗p53鼠单抗(1 ∶500稀释),cdk1、PDGFR-β、p21、bax、hsp90和TopBP1等兔多抗(1 ∶700稀释),β-actin 鼠单抗(1 ∶1 000稀释),4 ℃摇床过夜;1×TBST洗膜10 min×3次,加入二抗(山羊抗兔和抗鼠抗体均按1 ∶1 000稀释)室温孵育1.5 h,TBST洗膜10 min×3次,用ECLTM化学发光法系统采集图像,Image J软件测量条带灰度值。
1.8 统计学分析应用SPSS 20.0进行统计分析,计量资料数据以 x±s 表示,两组间均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析,检验水准α=0.05,双侧检验。
2 结果 2.1 PDGF-DD/PDGFR-β诱导MDA-MB-231细胞发生阿霉素耐药PDGF-DD(PDGFR-β特异性配体)20 ng/mL或相应体积ddH2O处理MDA-MB-231细胞48 h后加入不同浓度阿霉素(Dox)继续作用48 h,MTS结果显示,Dox+PDGF-DD组与Dox+ddH2O组相比细胞存活率均显著升高(P<0.05,图 1A);Dox(0.2 μmol/L)、PDGF-DD(20 ng/mL)处理后,细胞G2期比例分别为:对照组(8.96±1.80)%、Dox+ddH2O组(47.99±0.08)%、Dox+PDGF-DD组(43.04±0.09)%,Dox+PDGF-DD组与Dox+ddH2O组相比G2期比例下降差异具有统计学意义(P<0.01);Dox(0.2 μmol/L)处理48 h后,Dox+PDGF-DD组凋亡比例(10.44±0.49)%与Dox+ddH2O(17.02±0.86)%相比差异具有统计学意义(P<0.01,图 1B、C)。表明PDGF-DD/PDGFR-β能明显降低MDA-MB-231细胞对Dox的敏感性、介导耐药发生。
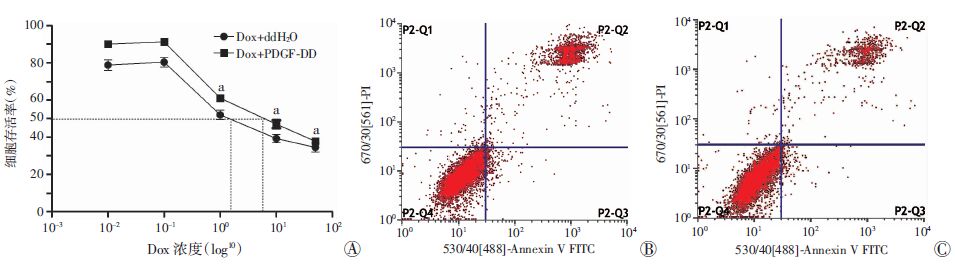
|
| A:MDA-MB-231细胞存活率定量分析 a: P<0.05,与Dox+ddH2O组比较;B、C:流式细胞仪检测细胞凋亡;B:Dox+ddH2O组,C:Dox+PDGF-DD组 图 1 PDGF-DD对MDA-MB-231细胞阿霉素(Dox)耐药的影响 |
2.2 PDGFR-β信号稳定并促进突变型p53(mtp53)功能
PDGF-DD处理MDA-MB-231细胞后行Western blot和qPCR检测(图 2A、B),结果显示,PDGF-DD组与对照组相比NF-Y靶基因PDGFR-β、cdk1 mRNA和蛋白水平显著上升,p63/p73靶基因p21、bax表达明显下降(P<0.05)。表明PDGF-DD/PDGFR-β可明显促进mtp53的致癌作用,形成PDGFR-β-mtp53-PDGFR-β正反馈环路;PDGF-DD处理后mtp53蛋白水平显著升高(P<0.05,图 2A),而其mRNA变化差异无统计学意义(P>0.05,图 2B),提示PDGF-DD可能从转录后水平促进mtp53功能。有报道热休克蛋白90(hsp90)能减少突变型p53蛋白降解[5]。拓扑异构酶(DNA)Ⅱ结合蛋白1(TopBP1)可促进突变型p53功能[6]。本实验数据显示,PDGF-DD能显著上调二者的蛋白水平和mRNA水平(P<0.05,图 2A~D)。予DMSO溶解的Wortmannin(PI3K抑制剂)2 μmol/L处理后,PDGF-DD+Wortmannin组与其对照组(PDGF- DD+DMSO组)相比hsp90和TopBP1 mRNA和蛋白水平都出现明显降低(P<0.05,图 2C、D)。表明PDGFR-β活化后通过PI3K信号转录水平上调hsp90和TopBP1表达可能是其促进突变型p53功能的机制之一。

|
| A:Western blot检测蛋白水平 1:对照组;2~4:分别为PDGF-DD 10、20、50 ng/mL组;B:qPCR检测mRNA相对表达量 a: P<0.05,与ddH2O组比较;C:Western blot检测TopBP1、hsp90表达 1:对照组;2:DMSO组;3:Wortmannin组;4:PDGF-DD组;5:PDGF-DD+DMSO组;6:PDGF-DD+Wortmannin组;D:qPCR检测TopBP1、hsp90 mRNA相对表达量 a:P<0.05,与ddH2O组比较,b:P<0.05,与PDGF-DD+DMSO组比较 图 2 PDGFR-β信号对突变型p53(mtp53)功能的影响 |
2.3 PDGFR-β信号通过突变型p53(mtp53)促进EMT和干性相关基因表达
为验证突变型p53、PDGF-DD与耐药相关基因(如EMT相关基因、干性相关基因)的关系,我们设计并合成了3条p53 siRNA,用脂质体2 000转染后行Western blot检测,结果显示:siRNA1干扰效率最佳,其蛋白干扰率为60%左右(图 3A),mRNA干扰率为(77.67±15.37)%。
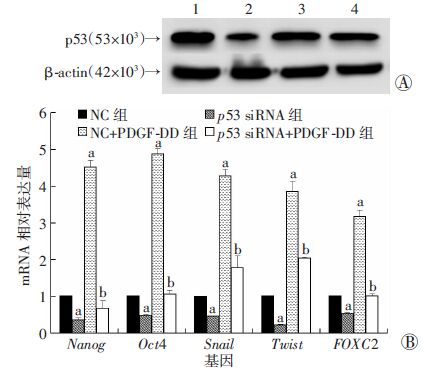
|
| A:Western blot筛选p53 siRNA 1:阴性对照RNA;2:p53 siRNA1;3:p53 siRNA2;4:p53 siRNA3;B:qPCR检测耐药相关基因mRNA水平 a:P<0.05,与NC组比较,b:P<0.05,与NC+PDGF-DD组比较 图 3 突变型p53在PDGF-DD上调耐药相关基因中的作用 |
NC+PDGF-DD组相对于NC组EMT相关基因 (FOXC2、twist、snail)、干性相关基因(nanog、oct4)mRNA 水平明显升高(P<0.05,图 3B),p53 siRNA组相对于NC组、p53 siRNA+PDGF-DD组相对于NC+PDGF-DD组各基因mRNA水平显著下降(P<0.05,图 3B)。表明PDGFR-β信号主要通过突变型p53转录水平上调EMT和干性相关基因表达。
3 讨论PDGFR-β为酪氨酸酶受体,广泛调控细胞增殖、凋亡、迁移、侵袭与转移、血管生成等过程,在正常人乳腺组织几乎不能检测,但在乳腺癌细胞和基质细胞中常过度表达,与原发性乳腺癌侵袭性表型及显著缩短的无复发生存率相关[7],可以被PDGF-BB或-DD特异性激活(-DD与-BB相比作用尚不明确),与PDGFR-α功能不尽相同。有报道称,非特异性酪氨酸酶抑制剂伊马替尼控制PDGFR-β而不是PDGFR-α病例进展失败[8],结合PDGFR-β在放疗存活的肺癌细胞中上 调[3],因此有必要深入探索其在耐药中的作用与机制。
阿霉素通过直接嵌入DNA碱基之间引发拓扑异构酶Ⅱ介导DNA三级结构破坏、诱导细胞继发性凋亡来发挥其抗癌作用。本实验MTS结果表明:PDGFR-β活化后能明显提高MDA-MB-231在阿霉素条件下细胞存活率及阿霉素IC50值,诱导耐药发生。细胞周期与凋亡检测结果证实PDGF-DD显著降低阿霉素所致的细胞凋亡,一定程度改善细胞G2/M阻滞。qPCR数据显示PDGF-DD显著提高耐药相关基因如干性相关基因、EMT相关基因、ABC转运体家族成员表达。由此可以看出,PDGFR-β介导耐药的机制涉及增强DNA损伤后修复、增强药物外流、抑制凋亡、上调耐药相关基因表达等多个方面。
相对于野生型p53,超过70%的p53突变体属于错义突变,大多发在p53 DNA结合区内,破坏其特异性DNA结合活性。突变体p53获得新功能后促进癌细胞增殖、转移、基因组不稳定性和放化疗耐药。以下是p53突变体获能的几种潜在机制:①与NF-Y转录因子相互结合、上调许多细胞周期相关基因如cyclin A、cyclin B、cdk1C、cdc25C;②与p63/p73形成复合物并阻断其DNA结合活性,下调许多凋亡基因如p21、bax。无论哪种机制其关键是p53突变体在细胞中高度累积,但p53突变体并不能独自保持自身稳定[9],需要在恶性转化过程中获得一些其他改变的积累才能拥有长半衰期。
PDGFR-β也是NF-Y靶基因之一[10]。本实验qPCR和WB数据表明PDGF-DD能显著调节p53突变体下游基因cdk1、PDGFR-β、p21、bax表达,明显提高p53突变体蛋白水平,但其mRNA变化差异无统计学意义,提示PDGFR-β信号可能是通过转录后调节方式来促进p53突变体的功能。hsp90能失活MDM2和CHIP的E3泛素酶活性从而稳定p53突变体[5]。TopBP1作为一个支架蛋白分布于细胞核参与DNA损伤反应和DNA复制起始的功能为大家所熟悉,但其异位到细胞质、在肿瘤组织中高表达并与高肿瘤分级、短预后相关[11]的机制却知之较少。有报道TopBP1能够与p53热点突变体结合并促进其对NF-Y和p63/p73靶基因的调控[6]。本实验中PDGF-DD显著上调hsp90和TopBP1 mRNA和蛋白水平,PI3K/Akt抑制剂处理后表达明显下降,表明通过PI3K信号途径上调hsp90和TopBP1表达是PDGFR-β信号促进p53突变体致癌的机制之一。Akt失活糖原合成酶激酶3-β(GSK3-β)、激活热休克转录因子1(HSF1)可能是PI3K信号上调hsp90表达的机制之一[12],而PI3K调节TopBP1的详细机制有待进一步探索。
低紧密连接蛋白乳腺肿瘤占TNBC 25%~39%,与高表达的EMT相关基因密切相关[13]。EMT相关基因如FOXC2能诱导干性相关基因上调、增加干细胞数目[13]。本实验运用siRNA技术证明p53突变在PDGF-DD上调EMT和干性相关基因表达中发挥了重要作用。文献[14-16]证明EMT相关基因FOXC2、snail、twist受转录因子NF-κB调控。p53突变能增强NF-κB活化强度及持续时间[17]。在肿瘤组织中p53突变体表达水平与NF-κB活性正相关[18]。因此我们推测NF-κB可能是p53突变体上调EMT及干性相关基因表达的方式之一。
综上所述,PDGF-DD/PDGFR-β能诱导MDA-MB-231细胞发生阿霉素耐药,通过PI3K途径转录水平上调hsp90和TopBP1表达、稳定并促进p53突变体介导细胞耐药是其重要机制之一。因此,PDGFR-β有可能成为耐阿霉素三阴性乳腺癌的治疗靶点之一,尤其是含p53突变的肿瘤。本研究为优化乳腺癌化疗方案提供了一定的实验依据。
| [1] | Ablett M P, Singh J K, Clarke R B. Stem cells in breast tumours: are they ready for the clinic?[J]. Eur J Cancer,2012, 48 (14) : 2104 –2116. DOI:10.1016/j.ejca.2012.03.019 |
| [2] | Shintani Y, Okimura A, Sato K, et al. Epithelial to mesenchymal transition is a determinant of sensitivity to chemoradiotherapy in non-small cell lung cancer[J]. Ann Thorac Surg,2011, 92 (5) : 1794 –1804. DOI:10.1016/j.athoracsur.2011.07.032 |
| [3] | Gomez-Casal R, Bhattacharya C, Ganesh N, et al. Non-small cell lung cancer cells survived ionizing radiation treatment display cancer stem cell and epithelial-mesenchymal transition phenotypes[J]. Mol Cancer,2013, 12 (1) : 94 . DOI:10.1186/1476-4598-12-94 |
| [4] | Shetzer Y, Solomon H, Koifman G, et al. The paradigm of mutant p53-expressing cancer stem cells and drug resistance[J]. Carcinogenesis,2014, 35 (6) : 1196 –1208. DOI:10.1093/carcin/bgu073 |
| [5] | Li D, Marchenko N D, Schulz R, et al. Functional inactivation of endogenous MDM2 and CHIP by HSP90 causes aberrant stabilization of mutant p53 in human cancer cells[J]. Mol Cancer Res,2011, 9 (5) : 577 –588. DOI:10.1158/1541-7786.MCR-10-0534 |
| [6] | Liu K, Ling S, Lin W C. TopBP1 mediates mutant p53 gain of function through NF-Y and p63/p73[J]. Mol Cell Biol,2011, 31 (22) : 4464 –4481. DOI:10.1128/MCB.05574-11 |
| [7] | Coltrera M D, Wang J, Porter P L, et al. Expression of platelet-derived growth factor B-chain and the platelet-derived growth factor receptor beta subunit in human breast tissue and breast carcinoma[J]. Cancer Res,1995, 55 (12) : 2703 –2708. |
| [8] | Watanabe K, Otsu S, Morinaga R, et al. CD34-negative solitary fibrous tumour resistant to imatinib[J]. BMJ Case Rep,2013, 2013 . DOI:10.1136/bcr-2013-200126 |
| [9] | Lang G A, Iwakuma T, Suh Y A, et al. Gain of function of a p53 hot spot mutation in a mouse model of Li-Fraumeni syndrome[J]. Cell,2004, 119 (6) : 861 –872. |
| [10] | Weissmueller S, Manchado E, Saborowski M, et al. Mutant p53 drives pancreatic cancer metastasis through cell-autonomous PDGF receptor β signaling[J]. Cell,2014, 157 (2) : 382 –394. DOI:10.1016/j.cell.2014.01.066 |
| [11] | Liu K, Bellam N, Lin H Y, et al. Regulation of p53 by TopBP1: a potential mechanism for p53 inactivation in cancer[J]. Mol Cell Biol,2009, 29 (10) : 2673 –2693. DOI:10.1128/MCB.01140-08 |
| [12] | Takahashi R U, Takeshita F, Honma K, et al. Ribophorin Ⅱ regulates breast tumor initiation and metastasis through the functional suppression of GSK3β[J]. Sci Rep,2013, 3 : 2474 . DOI:10.1038/srep02474 |
| [13] | Hollier B G, Tinnirello A A, Werden S J, et al. FOXC2 expression links epithelial-mesenchymal transition and stem cell properties in breast cancer[J]. Cancer Res,2013, 73 (6) : 1981 –1992. DOI:10.1158/0008-5472.CAN-12-2962 |
| [14] | Yu Y H, Chen H A, Chen P S, et al. MiR-520h-mediated FOXC2 regulation is critical for inhibition of lung cancer progression by resveratrol[J]. Oncogene,2013, 32 (4) : 431 –443. DOI:10.1038/onc.2012.74 |
| [15] | Cichon M A, Radisky D C. ROS-induced epithelial-mesenchymal transition in mammary epithelial cells is mediated by NF-kB-dependent activation of Snail[J]. Oncotarget,2014, 5 (9) : 2827 –2838. |
| [16] | Tsubaki M, Komai M, Fujimoto S, et al. Activation of NF-κB by the RANKL/RANK system up-regulates snail and twist expressions and induces epithelial-to-mesenchymal transition in mammary tumor cell lines[J]. J Exp Clin Cancer Res,2013, 32 : 62 . DOI:10.1186/1756-9966-32-62 |
| [17] | Schneider G, Henrich A, Greiner G, et al. Cross talk between stimulated NF-kappaB and the tumor suppressor p53[J]. Oncogene,2010, 29 (19) : 2795 –2806. DOI:10.1038/onc.2010.46 |
| [18] | Weisz L, Damalas A, Liontos M, et al. Mutant p53 enhances nuclear factor kappaB activation by tumor necrosis factor alpha in cancer cells[J]. Cancer Res,2007, 67 (6) : 2396 –2401. |



