内源性一氧化氮(nitric oxide,NO)作为一种血管内皮舒张性因子[1-2],对血管生成[3-6]以及空间学习和记忆能力[7-9]有着至关重要的作用。内源性NO在机体内是由左旋精氨酸和氧分子在一氧化氮合酶(nitric oxide synthase,NOS)的催化下生成的。内源性NO在体内的半衰期仅有3 ~ 5 s,因此其在体内的含量极大程度受到NOS的限制。Nω硝基左旋精氨酸甲酯(Nω-nitro-L-arginine methyl ester,L-NAME)是左旋精氨酸的衍生物,其结构与左旋精氨酸相似,能够竞争性的阻断NOS,从而抑制机体NO的产生[10-11]。研究发现,持续7 d利用L-NAME阻断正常大鼠大脑内的NOS,能够有效地抑制内源性NO对空间学习和记忆能力的积极作用[12]。NOS目前已知分为内皮结构型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS),神经核结构型一氧化氮合成酶(nucleus nitric oxide synthase,nNOS)和诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)[13],nNOS主要分布在神经元而eNOS主要分布在血管内皮细胞[14]。
在大脑结构中,海马作为大脑边缘系统的一部分,在空间学习和记忆过程中起着重要的作用。空间学习和记忆功能的实现,需要大脑各功能区相互协作,其中海马的CA1区作为一个多条传输轴的连接中心区域[15]显得尤为重要。海马局部缺血的患者存在记忆缺失症状[16-18]。L-NAME是通过作用于何种类型的NOS来对空间和学习记忆能力造成影响的呢?de-la-Torre等[19]在慢性低灌注模型大鼠(该模型通常用来研究NOS在空间记忆方面的作用)体内同时分别阻断3种NOS,仅有阻断eNOS的大鼠表现出空间记忆下降。而有研究表明eNOS对体内新生血管的生成是必需的[20]。Kerr等[21]发现分别阻断新生血管的形成和新生神经元形成后,仅有前者表现出空间学习和记忆能力下降,提示新生血管形成在空间学习和记忆中的重要作用。可见,L-NAME很有可能是通过作用于eNOS影响血管的形成,进而影响空间和学习记忆能力。那么,L-NAME是否通过阻断大鼠海马CA1区内NOS,对海马CA1区内的毛细血管造成影响呢?
因此,本实验在大鼠注射L-NAME后,用Morris水迷宫检测大鼠的空间学习、记忆能力,用无偏体视学方法[22]定量检测海马CA1区毛细血管各参数,以期探讨L-NAME对大鼠海马CA1区毛细血管和空间学习、记忆能力的影响。
1 材料与方法 1.1 实验动物健康清洁级雄性Sprague-Dawley(SD)大鼠,体质量200~250 g,所有动物由重庆医科大学实验动物中心提供。置于室温为(24±2)℃,通风良好的饲养室,自由饮食和饮水,自由活动,昼夜节律为12 h/12 h(上午8:00 开灯,晚上20:00 熄灯)。采用完全随机方法将动物分为2 组:对照组(Sham组)和阻断剂组(L-NAME组),每组10只。
1.2 侧脑室插管和给药为了保证药物到达海马CA1区,我们采用侧脑室给药:2%戊巴比妥(0.3 mL/100 g,腹腔注射)麻醉后,参照Paxinos-Watson图谱[23]将内导管埋植于侧脑室内[24]。术后3 d,每天给予1次青霉素(10万U)腹腔注射。给药:将动物单笼饲养,适应性喂养1周后,用微量注射器缓慢给药,Sham组给予5 μL生理盐水(0.9% NaCl溶液),L-NAME组给予NO阻断剂1 μmol/μL L-NAME(N-5751,Sigma,美国)5 μL[24],给药后均将微量注射器留针5 min,每日1次,持续4周。
1.3 Morris水迷宫空间记忆能力检测4周后,用Morris水迷宫检测各组实验大鼠空间学习和记忆能力[25]。实验所用圆形水池,直径为150 cm,高70 cm。实验人员用4个入水点将水池平均分为4个象限,站台随机放入一个象限内,实验期间保持不动。池内水用墨汁染成黑色,水池中水温保持(22±1)℃,水池四周放有固定不动的空间标记物。实验共持续7 d,第1天为可视站台实验,为评价动物的身体状况、积极性、动物的运动协调能力,排除药物及干预对其的影响。可视站台实验中站台露出水面约1.5 cm,实验前先将大鼠置于站台上适应15 s,随后将大鼠分别从远离站台的2个入水点(N和W)面壁置入池内,通过系统记录大鼠在180 s内找到站台所用时间。如果大鼠在180 s仍未找到站台,则由实验者将其牵引到站台上,并记录时间为180 s。无论大鼠是否找到站台,训练后都要在站台上停留约15 s,再放回笼中。第2 ~ 6天进行定位航行实验:水面高出站台1.5 cm,将大鼠分别随机地从4个入水点面壁置入池内,训练方式与可视站台实验相同。记录每天的逃避潜伏期时间,即找到站台的所用时间,作为评价大鼠空间学习能力的指标。水迷宫实验的第7天为空间探索实验,撤去水下站台,让大鼠在水池内搜索站台180 s,观察并记录下大鼠在原平台所在的象限停留时间及穿越原站台所在区域的次数(即穿台次数),作为评价大鼠空间记忆能力指标。
1.4 NOS活性及NO含量检测所用器械及辅助用品均经过高温高压消毒处理。随机从每组中抽取5只动物,经2% 戊巴比妥(0.3 mL/100 g,腹腔注射)麻醉后,取出海马组织,准确称取待测海马组织的质量,按质量体积比加生理盐水(1 ∶9),制备成10%的组织匀浆液,然后2 500 r/min 低温离心10 min,取上清液15 μL用于测定蛋白含量,50 μL检测NOS活性,50 μL检测NO含量。
海马组织蛋白质含量采用BCA蛋白定量试剂盒(江苏碧云天生物技术研究所,中国)测定。按照说明在96孔板中加入标准蛋白、标准蛋白稀释液(生理盐水)、样品(加入3孔求平均值)以及BCA工作液。然后用全波长酶标仪(赛默飞世尔科技,芬兰)在562 nm波长处测定光密度值[D(562)]。制作标准曲线算出样本蛋白含量备用。
1.5 海马组织NOs活性检测应用NOS检测试剂盒(南京建成生物工程研究所,中国)来检测。用紫外光栅分光光度计(上海第三分析仪器厂)检测各管光密度值[D(530)],利用公式(1)计算NOS活性。
| $\begin{align} & 总NOS活性\left( U/mg \right)=\left[ 总NOSD\left( 530 \right)-空白D\left( 530 \right) \right] \\ & /呈色物质纳摩尔消光系数\times 反应物总体积\left( mL \right)/取样量\left( mL \right)/\left[ 比色光径\left( cm \right)\times 反应时间\left( \min \right) \right] \\ & /待测样本蛋白溶度\left( mg/L \right) \\ \end{align}$ | (1) |
应用NO 试剂盒(南京建成生物工程研究所,中国)来检测。用全波长酶标仪在550 nm处测定光密度值[D(550)]。空白管和标准管的D(550)值分别用双蒸水和标准样品(20 μmol/L)测定。依据公式计算出海马组织NO 含量。
| $\begin{align} & NO含量\left( \mu mol/g \right)=\left[ 测定D\left( 550 \right)-空白D\left( 550 \right) \right] \\ & /\left[ 标准D\left( 550 \right)-空白D\left( 550 \right) \right]\times 标准品溶度\left( 20\mu mol/L \right) \\ & /待测样本蛋白溶度\left( g/L \right) \\ \end{align}$ | (2) |
用2% 戊巴比妥(0.3 mL/100 g,腹腔注射)对大鼠进行麻醉后,打开大鼠胸腔使心脏暴露,左心室心尖处插入灌注用针头,剪开右心耳,打开灌注泵(DHL-3型)开始灌注。先用100 mL加有肝素的生理盐水以20 mL/min的速度灌注,再用200 mL 4%多聚甲醛固定液以18 mL/min的速度灌注,全身僵硬、肝脏泛白后停止灌注。去除颅骨剥离出完整大脑组织,每只大鼠随机抽取一侧大脑半球,用琼脂包埋固定于模具后,以冠状方向切取1 mm厚的连续脑组织切片,每侧大脑半球平均切取16~20片,其中出现海马的6~8片。解剖显微镜10倍下将每张1 mm厚脑组织切片的枕面朝上放置,并将图像采集保存后,OCT包埋,从每张脑片额面方向切取10 μm厚冰冻切片,贴片后放入-20 ℃ 保存备用。每只大鼠所抽取的一侧大脑中随机抽取5片含有海马的等距切片,枕面覆盖随机测试点,在CA1区内被随机测试点击中处取1 mm3大小的组织块,每只大鼠CA1区均获得5块组织块。利用Isctor法[26]将组织块包埋成直径为5 mm的小球,将所有包埋好的组织块使用“定向法” [27],获得各向同性切面,沿各向同性切面方向切取4 μm厚的冰冻切片,即各向同性切片。每个组织块做6张各向同性切片,这样每只动物获得30张各向同性切片,置于-20 ℃保存备用。
1.8 免疫组织化学染色冰冻切片经4 ℃丙酮固定后,用pH为6.0的枸橼酸盐缓冲液进行水浴加热抗原修复,3%H2O2去离子水溶液灭活内源性过氧化物酶,正常山羊血清工作液封闭,孵育小鼠抗大鼠CD31抗体(ab64543,Abcam,美国)后,孵育滴加生物素标记的山羊抗小鼠IgG,SP工作液。经DAB显色,Mayor’s 苏木精复染后,所有切片用酒精梯度脱水、二甲苯透明,中性树胶封片[28]。于100倍油镜下摄片,每张切片按40%抽样分数随机抽样,每张切片拍得15~20张照片(视野之间变异系数CV=0.14)。每只动物拍得CA1区毛细血管的照片约700张。在得到的照片上,将标记的所有血管中直径≤10 μm的定义为毛细血管。
1.9 体视学分析 1.9.1 海马体积、CA1区体积和CA1区毛细血管参数的计算 1.9.1.1 体积计算用图像处理软件(Photoshop)在解剖显微镜下采集的图像上随机叠放透明的等距测试点,每一测点所对应的面积ap为0.168 mm2,记录击中海马的测试点的个数(图 1A),每只动物击中海马的总测点数为ΣPHF。利用卡瓦列里原理计算海马的总体积VHF [22, 27-31],t为切片厚度(1 mm):
| ${{V}_{HF}}=\left( t\times {{a}_{p}}\times \sum{{{P}_{HF}}} \right)\times 2$ | (3) |
CA1区的体积VCA1计算:10 μm厚冰冻切片,经0.01 mol/L PBS (pH7.2 ~ 7.4)浸洗5 min×3次后,滴加Mayor’s苏木精,将细胞核染成紫色后,蒸馏水终止染色并清洗10 min,再用饱和磷酸氢二钠返蓝4 min,酒精梯度脱水,二甲苯透明后,中性树脂封片。在显微镜下根据图谱进行分区,根据细胞带的特点在海马中区分出CA1区(绿色线标记),随机叠放透明的等距测点(图 1B),每只动物击中CA1区的总测点数为ΣPCA1,根据下列公式(4)[22, 27-31]计算CA1区的体积VCA1。
| ${{V}_{CA1}}=\left( t\times {{a}_{p}}\times \sum{{{P}_{CA1}}} \right)\times 2$ | (4) |

|
| 图 1 海马体积(A)和CA1区体积(B)计数方法 |
1.9.1.2 CA1区毛细血管的长度密度与总长度
在体视学系统随机抽取所得到的图片上随机叠加无偏计数框(面积为1.16×103 μm2),计数CA1区毛细血管断面数ΣQCA1(cap)(图 2A),则CA1区内毛细血管的长度密度LV(cap/CA1) 按下面公式(5)[22, 27-31]计算:

|
| A: 在体视学系统随机抽取所得到的图片上叠加无偏计数框,计数完全处于计数框内和(或)与计数线(虚线)相交的毛细血管断面数(箭头所指);B: 所得到的图片上随机叠加等距测试点,分别计数落在CA1区和毛细血管断面上的测试点(箭头所指);C:所得到的图片上随机叠加测试线,计数测试线与毛细血管断面的交点数(箭头所指) 图 2 大鼠海马CA1区毛细血管体视学计数方法 (S-P) |
| ${{L}_{V}}\left( cap/CA1 \right)=2\times \sum{{{Q}_{CA1}}}\left( cap \right)/\sum{A}$ | (5) |
式中ΣA为所使用的无偏计数框的总面积。
根据前述每只动物CA1区总体积VCA1,那么CA1区毛细血管总长度L(cap/CA1),则根据下面的公式(6)[22, 27-31]求得:
| $L\left( cap/CA1 \right)={{L}_{V}}\left( cap/CA1 \right)\times {{V}_{CA1}}$ | (6) |
在所得到的照片上随机叠加测试线(长度为6.05 μm),计数测试线与毛细血管交叉点数(图 2B),得到每只大鼠测试线与毛细血管总交叉点数为ΣICA1(cap),则CA1区内毛细血管的表面积密度SV(cap/CA1) 的计算公式(7)[22, 27-31]为:
| ${{S}_{V}}\left( cap/CA1 \right)=2\times \sum{{{I}_{A1}}}\left( cap \right)/\sum{L}$ | (7) |
式中ΣL为CA1区内使用的测试线的总长度。
CA1区毛细血管总表面积 SCA1(cap/CA1) 根据下面的公式(8)[22, 27-31]求得:
| $S\left( cap/CA1 \right)={{S}_{V}}\left( cap/CA1 \right)\times {{V}_{CA1}}$ | (8) |
在所得到的照片上随机叠加等距测点(每一测点所对应的面积为36.6 μm2),分别计数落在整个CA1区内及CA1区内毛细血管上的总测点数ΣPCA1和ΣP(cap)(图 2C)。根据下面的公式[22, 27-31]计算毛细血管的体积密度VV(cap/CA1):
| ${{V}_{V}}\left( cap/CA1 \right)=\sum{P}\left( cap \right)/\sum{{{P}_{CA1}}}$ | (9) |
CA1区毛细血管的总体积V(cap/CA1),则根据以下公式[22, 27-31]计算:
| $V\left( cap/CA1 \right)={{V}_{V}}\left( cap/CA1 \right)\times {{V}_{CA1}}$ | (10) |
所有数据以x ±s表示,结果采用SPSS 19.0 统计软件进行分析,用重复测量方差分析统计处理水迷宫定位航行实验数据;可视站台实验数据、空间探索实验数据和体视学分析数据经过正态性检验后,用student-t检验进行统计处理。
2 结果 2.1 Morris水迷宫结果第1天可视站台实验结果显示,L-NAME组和Sham组两组大鼠差异无统计学意义[潜伏期分别为(136.09±45.19)、(95.10±46.87)s,P>0.05]。第2~6天的定位航行实验中,Sham组和L-NAME组从第3开始出现统计学差异(P=0.03),即L-NAME组大鼠的逃避潜伏期显著长于Sham组大鼠,这种差异一直持续到第6天(P=0.003,图 3)。在第7天的空间探索实验中,L-NAME组穿越平台次数[(5.20±2.78)次]显著少于Sham组[(10.00±2.87)次,P=0.011],而两组大鼠在平台所在象限停留差异无统计学意义(P>0.05)。
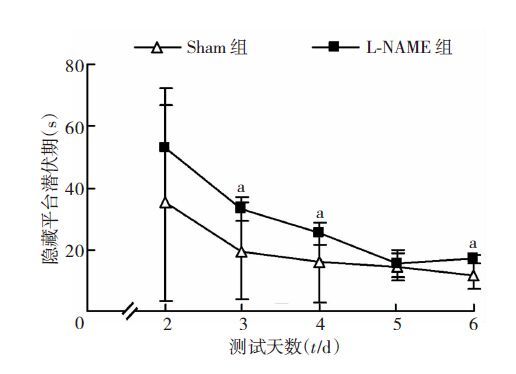
|
| a:P<0.05,与Sham组比较 图 3 两组大鼠Morris水迷宫空间学习记忆能力检测结果 |
2.2 NOS活性和NO含量结果
L-NAME组大鼠海马组织中NOS的活性[(96.12± 3.78)U/g]显著低于Sham组[(209.53±12.56)U/g,P<0.01],同时L-NAME组大鼠海马组织中的NO含量为(2.44±0.29) μmol/g,显著低于Sham组的海马组织中NO含量[(3.97±0.35) μmol/g,P<0.01]。
2.3 体视学方法分析 2.3.1 免疫组化染色与Sham组相比,L-NAME 组的毛细血管数量显著减少(图 4)。
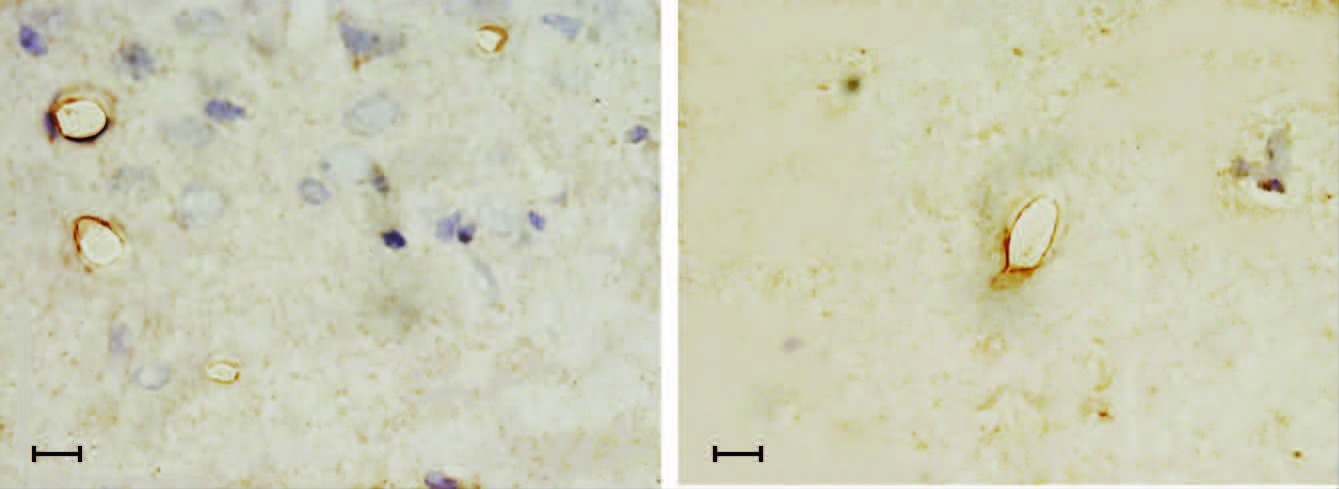
|
| 图 4 Sham组(A)和L-NAME组(B)大鼠海马组织免疫组化染色观察 (S-P) |
2.3.2 海马、CA1区总体积
Sham组和L-NAME 组的海马总体积未见统计学差异[分别为(84.57±10.75)、(89.61±9.05)mm3,P>0.05]。L-NAME 组CA1区总体积[(31.14±3.05)mm3]与Sham组的总体积[(29.87±2.56)mm3]差异无统计学意义(P>0.05)。同时CA1区体积占海马总体积的比重L-NAME组[(34.92±3.62)%]和Sham组[(35.68±4.38)%]之间差异也无统计学意义(P>0.05)。
2.4 CA1区毛细血管的体视学结果 2.4.1 CA1区毛细血管总长度L-NAME 组CA1区毛细血管长度密度(0.262±0.050)m/mm3显著少于Sham组[(0.398±0.068)m/mm3,P=0.007]。 L-NAME 组CA1区毛细血管总长度[(7.375±1.291)m] 比Sham组[(11.920±2.606)m]显著减少了38.17%(P=0.008)。
2.4.2 CA1区毛细血管总表面积L-NAME 组CA1区毛细血管表面积密度[(3.896±0.676)mm2/mm3]显著低于Sham组[(6.369±1.010)mm2/mm3,P=0.002]。L-NAME 组CA1区毛细血管总表面积[(110.703±24.967)mm2]比Sham组CA1区毛细血管总表面积[(189.821±30.733)mm2]显著减少了41.68%(P=0.003)。
2.4.3 CA1区毛细血管总体积L-NAME 组CA1区毛细血管体积密度[(3.900±0.712)×10-3]显著低于Sham组[(7.265±1.539)×10-3,P=0.002]。 L-NAME组CA1区毛细血管总体积(0.110±0.027)mm3 相对于Sham组CA1区的毛细血管总体积[(0.217±0.050)mm3]显著缩小了50%(P=0.002)。
3 讨论在机体内,化学性质活泼的NO由于拥有亲脂性,能够自由的穿梭细胞膜而不需要任何特殊的通道,所以它有着非常复杂的生物化学效应,在多条关键通路中扮演着重要的角色。但是它的半衰期极短,在体内很快转化为硝酸盐及亚硝酸盐。所以我们只能通过控制合成NO合成的酶来调节NO的生物效应。NOS在拥有四氢叶酸蝶呤和亚铁血红素的环境中,催化左旋精氨酸和O2合成NO。NOS主要分布于血管内皮细胞、神经元、血管平滑肌细胞、巨噬细胞、血小板以及多种炎症免疫细胞的胞质内[32-34]。L-NAME是一种左旋精氨酸衍生物,能与左旋精氨酸竞争性结合NOS的激活位点,作为一种NOS竞争性阻断剂,合适的剂量能有效地阻断体内3种NOS,从而使机体NO产生的含量下降。Wei等[35]每日给大鼠从侧脑室注射5 μmol L-NAME,持续7 d后大鼠海马和前额叶皮质内NO溶度显著下降。本实验结果也显示给予成年SD大鼠4周持续注射5 μL浓度为1 μmol/μL L-NAME进入侧脑室后,海马内NOS活性和NO含量显著下降。这提示本实验给予L-NAME的剂量能够有效地阻断海马内NOS,并降低了海马内NO的含量。
海马作为大脑边缘系统的一部分,在空间学习和记忆过程中起着重要的作用。内源性NO作为一种血管内皮舒张性因子[1-2],对空间学习和记忆能力也有着至关重要的作用[7-9]。海马内NO含量的降低将会对空间学习和记忆能力产生重要影响。本实验表明4周的L-NAME持续注射后,大鼠的空间学习和记忆能力显著降低。第1天的Morris水迷宫可见平台实验,表明L-NAME 组和Sham组的活动能力和积极性等并没有受到药物的影响。也就是说这两组动物在空间记忆训练之前并没有空间学习和记忆能力的差别。第2~6天的隐藏平台实验为检测动物接受空间标记的快慢程度,即一个学习和记忆的过程,它包含了获得信息和巩固信息的能力。我们的实验结果表明4周的L-NAME持续作用使得SD大鼠的空间学习和记忆能力降低,这与Wei等[35]的研究一致。 Boultadakis等[11]用辐射水迷宫来测试L-NAME对大鼠空间学习和记忆的影响,发现3 mg/kg腹腔注射对空间记忆有阻断作用。这些结果提示,L-NAME对空间记忆和学习记 忆有损害作用。我们采用的L-NAME浓度为1 μmol/L,剂量为5 μL,不仅观察到L-NAME对空间学习和记忆能力有损伤作用,还观察到L-NAME对海马内NOS活性和NO含量的负性作用。L-NAME作为一种NOS竞争性阻断剂,有效地阻断体内NOS,从而降低机体NO的含量。可见,L-NAME对空间记忆和学习记忆的作用与其对SD大鼠海马内NOS活性和NO含量的作用密切相关。
那么L-NAME引起的学习和记忆能力的下降是如何产生的?关于NO对学习和记忆影响的研究主要集中在中枢神经系统的结构和功能变化[12, 36]。有趣的是,de-la-Torre等[19]在慢性低灌注模型大鼠(该模型通常用来研究NOS在空间记忆方面的作用)体内分别阻断3种NOS,仅有阻断eNOS的大鼠表现出空间记忆下降。海马内分布有较多的eNOS和nNOS,其中eNOS主要存在于血管内皮细胞,nNOS主要分布于神经细胞[14]。血管尤其是毛细血管可能是NOS和NO影响空间记忆和学习记忆的重要结构基础[3-5, 7, 21]。并且有临床证据表明,海马局部缺血的患者存在记忆缺失的症状[16-18]。那么L-NAME对SD大鼠海马NOS活性和NO含量的影响是否会对海马内的毛细血管造成影响呢?海马CA1区在学习和记忆中有着关键作用,L-NAME是否通过影响大鼠海马CA1区毛细血管的形成来降低大鼠空间记忆的能力呢?本实验中,我们采用无偏体视学方法,对海马CA1区内毛细血管进行定量分析,结果显示在海马体积、海马CA1区总体积以及CA1区在海马体积中所占比重并没有发生变化的情况下,L-NAME组海马CA1区内毛细血管的长度密度,表面积密度和体积密度均较对照组显著性降低,提示持续4周的L-NAME侧脑室注射,导致毛细血管在海马CA1区的分布变得稀疏了。通过体视学无偏估算,结果显示L-NAME组海马CA1区毛细 血管的总长度,总表面积以及总体积分别较对照组减少了38.17%、41.68%和50%,进一步提示通过L-NAME 持续阻断海马内NOS后,海马CA1区毛细血管的数量显著性下降。可见,L-NAME在降低海马内NOS活性和NO含量同时还减少了海马CA1区毛细血管,而L-NAME 对海马CA1区毛细血管的影响可能是其对海马CA1区毛细血管内皮细胞上NOS阻断的结果。
综上所述,L-NAME能够阻断大鼠海马内NOS,降低NO含量,能够导致大鼠空间学习、记忆能力下降和大鼠海马CA1区毛细血管总长度、总表面积以及总体积的减少。我们将进一步研究L-NAME所致大鼠海马CA1区毛细血管总长度、总表面积以及总体积的减少与大鼠空间学习、记忆能力下降之间的关系。
| [1] | Palmer R M, Ferrige A G, Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor[J]. Nature,1987, 327 (6122) : 524 –526. |
| [2] | Furchgott R F, Zawadzki J V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine[J]. Nature,1980, 288 (5789) : 373 –376. |
| [3] | Papapetropoulos A, Garcia-Cardena G, Madri J A, et al. Nitric oxide production contributes to the angiogenic properties of vascular endothelial growth factor in human endothelial cell[J]. J Clin Invest,1997, 100 (12) : 3131 –3139. |
| [4] | Ziche M, Morbidelli L, Masini E, et al. Nitric oxide mediates angiogenesis in vivo and endothelial cell growth and migration in vitro promoted by substance P[J]. J Clin Invest,1994, 94 (5) : 2036 –2044. |
| [5] | Jiang T, Yu J T, Zhu X C, et al. Angiotensin-(1-7) induces cerebral ischaemic tolerance by promoting brain angiogenesis in a Mas/eNOS-dependent pathway[J]. Br J Pharmacol,2014, 171 (18) : 4222 –4232. DOI:10.1111/bph.12770 |
| [6] | Craige S M, Chen K, Pei Y, et al. NADPH oxidase 4 promotes endothelial angiogenesis through endothelial nitric oxide synthase activation[J]. Circulation,2011, 124 (6) : 731 –740. DOI:10.1161/CIRCULATIONAHA.111.030775 |
| [7] | Bohme G A, Bon C, Lemaire M, et al. Altered synaptic plasticity and memory formation in nitric oxide synthase inhibitor-treated rats[J]. Proc Natl Acad Sci U S A,1993, 90 (19) : 9191 –9194. |
| [8] | Harooni H E, Naghdi N, Sepehri H, et al. The role of hippocampal nitric oxide (NO) on learning and immediate, short- and long-term memory retrieval in inhibitory avoidance task in male adult rats[J]. Behav Brain Res,2009, 201 (1) : 166 –172. DOI:10.1016/j.bbr.2009.02.011 |
| [9] | Azizi-Malekabadi H, Hosseini M, Saffarzadeh F, et al. Chronic treatment with the nitric oxide synthase inhibitor, L-NAME, attenuates estradiol-mediated improvement of learning and memory in ovariectomized rats[J]. Clinics (Sao Paulo),2011, 66 (4) : 673 –679. |
| [10] | Babaei S, Teichert-Kuliszewska K, Monge J C, et al. Role of nitric oxide in the angiogenic response in vitro to basic fibroblast growth factor[J]. Circ Res,1998, 82 (9) : 1007 –1015. |
| [11] | Boultadakis A, Pitsikas N. Effects of the nitric oxide synthase inhibitor L-NAME on recognition and spatial memory deficits produced by different NMDA receptor antagonists in the rat[J]. Neuropsychopharmacology,2010, 35 (12) : 2357 –2366. DOI:10.1038/npp.2010.109 |
| [12] | Moosavi M, Abbasi L, Zarifkar A, et al. The role of nitric oxide in spatial memory stages, hippocampal ERK and CaMKII phosphorylation[J]. Pharmacol Biochem Behav,2014, 122 : 164 –172. DOI:10.1016/j.pbb.2014.03.021 |
| [13] | Alderton W K, Cooper C E, Knowles R G. Nitric oxide synthase: structure, function and inhibition[J]. Biochem J,2001, 357 (pt3) : 593 –615. |
| [14] | Vincent S R, Kimura H. Histochemical mapping of nitric oxide synthase in the rat brain[J]. Neuroscience,1992, 46 (4) : 755 –784. |
| [15] | Cenquizca L A, Swanson L W. Spatial organization of direct hippocampal field CA1 axonal projections to the rest of the cerebral cortex[J]. Brain Res Rev,2007, 56 (1) : 1 –26. |
| [16] | Zola-Morgan S, Squire L R, Amaral D G. Human amnesia and the medial temporal region: enduring memory impairment following a bilateral lesion limited to field CA1 of the hippocampus[J]. J Neurosci,1986, 6 (10) : 2950 –2967. |
| [17] | Marinkovic I, Lyytinen J, Valanne L, et al. Bilateral hippocampal infarction as etiology of sudden and prolonged memory loss[J]. Case Rep Neurol,2012, 4 (3) : 207 –211. DOI:10.1159/000345564 |
| [18] | Kostic S, Pasovski V, Krsmanovic Z, et al. Bilateral hippocampal infarction and amnesia: A case report[J]. Vojnosanit Pregl,2015, 72 (6) : 545 –551. |
| [19] | de-la-Torre J C, Aliev G. Inhibition of vascular nitric oxide after rat chronic brain hypoperfusion: spatial memory and immunocytochemical changes[J]. J Cereb Blood Flow Metab,2005, 25 (6) : 663 –672. |
| [20] | Murohara T, Asahara T, Silver M, et al. Nitric oxide synthase modulates angiogenesis in response to tissue ischemia[J]. J Clin Invest,1998, 101 (11) : 2567 –2578. |
| [21] | Kerr A L, Steuer E L, Pochtarev V, et al. Angiogenesis but not neurogenesis is critical for normal learning and memory acquisition[J]. Neuroscience,2010, 171 (1) : 214 –226. DOI:10.1016/j.neuroscience.2010.08.008 |
| [22] | Gundersen H J, Bendtsen T F, Korbo L, et al. Some new, simple and efficient stereological methods and their use in pathological research and diagnosis[J]. APMIS,1988, 96 (5) : 379 –394. |
| [23] | Paxinos G, Watson C. The Rat Brain in Stereotaxic Coordinates[M]. San Diego: Academic Press, 1997 . |
| [24] | Qiang M, Chen Y C, Wang R, et al. Nitric oxide is involved in formation of learning and memory in rats: studies using passive avoidance response and Morris water maze task[J]. Behav Pharmacol,1997, 8 (2/3) : 183 –187. |
| [25] | Morris R. Developments of a water-maze procedure for studying spatial learning in the rat[J]. J Neurosci Methods,1984, 11 (1) : 47 –60. |
| [26] | Huang C X, Qiu X, Wang S, et al. Exercise-induced changes of the capillaries in the cortex of middle-aged rats[J]. Neuroscience,2013, 233 : 139 –145. DOI:10.1016/j.neuroscience.2012.12.046 |
| [27] | Shao W H, Li C, Chen L, et al. Stereological investigation of age-related changes of the capillaries in white matter[J]. Anat Rec (Hoboken),2010, 293 (8) : 1400 –1407. DOI:10.1002/ar.21184 |
| [28] | Wang S, Chen L, Zhang L, et al. Effects of long-term exercise on spatial learning, memory ability, and cortical capillaries in aged rats[J]. Med Sci Monit,2015, 21 : 945 –954. DOI:10.12659/MSM.893935 |
| [29] | Gundersen H J. Notes on the estimation of the numerical density of arbitrary profiles: the edge effect[J]. J Microsc,1977, 111 (pt2) : 219 –223. |
| [30] | Tang Y, Nyengaard J R, Pakkenberg B, et al. Age-induced white matter changes in the human brain: a stereological investigation[J]. Neurobiol Aging,1997, 18 (6) : 609 –615. |
| [31] | Qiu X, Li C, Jiang R, et al. The effects of short-term enriched environment on capillaries of the middle-aged rat cortex[J]. Neurosci Lett,2011, 505 (2) : 186 –190. DOI:10.1016/j.neulet.2011.10.019 |
| [32] | Bredt D S. Endogenous nitric oxide synthesis: biological functions and pathophysiology[J]. Free Radic Res,1999, 31 (6) : 577 –596. |
| [33] | Galea E, Reis D J, Feinstein D L. Cloning and expression of inducible nitric oxide synthase from rat astrocytes[J]. J Neurosci Res,1994, 37 (3) : 406 –414. |
| [34] | Ziche M, Morbidelli L. Nitric oxide and angiogenesis[J]. J Neurooncol,2000, 50 (1/2) : 139 –148. |
| [35] | Wei X M, Yang W, Liu L X, et al. Effects of L-arginine and Nω-nitro-L-arginine methylester on learning and memory and α7 nAChR expression in the prefrontal cortex and hippocampus of rats[J]. Neurosci Bull,2013, 29 (3) : 303 –310. DOI:10.1007/s12264-013-1331-1 |
| [36] | Luo C X, Zhu D Y. Research progress on neurobiology of neuronal nitric oxide synthase[J]. Neurosci Bull,2011, 27 (1) : 23 –35. DOI:10.1007/s12264-011-1038-0 |



