2. 400014 重庆,重庆医科大学附属儿童医院:儿科研究所干细胞实验室,儿童发育疾病研究教育部重点实验室,重庆市干细胞治疗工程技术研究中心
2. Laboratory of Stem Cells of Pediatric Institute, Key Laboratory of Child Development and Disorders of Ministry of Education, Chongqing Stem Cell Therapy Engineering Technical Center, the Children’s Hospital of Chongqing Medical University, Chongqing, 400014, China
膀胱疾病是泌尿系统最常见的疾病。而膀胱的先天发育畸形(如膀胱外翻)、慢性感染及肿瘤等疾病都会导致膀胱结构与功能的严重破坏,需要进行修复与重建[1]。目前临床的治疗方法主要为膀胱扩大术或者替代术,最常用的组织材料来自胃肠道组织。这些重建手术虽然有效地增加了膀胱的容积,但是也可能引起一系列严重的并发症,包括感染、肠梗阻、黏液产生、结石形成、电解质紊乱、穿孔以及癌变等[2-3]。因此找到合适的生物支架材料应用于膀胱组织修复重建,是膀胱组织工程研究的重点。大量研究表明猪来源的小肠黏膜下组织(small intestine submucosa,SIS)是一种天然的生物材料,可用于膀胱组织再生[4-5],但通过常规方法去细胞化后,SIS基质仍然含有致密的胶原组织,阻止细胞向基质内生长,影响膀胱组织再生。而作为外源性移植物,SIS中残存的细胞增加了其免疫原性[6-8]。本课题组前期研究中采用过氧乙酸(peroxyacetic acid,PAA)处理的方法,制作出具有3-D多孔结构的SIS,使其胶原组织致密程度及DNA含量明显降低,形成了适宜细胞向内生长的多孔结构,并能保持良好的生物材料的机械性能,将膀胱细胞种植在SIS上植于裸鼠皮下,膀胱细胞可以较好地生长[9-11]。本研究将从新型的3-D多孔结构的SIS这个新视点探讨其在膀胱组织再生中的应用,以期为膀胱及泌尿系统疾病的治疗提供新的生物修复材料。
1 材料与方法 1.1 实验动物雄性新西兰大白兔24只,4~5月龄,体质量约2.5 kg,购自重庆医科大学实验动物中心(2012-) 饲养温度24~25 ℃,正常喂食及饮水。术前禁食12 h,禁饮5 h。
1.2 主要实验材料及试剂新鲜猪小肠(重庆市渝中区黄沙溪屠宰场,冰盒保存运输),过氧乙酸(成都市科龙化工试剂厂),戊巴比妥钠(Notlas公司),异氟烷(瑞沃德公司),胎牛血清(Gibco公司)HE染色试剂(Solarbio公司),Masson三色染色液(森贝伽生物科技有限公司),无菌手术器械等由重庆医科大学附属儿童医院提供。
1.3 制备3-D多孔结构的SIS取新鲜猪小肠8~10 cm,手工机械分离小肠的黏膜层和浆肌层,清洗后浸泡于无菌去离子水中,置于摇床上以200 r/min振荡摇晃24 h;2%过氧乙酸溶液中浸泡2 h,无菌去离子水清洗8次,25 min/次;于含有0.1%过氧乙酸及20%无水乙醇溶液中浸泡2 h,无菌去离子水冲洗8次,25 min/次;最后储存在1%青链霉素的无菌去离子水中,4 ℃保存。术前将SIS材料浸泡于100%胎牛血清中,37 ℃孵箱内24 h。其中未经PAA处理的SIS为A组,PAA处理的SIS为B组,PAA处理后100%血清浸润的SIS为C组,每组8只。
1.4 SIS组织学检测SIS经10%中性福尔马林缓冲液固定24 h后,乙醇梯度脱水及石蜡包埋固定,切片厚度为5 μm,行HE染色、Masson染色,镜下观察其组织结构并摄片。
1.5 扫描电镜检测SIS结构取制备好的SIS以2.5%戊二醛室温下固定2 h,PBS清洗,固定清洗和系列梯度酒精脱水等处理后,在20.0 kV× 200扫描电镜下观察并摄片。
1.6 兔膀胱容量测定兔膀胱术前和修复重建术后4周行膀胱容量测定。异氟烷呼吸麻醉兔子后,通过尿道外口逆行插入6F导尿管,排空膀胱,用注射器向膀胱内缓慢注入温热生理盐水,当尿道外口有液体溢出时记录的生理盐水量即为膀胱最大容量(Volmax)。
1.7 兔膀胱损伤模型建立及修复重建取雄性新西兰大白兔,3%戊巴比妥钠30 mg/kg腹腔注射麻醉,麻醉成功后固定于手术台上,下腹部术区备皮、消毒、铺单后,取下腹部旁正中切口,长约5 cm,依次切开皮肤、皮下、肌肉、腹膜进入腹腔,暴露膀胱。排空膀胱后注入10 mL无菌生理盐水,牵起膀胱顶部,浆膜层标记3 cm×3 cm膀胱,切除约40%膀胱组织,建立膀胱损伤模型。分别用经过不同处理的3组SIS修复膀胱缺损组织;用4-0可吸收线连续锁边缝合SIS与膀胱的浆肌层,并用4-0丝线在吻合处浆膜面的前、后、左、右各缝1针作为标记。冲洗膀胱并检查吻合口有无漏尿,最后用大网膜包裹重建的膀胱;检查无活动性出血后,将膀胱复位,关闭切口并留置导尿1周。各组大白兔术后连续3 d肌肉注射青霉素40×104 U,观察其切口、排尿和进食情况等。
1.8 术后兔膀胱组织学检测各组大白兔于术后4周处死,取出膀胱,观察大体情况,其中粘连度分级为4种,+ + + +:与周围组织粘连严重,无法分离;+ + +:粘连较重,可分离伴出血;+ +: 粘连轻,分离时少量出血; +:粘连较轻,分离时极少出血。行HE染色、Masson三色染色。把距离移植物边缘0.5 cm的区域定义为边缘区,超出边缘0.5 cm 的区域定义为中心区,镜下分别观察组织学变化并摄片。对组织切片随机进行编号,如有血管的圆形或椭圆形样结构,即判定为血管;使用Image-pro Plus 6.0软件计算面积和切片总面积。
1.9 统计学分析采用SPSS 18.0统计软件,计量资料以 x±s表达,组间比较采用单因素方差分析。
2 结果 2.1 3-D多孔结构SIS的检测A组大白兔SIS的HE及Masson三色染色显示,SIS仍残留较多的细胞核,胶原组织结构仍较致密,多孔性差;B组、C组的SIS细胞核残留较少见,呈疏松多孔结构,与A组相比,PAA处理后的SIS去细胞化效果显著(图 1)。
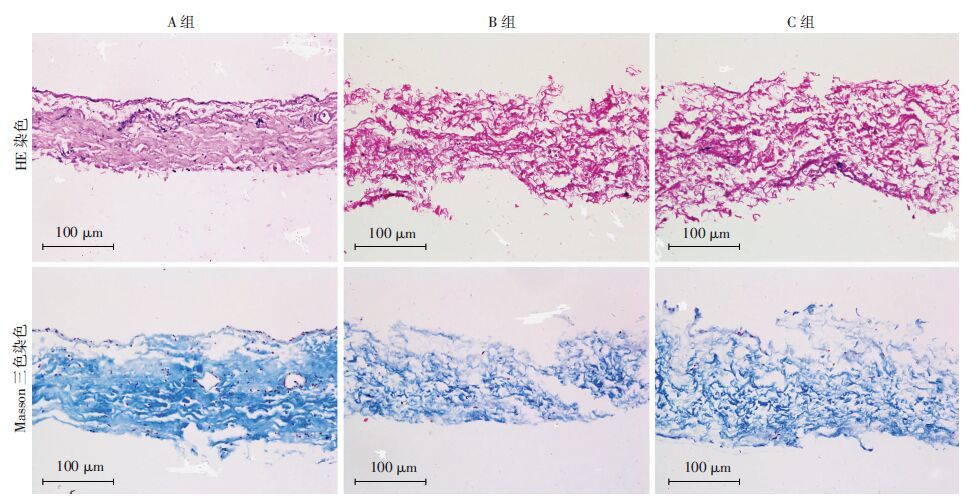
|
| 图 1 3组大白兔SIS的HE染色和Masson三色染色观察结果 |
2.2 SIS扫描电镜观察
3组大白兔经过不同处理的SIS生物材料扫描电镜下观察,A组SIS表面光滑,胶原为致密纤维结构,表面孔隙少(图 2)。与A组比较,B组、C组的SIS浆膜侧表面粗糙,黏膜侧网状纤维结构,孔隙更多,有利于细胞的黏附、生长,但B、C两组差异无统计学意义。
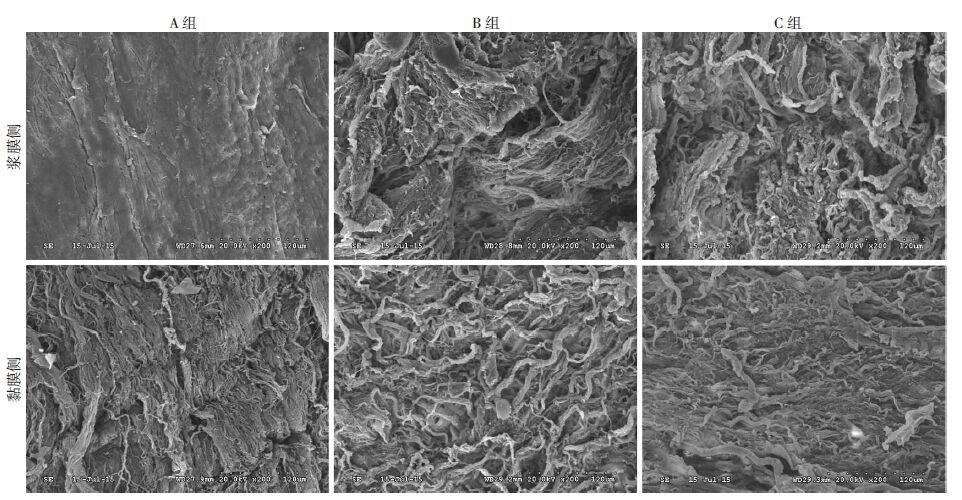
|
| 图 2 3组大白兔的SIS扫描电镜观察 |
2.3 术后膀胱大体标本观察
3组大白兔取材前A组死亡2只,B组死亡1只,C组死亡1只,死因均为SIS与膀胱缝合处尿漏导致腹腔感染,其余全部存活至取材。膀胱取材时,A、B、C组的膀胱局部粘连程度依次降低(粘连度分别为+ + + +、 + + +、+ +);A、B、C组均有结石形成(结石率分别为33.3%、28.6%、14.3%),质硬,黄豆大小,呈黄色,黏膜局部无钙斑形成。与A、B组比较,C组的黏膜颜色最接近正常膀胱(图 3),且其挛缩程度亦最轻。
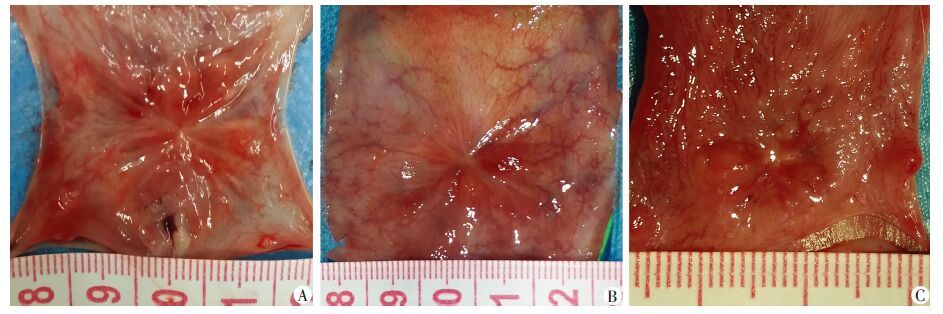
|
| 图 3 膀胱重建术后4周3组兔膀胱黏膜侧的大体形态 |
2.4 重建膀胱容量的测定
术后4周A、B、C组膀胱最大容量均缩小且依次增加,组间比较差异有统计学意义(P<0.05,表 1)。提示PAA及血清处理后的SIS有利于膀胱的再生和功能的恢复,而膀胱容量的变化还与术后的炎症反应、手术粘连以及SIS大小等因素有关。
| 组别 | n | 术前(mL) | 术后(mL) | 术后/术前(%) |
| A组 | 6 | 47.6±5.5 | 24.7±4.5 | 51.5±3.6 |
| B组 | 7 | 46.7±8.5a | 28.0±7.0a | 59.9±4.2a |
| C组 | 7 | 46.3±5.6ab | 31.7±1.5ab | 67.7±3.2ab |
| a:P<0.05,与A组比较;b:P<0.05,与B组比较 | ||||
2.5 重建膀胱的组织学观察 2.5.1 膀胱上皮细胞的再生
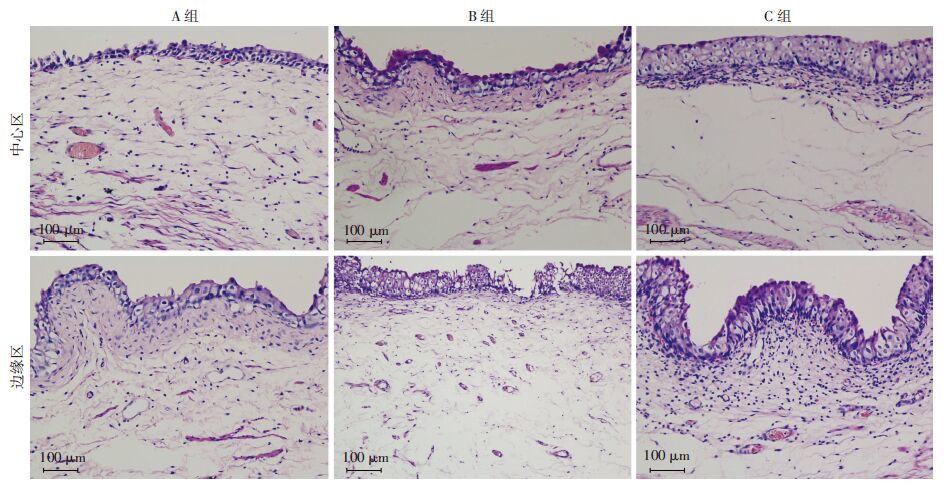
术后4周移植SIS的HE染色示,3组再生膀胱组织分中心区和边缘区(图 4),均可见膀胱上皮细胞再生;与中心区比较,边缘区上皮细胞再生较好;与A组比较,B、C组再生较好;与B组比较,C组略好,但差异不明显(图 5)。
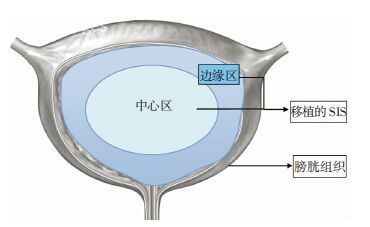
|
| 图 4 再生膀胱组织的中心区和边缘区示意图 |
|
| 图 5 HE染色观察膀胱重建术后4周3组兔再生膀胱上皮细胞 |
2.5.2 平滑肌形成
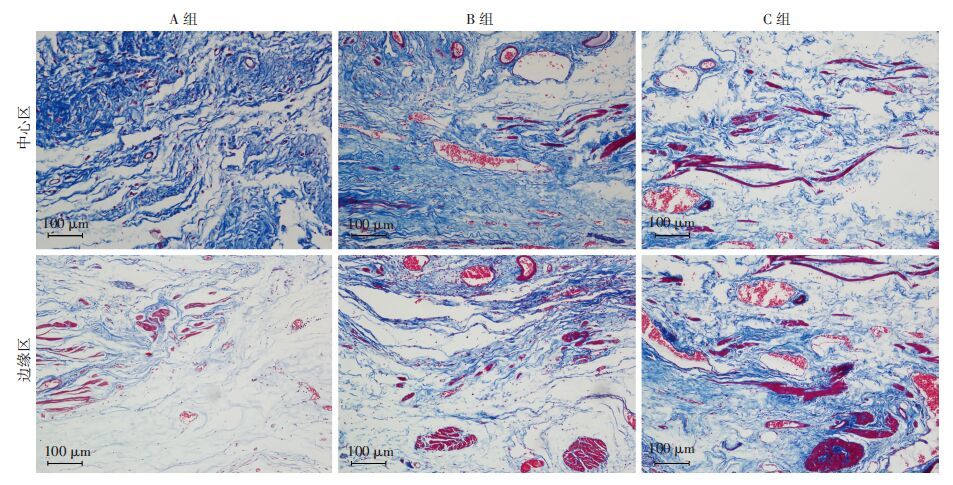
术后4周再生膀胱的Masson三色染色结果显示,A、B、C组膀胱平滑肌的再生均较少,排列不规则。A、B、C组膀胱平滑肌再生的数量占总面积的比例依次增加。边缘区分别为(1.44±1.26) 、(4.84±2.35) 、(5.98±1.56) 。B、C组与A组比较,差异有统计学意义(P<0.05) B组与C组比较,差异无统计学意义(P>0.05) 中心区分次为(0.11±0.10) 、(0.81±0.05) 、(0.82±0.32) ,B、C组与A组比较,差异有统计学意义(P<0.05) B组与C组比较,差异无统计学意义(P>0.05) 表明3-D多孔结构的SIS可以较好地促进平滑肌的再生;与B组比较,血清浸润的C组更有利于平滑肌再生,但差异不明显(图 6)。
|
| 图 6 Masson三色染色观察膀胱重建术后4周3组兔再生膀胱组织 |
2.5.3 血管再生
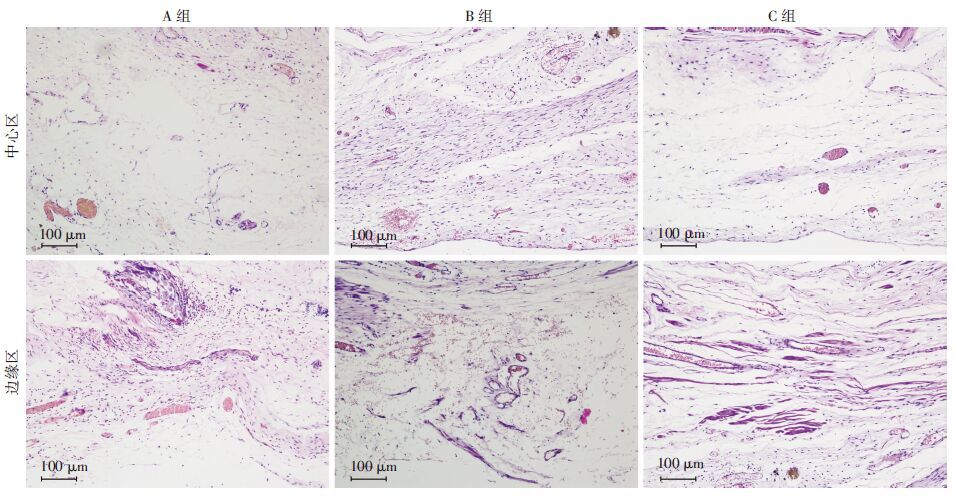
术后4周再生膀胱组织的HE染色结果显示(图 7),A、B、C组再生血管面积与总面积的百分比在边缘区依次递增,分别为(1.10±0.29) 、(1.94±0.53) 、(3.64±0.32) ,组间比较差异有统计学意义(P<0.05) 在中心区,A、B、C组再生血管面积与总面积的百分比分别为(0.45±0.20) 、(0.49±0.13) 、(0.79±0.08) ,组间比较差异有统计学意义(P<0.05)
|
| 图 7 HE染色观察膀胱重建术后4周3组兔再生膀胱组织 |
3 讨论
生物支架材料是膀胱组织工程研究的关键和基础,如何选择一种理想的生物支架材料是近年来组织工程研究领域的热点。生物支架材料主要分两大类,即天然生物材料[12](如SIS等)和人工合成的支架材料(如聚乳酸等)。人工合成的支架材料由于生物相容性的局限性而限制了其应用[13-14]。体外研究表明小肠黏膜下组织具有免疫原性低、生物相容性好等特点,且含有胶原、蛋白多糖及功能性生长因子等成分[9, 15]。本研究中使用的3-D多孔结构的SIS由于其独特的处理方式,使其具有3-D多孔结构,有利于细胞向内生长、增殖和功能维持等,在组织工程中作为支架材料具有明显的优势[9]。
应用于组织工程的生物材料很多,如Perchota等[16]研究中用膀胱扩大术将膀胱的无细胞基质移植到大鼠模型体内,可观察到膀胱上皮细胞、血管和平滑肌组织的再生,但是术后结石形成率、感染等并发症多。本研究结果显示3-D多孔结构的SIS可较好地促进膀胱的再生,膀胱的结石形成率低和粘连程度轻。
研究表明,支架材料在移植后快速血管化是组织工程再生的关键因素之一。Hodde等[17]发现SIS内的Ⅳ型胶原可促进血管内皮细胞在SIS表面形成细胞层并穿透基质生长,从而促进血管内皮细胞血管化;Zhou等[18]研究发现生长因子和去细胞化基质可以结合,移植后可促进膀胱组织再生。SIS含有丰富的Ⅳ型胶原,膀胱的无细胞化基质Ⅳ型胶原含量较少,而SIS中的Ⅳ型胶原可结合血清中的生长因子,且具有较好的促进细胞的黏附、生长和增殖,进而促进膀胱组织的再生和血管化。但本研究的移植材料中心区域的膀胱再生较差,使其快速血管化是进一步促进膀胱组织再生的新途径。
本研究从3-D多孔结构的SIS这个新视点,揭示了其能较好地促进膀胱组织的再生,是膀胱组织工程的一种理想的生物材料。既往研究表明,单纯应用支架材料修复与重建膀胱,结石形成、移植物萎缩和钙化等并发症高,从而影响重建器官结构与功能的恢复[16]。利用种子细胞结合生物支架较单纯利用支架修复重建膀胱有明显优势,获得了更好组织再生效果,特别是在膀胱平滑肌层的再生修复方面[19-20]。本课题组前期研究[21-23]发现尿液中存在一种具有多向分化潜能的干细胞,即尿源性干细胞(urine derived stem cells,USCs),由于其获取简单无创、单克隆性和可分泌多种生长因子(如血管内皮生长因子、血小板源性生长因子)等优点,且其来源于肾脏,在修复膀胱等泌尿系统疾病等方面具有独特的优势,应用前景广泛。因此,在前期研究的基础上制作的3-D多孔结构的SIS作为支架材料为下一步种子细胞和调控因子与材料的结合,制作组织工程化的膀胱提供了可能,希望为膀胱及泌尿系统的组织再生提供新的手段和方法。
| [1] | Geutjes P, Roelofs L, Hoogenkamp H, et al. Tissue engineered tubular construct for urinary diversion in a preclinical porcine model[J]. J Urol,2012, 188 (2) : 653 –660. DOI:10.1016/j.juro.2012.03.119 |
| [2] | Singh G, Thomas D G. Bowel problems after enterocystoplasty[J]. Br J Urol,1997, 79 (3) : 328 –332. DOI:10.1046/j.1464-410X.1997.03274 |
| [3] | Atala A. Tissue engineering of human bladder[J]. Br Med Bull,2011, 97 : 81 –104. DOI:10.1093/bmb/ldr003 |
| [4] | Lin H K, Godiwalla S Y, Palmer B, et al. Understanding roles of porcine small intestinal submucosa in urinary bladder regeneration: identification of variable regenerative characteristics of small intestinal submucosa[J]. Tissue Eng Part B Rev,2014, 20 (1) : 73 –83. DOI:10.1089/ten.teb.2013.0126 |
| [5] | Chung Y G, Algarrahi K, Franck D, et al. The use of bi-layer silk fibroin scaffolds and small intestinal submucosa matrices to support bladder tissue regeneration in a rat model of spinal cord injury[J]. Biomaterials,2014, 35 (26) : 7452 –7459. DOI:10.1016/j.biomaterials.2014.05.044 |
| [6] | Ashley R A, Palmer B W, Schultz A D, et al. Leukocyte inflammatory response in a rat urinary bladder regeneration model using porcine small intestinal submucosa scaffold[J]. Tissue Eng Part A,2009, 15 (11) : 3241 –3246. DOI:10.1089/ten.teb.2013.0126 |
| [7] | Ashley R A, Roth C C, Palmer B W, et al. Regional variations in small intestinal submucosa evoke differences in inflammation with subsequent impact on tissue regeneration in the rat bladder augmentation model[J]. BJU Int,2010, 105 (10) : 1462 –8. DOI:10.1111/j.1464-410X.2009.08965.x |
| [8] | Vaught J D, Kropp B P, Sawyer B D, et al. Detrusor regeneration in the rat using porcine small intestinal submucosal grafts: functional innervation and receptor expression[J]. J Urol,1996, 155 (1) : 374 –378. DOI:10.1016/S0022-5347(01)66663-1 |
| [9] | Liu Y, Bharadwaj S, Lee S J, et al. Optimization of a natural collagen scaffold to aid cell-matrix penetration for urologic tissue engineering[J]. Biomaterials,2009, 30 (23/24) : 3865 –3873. DOI:10.1016/j.biomaterials.2009.04.008 |
| [10] | Wu S, Liu Y, Bharadwaj S, et al. Human urine-derived stem cells seeded in a modified 3D porous small intestinal submucosa scaffold for urethral tissue engineering[J]. Biomaterials,2011, 32 (5) : 1317 –1326. DOI:10.1016/j.biomaterials.2010.10.006 |
| [11] | Hodde J. Naturally occurring scaffolds for soft tissue repair and regeneration[J]. Tissue Eng,2002, 8 (2) : 295 –308. DOI:10.1089/107632702753725058 |
| [12] | 段江洁, 汪维伟. 天然生物材料支架的应用[J]. 解剖学进展,2009, 15 (2) : 246 –249. DOI:10.16695/j.cnki.1006-2947.2009.02.032 |
| [13] | Orabi H, Bouhout S, Morissette A, et al. Tissue engineering of urinary bladder and urethra: advances from bench to patients[J]. ScientificWorldJournal,2013, 2013 : 154564 . DOI:10.1155/2013/154564 |
| [14] | Pokrywczynska M, Jundzill A, Adamowicz J, et al. Is the poly (l- actide- co- caprolactone) nanofibrous membrane suitable for urinary bladder regeneration?[J]. PLoS One,2014, 9 (8) : e105295 . DOI:10.1371/journal.pone.0105295 |
| [15] | Chun S Y, Lim G J, Kwon T G, et al. Identification and characterization of bioactive factors in bladder submucosa matrix[J]. Biomaterials,2007, 28 (29) : 4251 –4256. DOI:10.1016/j.biomaterials.2007.05.020 |
| [16] | Perchota H J, Gleason C A, Dahms S E, et al. Bladder acellular matrix graft: in vivo functional properties of the regenerated rat bladder[J]. Urol Res,1999, 27 (3) : 206 –213. DOI:10.1007/s002400050111 |
| [17] | Hodde J, Record R D, Tullius R S, et al. Retention of endothelial cell adherence to porcine-derived extracellular matrix after disinfection and sterilization[J]. Tissue Eng,2002, 8 (2) : 225 –234. DOI:10.1089/107632702753724996 |
| [18] | Zhou L, Yang B, Sun C, et al. Coadministration of platelet-derived growth factor-BB and vascular endothelial growth factor with bladder acellular matrix enhances smooth muscle regeneration and vascularization for bladder augmentation in a rabbit model[J]. Tissue Eng Part A,2013, 19 (1/2) : 264 –276. DOI:10.1089/ten.tea.2011.0609 |
| [19] | Gerharz E W, McDougal W S. Metabolic and functional consequences of urinary diversion through intestinal segments[J]. World J Urol,2004, 22 (3) : 155 –156. DOI:10.1007/s00345-004-0428-6 |
| [20] | Bharadwaj S, Liu G, Shi Y, et al. Multipotential differentiation of human urine-derived stem cells: potential for therapeutic applications in urology[J]. Stem Cells,2013, 31 : 1840 –1856. DOI:10.1002/stem.1424 |
| [21] | Zhang Y, McNeill E, Tian H, et al. Urine derived cells are a potential source for urological tissue reconstruction[J]. J Urol,2008, 180 (5) : 2226 –2233. DOI:10.1016/j.juro.2008.07.023 |
| [22] | Qin D, Long T, Deng J, et al. Urine-derived stem cells for potential use in bladder repair[J]. Stem Cell Res Ther,2014, 5 (3) : 69 . DOI:10.1186/scrt458 |
| [23] | Wu R, Liu G, Yang B, et al. PD8-01 Human urine-derived stem cells originate from parietal stem cells[J]. J Urol,2014, 191 (4 Suppl) : e217 . DOI:10.1016/j.juro.2013.02.1631 |



