动脉瘤性蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种高发病率和高病死率的毁灭性疾病[1]。早期脑损伤(early brain injury,EBI)被认为是导致SAH患者高风险死亡和不良预后的主要因素[2, 3]。尽管对于SAH后EBI的发病机制尚不清楚,但是大多数学者认为SAH后颅内压急剧升高和脑血流量减少导致的急性脑缺血在EBI中发挥重要作用[4]。低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是缺血缺氧条件下广泛存在哺乳动物和人体内的一种转录因子,能够激活下游多种基因的表达,从而调节机体对外界刺激的应答反应[5]。大量研究报道,在大鼠SAH模型的脑实质内可见HIF-1α表达[6, 7, 8, 9],同时通过不同的方式抑制HIF-1α可以减轻脑水肿、血脑屏障通透性和神经元凋亡等EBI表现[10]。因此抑制HIF-1α可能为EBI治疗提供新思路。
液态氟碳(perfluorooctyl-bromide,PFOB)属于新三代全氟碳化合物(perfluorocarbon,PFC),具有性质稳定、良好的携氧功能、低表面张力、低毒性等独特的性质,使其广泛应用于临床治疗、新型造影剂、靶向药物载体等领域[11, 12]。而纳米粒级的PFOB直径更小、半衰期更长、循环时间更长、更易穿过血管内皮间隙等特点[13]。本课题组前期初步证实PFOB纳米粒对SAH后EBI有神经保护作用[14],但是其发挥作用具体机制还不清楚。因此我们提出假设:PFOB纳米粒对EBI的神经保护作用,可能与抑制HIF-1α蛋白表达相关。本研究采用颈内动脉穿刺法建立SAH模型,给予不同剂量PFOB纳米粒干预,观察PFOB对SAH后HIF-1α的影响。
1 材料与方法 1.1 实验试剂液态氟碳购自Alliance Pharmaceutical公司,于重庆医科大学超声影像学研究所乳化成纳米粒;TUNEL试剂盒购自Roche公司;免疫组化试剂盒(PV9001)和DAB显色剂购自中杉金桥公司;HIF-1α(ab51608)蛋白抗体购自Abcam公司。GAPDH内参购自博奥森公司。其余试剂由重庆医科大学附属第一医院实验中心提供。
1.2 实验对象及分组健康雄性SD大鼠100只,由重庆医科大学动物实验中心提供,体质量为(300±20)g,分为5个组:假 手术组(Sham)、蛛血组 (SAH)、蛛血+安慰剂组(SAH+ vehicle)、蛛血+5 g/kg液态氟碳纳米粒组(SAH+5 g/kg PFOB)和蛛血+10 g/kg液态氟碳纳米粒组(SAH+10 g/kg PFOB)。SAH组采用颈内动脉穿刺法制作模型;Sham组同SAH组,但不刺破动脉;PFOB纳米粒造模成功后1 h尾静脉注射,安慰剂组注射等量的生理盐水。
1.3 SAH模型制作采用改良颈内动脉穿刺法制作SAH模型[15, 16]。大鼠经10%水合氯醛(3.5 mL/kg)腹腔麻醉,仰卧位固定于手术架上,取颈部正中切口,分离一侧颈总动脉颈内动脉和颈外动脉,将2-0单股尼龙线由一侧颈外动脉进入,导入同侧的颈内动脉,刺入18~20 mm后感觉阻力存在,继续插入约3 mm,刺破大脑中动脉和大脑前动脉分叉处,抽出细线,缝合颈部皮肤。假手术组除了不刺破血管,其余步骤与SAH组相同。如建模过程中出现大鼠死亡情况,及时补充新的大鼠以保证每组20只。
1.4 神经行为功能缺损评分在SAH造模后24 h,对各组大鼠进行神经行为功能缺损评分,主要根据Yamaguchi神经评分系统[17],按照表 1评分标准,评分越高,表明神经行为功能损伤越明显。
造模24 h后每组各取5只大鼠,10%水合氯醛(3.5 mL/kg)腹腔麻醉端头处死后,迅速取出脑组织 并立即称重(湿质量)。然后将所有脑组织至于105 ℃ 烤箱,48 h后再次称量(干质量)。脑水肿可用公式求得:[(湿质量-干质量)/湿质量]×100%。
1.6 血脑屏障通透性检测血脑屏障通透性的定量分析是通过伊文思蓝渗透率的表现的。股静脉注射2%伊文思蓝(evans blue,EB)染料,1 h后,麻醉大鼠并用PBS灌注取脑,脑组织称重后超声匀浆破碎,4 ℃,2 000 r/min离心20 min,收集上清,重复3次。取上清测定620 nm条件下的 光密度值[D(620)],标准曲线上获取EB含量(mg/g)。
1.7 原位细胞凋亡检测技术(TUNEL)大鼠经用10%水合氯醛麻醉,先后用磷酸盐缓冲液(PBS)和4%多聚甲醛灌注,迅速取出脑组织置于4%多聚甲醛固定48 h,切除小脑及前三分之一的脑组织,剩余脑组织石蜡包埋,并取冠状位连续切4 μm薄片贴敷于载玻片,选取海马结构完整的切片经常规、水化;0.4% Triton室温下破膜 10 min,滴加TUNEL试剂1和试剂2(1 ∶9)、37 ℃孵育60 min,DAB显色、复染、盐酸酒精分化、返蓝、脱水、中性树胶封片。各组选取位置在相同范围内的切片各5张,光学显微镜下观察大鼠海马神经细胞,以棕黄色颗粒的有核细胞为阳性细胞,每张切片高倍镜(10×40)下随机选择5个不同的视野(均取自海马CA1区),运用Image-Pro Plus软件计数每个视野阳性细胞率,取其平均值。
1.8 实时荧光定量PCR分析每组选取5只大鼠,麻醉后迅速取脑组织并分离出海马,用TRIzol试剂盒提取各组总RNA,并用紫外分光光度计测浓度,然后运用AMV First Strand cDNA试剂盒 (SK 2445) 和 CFX96TM Real-Time PCR检测系统将RNA反转录cDNA。根据检测目的基因,通过Gene Bank 设计引物序列,HIF-1α:上游:5′-GTCAGTCACTGCCACCGCAACTG-3′,下游5′- CTGTCTGGTGA- GGCTGTCCGA-3′,GAPDH: 上游:5′- TAGTTGCGTTACACCCTTTCTTG-3′,下游:5′- TCACCTTCACCGTTCCAGTTT-3′。PCR反应条件:第1步,95 ℃变性30 s,第2步,95 ℃变性5 s、58 ℃退火34 s,共40个循环;绘制溶解曲线的条件为95 ℃变性15 min、60 ℃退火60 s、95 ℃变性15 s。数据运用公式RQ=2-ΔΔCt的方法进行分析,以2-ΔΔCt表示相关基因的mRNA表达水平,实验重复3次。
1.9 免疫组化检测HIF-1α蛋白表达采用PV9001两步法:取含有海马完整海马结构的石蜡切片,经常规脱蜡、水化、抗原修复;3%H2O2室温下孵育10 min,PBS清洗后孵育一抗(HIF-1α 1 ∶50)4 ℃过夜;PBS冲洗后滴加试剂1、室温下孵育20 min;PBS冲洗再次冲洗后滴加试剂2、室温孵育20 min、PBS冲洗后DAB显色、复染、盐酸酒精分化、返蓝、脱水、中性树胶封片。各组选取位置在相同范围内的切片各5张,光学显微镜下观察大鼠海马神经细胞,以胞质或胞核内出现鲜艳的棕黄色颗粒的有核细胞为阳性细胞,每张切片高倍镜(10×40)下随机选择5个不同的视野(均取自海马CA1区),运用Image-Pro Plus软件计数每个视野阳性细胞率,取其平均值。
1.10 Western blot检测HIF-1α蛋白表达每组随机取5只大鼠,麻醉后取脑组织并分离出海马组织,置于细胞裂解液中,再加入蛋白酶抑制剂,低温匀浆,静置40 min,4 ℃ 12 000×g离心15min,取上清,分装-80 ℃保存备用。BCA测蛋白浓度,根据蛋白浓度取等量蛋白,加5×SDS-聚丙烯酰胺凝胶(SDS-PAGE)上样缓冲液煮沸5 min,进行SDS-PAGE电泳后将蛋白转移到PVDF膜上,用含5%脱脂奶粉、1 g/L 吐温-20的Tis-HCl缓冲盐溶液(TBST)封闭液置摇床上封闭2 h,经1×TBST充分漂洗(5 min,3次),HIF-1α单克隆抗体按照1 ∶1 000稀释,4 ℃孵育过夜,充分漂洗后加山羊抗兔二抗按照1 ∶2 000稀释,室温孵育1 h,ECL发光,暗室胶片显影。通过Fusion 软件分析图像,以HIF-1α蛋白条带的灰度值与GAPDH蛋白条带的灰度值的比值表示目的蛋白的相对表达水平。
1.11 统计学分析计量资料以x±s表示。采用SPSS 17.0统计软件,组间比较采用方差分析和t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 PFOB对神经行为功能缺失的影响Sham组没有神经行为功能缺失。SAH组和SAH+ vehicle组中大鼠神经行为功能缺失评分明显高于Sham组(P<0.05),而这两组之间差异并无统计学意义(P>0.05)。给予PFOB(5 g/kg和10 g/kg)纳米粒的干预治疗后,神经行为功能缺失与SAH组相比明显降低,且10 g/kg PFOB组降低较5 g/kg PFOB组更明显(P<0.05,图 1A)。
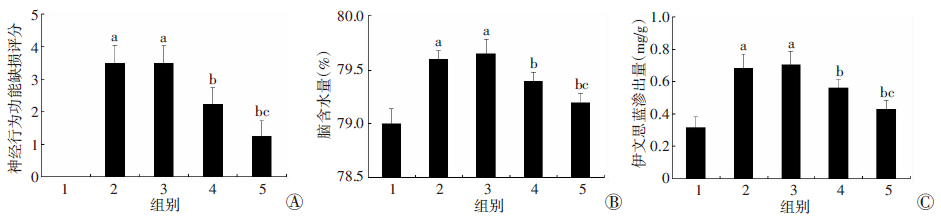 |
| 1: Sham组;2:SAH组:3:SAH+vehicle组;4: SAH+5 g/kg PFOB组;5: SAH+10 g/kg PFOB组;a:P<0.05,与Sham组比较;b:P<0.05,与SAH组和SAH+vehicle组比较;c:P<0.05,与SAH+5 g/kg PFOB组比较 图 1 各组大鼠神经行为功能缺损评分(A)、脑含水量(B)、伊文思蓝渗出量(C)比较 |
与Sham组相比,在SAH组和SAH+vehicle组中脑水肿和伊文思蓝渗出率明显增加(P<0.05)。而予以PFOB纳米粒干预后,脑水肿和伊文思蓝渗出率较SAH组明显降低,且SAH+10 g/kg PFOB组降低程度较SAH+5 g/kg PFOB组更明显(P<0.05,图 1B、C)。
2.3 PFOB对神经元凋亡的影响TUNEL染色结果显示,在造模24 h后Sham组海 马区少量TUNEL阳性染色细胞,而在SAH组和SAH+ vehicle组的海马区明显见到大量TUNEL阳性细胞标记的凋亡细胞。给予PFOB(5、10 g/kg)治疗干预后,在海马区TUNEL染色的凋亡细胞较SAH组明显减少,且SAH+10 g/kg PFOB组较SAH+5 g/kg PFOB组减少更明显(P<0.05,图 2)。
 |
| A:Sham组;B:SAH组;C:SAH+vehicle组;D:SAH+5 g/kg PFOB组;E:SAH+10 g/kg PFOB组;F:半定量分析结果 1: Sham组;2:SAH组:3:SAH+vehicle组;4: SAH+5 g/kg PFOB组;5: SAH+10 g/kg PFOB组 a:P<0.05,与Sham组比较;b:P<0.05,与SAH组和SAH+vehicle组比较;c:P<0.05,与SAH+5 g/kg PFOB组比较 图 2 TUNEL染色观察各组大鼠海马CA1区神经元凋亡情况 |
HIF-1α mRNA在Sham组表达量极低。相比之下,HIF-1α mRNA在SAH组和SAH+vehicle组表达量明显增加(P<0.05)。而在造模1 h后予以PFOB纳米粒干预,并不能降低HIF-1α mRNA表达水平(图 3)。
 |
| 1:Sham组;2:SAH组;3:SAH+vehicle组;4:SAH+5 g/kg PFOB组;5:SAH+10 g/kg PFOB组 a:P<0.05,与Sham组比较 图 3 荧光定量PCR检测各组HIF-1α mRNA的表达变化 |
在脑组织海马中,HIF-1α主要在神经元表达,既可以在细胞核中,也可以在胞质中表达。Sham组海马区仅见少量的HIF-1α阳性染色细胞的表达,且主要表达在胞质。与Sham组相比,在造模24 h后SAH组和SAH+vehicle组中海马区的神经元HIF-1α阳性染色细胞明显增多。在造模1 h后给予PFOB(5、10 g/kg)纳米粒干预,海马区HIF-1α阳性细胞数目较SAH明显减少(P<0.05),且SAH+10 g/kg PFOB组阳性细胞减少较SAH+5 g/kg PFOB组更明显(P<0.05,图 4)。
 |
| A:Sham组;B:SAH组;C:SAH+vehicle组;D:SAH+5 g/kg PFOB组;E:SAH+10 g/kg PFOB组;F:半定量分析 1: Sham组;2:SAH组;3:SAH+vehicle组;4: SAH+5 g/kg PFOB组;5:SAH+10 g/kg PFOB组 a:P<0.05,与Sham组比较;b:P<0.05,与SAH组和SAH+vehicle组比较;c:P<0.05,与SAH+5 g/kg PFOB组比较 图 4 免疫组化观察各组大鼠海马CA1区神经元HIF-1α的表达 |
造模24 h后,Western blot检测结果显示Sham组海马区HIF-1α蛋白表达量很低。相比之下,在SAH组和SAH+vehicle组中HIF-1α蛋白表达量明显升高(P<0.05)。而在造模1 h后予以PFOB治疗能够明显降低HIF-1α蛋白表达,且SAH+10 g/kg PFOB组降低程度明显高于SAH+5 g/kg PFOB组(P<0.05,图 5)。
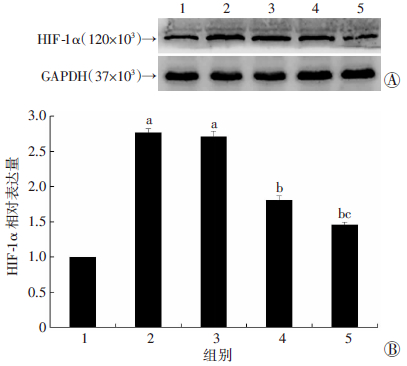 |
| 1: Sham组;2:SAH组;3:SAH+vehicle组;4: SAH+5 g/kg PFOB组;5: SAH+10 g/kg PFOB组 A:Western blot检测结果;B:半定量分析结果 a:P<0.05,与Sham组比较;b:P<0.05,与SAH组和SAH+vehicle 组比较;c:P<0.05,与SAH+5 g/kg PFOB组比较 图 5 液态氟碳纳米粒对大鼠SAH后24 h海马区HIF-1α 蛋白表达的影响 |
SAH是具有高病死率和致残率的临床重症,占所有脑卒中的5%,约30%的存活者留有不同程度的残疾[1]。目前研究认为EBI是导致SAH患者病死率较高和决定预后的首要因素。EBI是指SAH后72 h之内整个脑组织发生的直接损伤,涉及迟发性脑血管痉挛出现前(3 d至3周)脑组织内发生的所有病理生理过程,包括脑水肿、血脑屏障(blood brain barrier,BBB)破坏、脑细胞死亡等[3]。虽然对于EBI的发病机制尚不清楚,但是多数学者认为SAH后颅内压急剧升高和脑血流量锐减导致的急性脑缺血在EBI中发挥重要作用。因此,对EBI的干预成为能够改善SAH预后的关键。
HIF-1是1992年Semenza等[18]在Hep3B细胞提取物中发现。它是由对氧敏感的α亚基和稳定表达的β亚基组成的异源二聚体,而HIF-1α既是HIF-1的调节亚基又是活性亚基,因此HIF-1的生物效应是由HIF-1α亚基实现的。大量研究证实HIF-1α与脑外伤、脑缺血和脑出血性疾病密切相关[19, 20]。Ostrowski等[6]首先报道SAH模型24 h后大鼠脑实质内可见HIF-1α高表达。Wang等[8]研究发现大鼠SAH后大量表达的HIF-1α通过调节水孔蛋白-4和金属基质蛋白酶-9在SAH后脑水肿的发生中发挥重要作用。随后胡强等[21]研究报道,HIF-1α在大鼠SAH后大量表达,并且在12 h明显增多,24 h达高峰,72 h显著下降;同时HIF-1α参与早期脑损伤中的神经元凋亡。因此,他们认为HIF-1α参与EBI的发生,而抑制HIF-1α能够发挥神经保护作用。同时Ostrowski等[6]研究发现高压氧治疗能够减轻SAH后早期脑损伤,部分原因是其抑制HIF-1α及其下游的VEGF和BNIP3蛋白表达。Wu等[10]研究报道通过HIF-1α的抑制剂2ME2干预SAH,在不影响颅内压、脑灌注压和脑血流量的情况下,能够减轻脑水肿和神经元凋亡等早期脑损伤的表达。这些研究都进一步证实在SAH后EBI中通过不同的方式抑制HIF-1α及其下游靶基因蛋白的表达,能够发挥神经保护作用。
PFOB属于安全无毒全氟碳化合物(PFC)的一种,具有高度稳定性和良好的携氧功能,经过乳化的PFOB能够达到最小直径90 nm,使其更容易通过血管内皮细胞间隙,并使停留在血管内时间大大延长,同时大大增加了PFOB的携氧能力和穿透能力。从最初利用PFC特殊的理化性质,到后来发现PFOB具有抗氧化应激损伤[22],再到PFOB具有抗炎症反应[23]等作用,PFOB已经广泛应用于临床的各个领域,也越来越受到医学研究工作者的重视。在神经外科领域,PFC被用于颅脑外伤后的意识恢复、脊髓外伤后神经保护和预防出血性梗死等疾病中[24, 25],但是对于PFOB纳米粒作用于SAH的研究目前尚处于起步阶段。本团队前期实验通过视交叉前池注血法建立SAH模型,经尾静脉注射PFOB纳米粒对SAH大鼠干预发现,PFOB纳米粒能够减轻脑水肿、神经元凋亡等早期脑损伤表现,发挥神经保护作用[14]。但是对于PFOB纳米粒发挥神经保护作用机制还不清楚。本实验采用颈内动脉穿刺法建立SAH后早期脑损伤的模型,于术后1 h经尾静脉予以(5、10 g/kg)不同剂量PFOB纳米粒干预,结果发现脑水肿、血脑屏障通透性、海马CA1区神经元凋亡等早期脑损伤表现较SAH组明显减轻,神经行为功能缺损明显改善,且SAH+10 g/kg PFOB组作用效果比SAH+5 g/kg PFOB组更明显。因此,进一步证实了PFOB纳米粒对SAH后EBI的神经保护作用。同时于造模24 h采取大鼠海马组织,分别采用免疫组化和Western blot检测HIF-1α蛋白表达情况,发现在SAH组HIF-1α蛋白的表达较Sham组明显升高,予以PFOB纳米粒干预后HIF-1α蛋白表达显著下降,同样SAH+10 g/kg PFOB组抑制效果较SAH+5 g/kg PFOB组更明显。上述实验表明PFOB纳米粒在EBI中能够抑制HIF-1α表达,而这种抑制作用可能与PFOB的神经保护作用密切相关。但是对于PFOB纳米粒作用于HIF-1α的是从调节mRNA水平还是翻译和翻译后水平,目前还不清楚。而本试验结果显示,PFOB并不能改变HIF-1α mRNA表达。因此,我们认为可能的机制是:PFOB纳米粒含有高浓度氧,能够改善脑组织的缺血缺氧状态,进而激活HIF-1羟化酶,使得HIF-1α被羟化,羟化的HIF-1α可 与希佩尔-林道病肿瘤抑制蛋白结合,结合后的HIF-1α 能够被E3泛素化蛋白识别,从而导致HIF-1α被26S蛋白酶泛素化降解,从而达到降低HIF-1α在胞质中的积累。当然这只是假设的机制之一,仍需进一步研究证实和明确具体的作用机制,为推动PFOB纳米粒尽早应用于临床,提供可靠的理论依据。
| [1] | Connolly E S Jr, Rabinstein A A, Carhuapoma J R, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke, 2012, 43(6): 1711-1737. DOI: 10.1161/STR.0b013e3182587839 |
| [2] | Cahill W J, Calvert J H, Zhang J H. Mechanisms of early brain injury after subarachnoid hemorrhage[J]. J Cereb Blood Flow Metab, 2006, 26(11): 1341-1353. DOI: 10.1038/sj.jcbfm.9600283 |
| [3] | Kusaka G, Ishikawa M, Nanda A, et al. Signaling pathways for early brain injury after subarachnoid hemorrhage[J]. J Cereb Blood Flow Metab, 2004, 24(8): 916-925. DOI: 10.1097/01.WCB.0000125886.48838.7E |
| [4] | Sehba F A, Bederson J B. Mechanisms of acute brain injury after subarachnoid hemorrhage[J]. Neurol Res, 2006, 28(4): 381-398. DOI: 10.1179/016164106X114991 |
| [5] | Semenza G L, Agani F, Feldser D, et al. Hypoxia, HIF-1, and the pathophysiologi of common human diseases[J]. Adv Exp Med Biol, 2000, 475: 123-130. |
| [6] | Ostrowski R P, Colohan A R, Zhang J H. Mechanisms of hyperbaric oxygen-induced neuroprotection in a rat model of subarachnoid hemorrhage[J]. J Cereb Blood Flow Metab, 2005, 25(5): 554-571. DOI: 10.1038/sj.jcbfm.9600048 |
| [7] | Yan J, Chen C, Lei J, et al. 2-methoxyestradiol reduces cerebral vasospasm after 48 hours of experimental subarachnoid hemorrhage in rats[J]. Exp Neurol, 2006, 202(2): 348-356. DOI: 10.1016/j.expneurol.2006.06.009 |
| [8] | Wang Z, Meng C J, Shen X M, et al. Potential contribution of hypoxia-inducible factor-1α, aquaporin-4, and matrix metalloproteinase-9 to blood-brain barrier disruption and brain edema after experimental subarachnoid hemorrhage[J]. J Mol Neurosci, 2012, 48(1): 273-280. DOI: 10.1007/s12031-012-9769-6 |
| [9] | Hishikawa T, Ono S, Ogawa T, et al. Effect of deferoxamine-activated hypoxia inducible factor-1 on the brainstem following subarachnoid haemorrhage[J]. Neurosurgery, 2008, 62(1): 232-241. DOI: 10.1227/01.NEU.0000311082.88766.33 |
| [10] | Wu C, Hu Q, Chen J, et al. Inhibiting HIF-1α by 2ME2 ameliorates early brain injury after experimental subarachnoid hemorrhage in rats[J]. Biochem Biophys Res Commun, 2013, 437(3): 469-474. DOI: 10.1016/j.bbrc.2013.06.107 |
| [11] | Lin C Y, Javadi M, Belnap D M, et al. Ultrasound sensitive eLiposomes containing doxorubicin for drug targeting therapy[J]. Nanomedicine, 2014, 10(1): 67-76. DOI: 10.1016/j.nano.2013.06.011 |
| [12] | Chen J, Pan H, Lanza G M, et al. Perfluorocarbon nanoparticles for physiological and molecular imaging and therapy[J]. Adv Chronic Kidney Dis, 2013, 20(6): 466-478. DOI: 10.1053/j.ackd.2013.08.004 |
| [13] | Kaneda M M, Caruthers S, Lanza G M, et al. Perfluorocarbon nanoemulsions for quantitative molecular imaging and targeted therapeutics[J]. Ann Biomed Eng, 2009, 37(10): 1922-1933. DOI: 10.1007/s10439-009-9643-z |
| [14] | Zhang H, Xu R, Xie F, et al. Protective effects of perfluorooctyl-bromide nanoparticles on early brain injuries following subarachnoid hemorrhage in rats[J]. Am J Transl Res, 2015, 7(8): 1404-1416. |
| [15] | Veelken J A, Laing R J, Jakubowski J. The Sheffield model of subarachnoid hemorrhage in rats[J]. Stroke, 1995, 26(7): 1279-1284. |
| [16] | Bederson J B, Germano I M, Guarino L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat[J]. Stroke, 1995, 26(6): 1086-1092. |
| [17] | Yamaguchi M, Zhou C, Nanda A, et al. Ras protein contributes to cerebral vasospasm in a canine double-hemorrhage model[J]. Stroke, 2004, 35(7): 1750-1755. DOI: 10.1161/01.STR.0000129898.68350.9f |
| [18] | Semenza G L, Wang G L. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J]. Mol Cell Biol, 1992, 12(12): 5447-5454. |
| [19] | Higashida T, Kreipke C W, Rafols J A, et al. The role of hypoxia-inducible factor-1α, aquaporin-4, and matrix metalloproteinase-9 in blood-brain barrier disruption and brain edema after traumatic brain injury[J]. J Neurosurg, 2011, 114(1): 92-101. DOI: 10.3171/2010.6.JNS10207 |
| [20] | Chen C, Hu Q, Yan J, et al. Early inhibition of HIF-1α with small interfering RNA reduces ischemic-reperfused brain injury in rats[J]. Neurobiol Dis, 2009, 33(3): 509-517. DOI: 10.1016/j.nbd.2008.12.010 |
| [21] | 胡强, 吴骋, 陈敬寅, 等. 蛛网膜下腔出血大鼠早期大脑皮层低氧诱导因子-1α表达与细胞凋亡相关性研究[J]. 浙江大学学报: 医学版, 2014, 43(1): 58-65. |
| [22] | Augustin A J, Spitznas M, Koch F, et al. Effects of perfluorooctylbromide and vitamin E on ischemia induced retinal oxidative tissue damage[J]. Exp Eye Res 1998, 66(1): 19-24. |
| [23] | Rotta A T, Gunnarsson B, Fuhrman B P, et al. Perfluorooctyl bromide (perflubron) attenuates oxidative injury to biological and nonbiological systems[J]. Pediatr Crit Care Med, 2003, 4(2): 233-238. |
| [24] | Zhou Z, Sun D, Levasseur J E, et al. Perfluorocarbon emulsions improve cognitive recovery after lateral fluid percussion brain injury in rats[J]. Neurosurgery, 2008, 63(4): 799-807. DOI: 10.1227/01.NEU.0000325493.51900.53 |
| [25] | Yacoub A, Hajec M C, Stanger R, et al. Neuroprotective effects of perflurocarbon (oxycyte) after contusive spinal cord injury[J]. J Neurotrauma, 2014, 31(3): 256-267. DOI: 10.1089/neu.2013.3037 |



