慢性肾脏病(chronic kidney disease,CKD)患者体内尿毒素蓄积,对机体的多个系统均可造成不良影响。欧洲尿毒素研究组(European uremic toxin work group,EUTox)根据尿毒素的理化性质将其分为小分子水溶性物质、中分子物质及蛋白结合毒素三类[1]。很多小分子毒素,譬如硫酸吲哚酚(indoxyl sulfate,IS)可与血浆白蛋白结合,导致常规透析难以将其清除[2]。研究表明,CKD患者体内IS的蓄积可促进心血管事件和感染等并发症的发生,其发病机制至今尚未完全明确,可能与氧化应激、炎症反应、免疫功能障碍等有关[3, 4, 5, 6]。新近研究发现,单核巨噬系统在上述机制中可能发挥重要作用[7, 8]。既往关于IS的体外研究多以游离毒素进行实验,忽略了IS的蛋白结合特性。本研究以人单核细胞作为研究对象,观察蛋白结合IS对单核细胞趋化功能的影响,并初步探讨其机制。
1 材料与方法 1.1 材 料人单核细胞株THP-1(美国ATCC细胞库),RPMI1640培养基、胎牛血清(美国HyClone),硫酸吲哚酚、人血白蛋白(美国Sigma),CCK-8试剂盒(日本同仁),Amicon Ultra-15离心过滤器(30 K,Millipore),Transwell小室(8 μm,24孔,美国Millipore),MCP-1 ELISA试剂盒(美国eBioscience),PE标记的抗人CCR2多克隆抗体及其同型对照(美国BioLegend),PBS、多聚甲醛、结晶紫(第三军医大学中心实验室)。
1.2 方 法 1.2.1 THP-1细胞培养、蛋白结合硫酸吲哚酚的配制及鉴定THP-1细胞用含10%胎牛血清的RPMI1640培养基在37 ℃、5% CO2培养箱中培养,2~3 d 换液1次。蛋白结合IS的配制:参考文献[1]中CKD患者的血清总IS水平,将不同浓度的IS溶液(100、200、400、800 μmol/L)与4% HSA溶液混合均匀,37 ℃ 水浴作用2 h得蛋白结合IS溶液。将蛋白结合 IS溶液4 ℃预冷20 min,转入超滤膜为30 K的Amicon Ultra-15离心过滤器,4 ℃、3 500×g离心20 min,收集下层离心管中超滤液行高效液相色谱检测。计算蛋白结合IS溶液中IS的蛋白结合率。蛋白结合率=(1-超滤液峰面积/标准品峰面积)×100%。
1.2.2 CCK-8检测细胞增殖率收集对数生长期的THP-1细胞,1×105/mL,100 μL/孔接种于96孔板,完全培养基培养24 h。向培养板中加入不同浓度的游离IS(100、200、400、800 μmol/L)和蛋白结合IS(4% HSA+IS 100、200、400、800 μmol/L),游离组和蛋白结合组的对照分别加入等量的PBS和4% HSA溶液,同时设不含细胞只含完全培养基的空白调零组。每组设置3个复孔,每孔反应体系总体积为110 μL。培养24 h向每孔加入10 μL CCK-8溶液继续培养1.5 h,用酶标仪测定在450 nm处的光密度值[D(450)],实验重复3次。以空白调零组D(450)值均数调零,以平行孔的平均D(450)值作为各实验组的D(450)值,细胞增殖率=[实验组D(450)值-调零组D(450)值]/[对照组D(450)值-调零组D(450)值]×100%。
1.2.3 Transwell趋化实验后续实验分组:空白对照组(PBS溶液),阴性对照组(4% HSA溶液),游离IS组(IS 200 μmol/L),蛋白结合IS组(4% HSA+IS 200 μmol/L)。趋化实验采用Transwell小室模型,下室加入500 μL含10% FBS的RPMI1640完全培养基;收集无血清1640培养基孵育12 h的THP-1细胞,4×105/mL,每室200μL接种于上室,按实验分组孵育细胞24 h。取出小室,PBS棉球擦拭上室,4%多聚甲醛固定30 min,0.1%结晶紫染色20 min,PBS漂洗后倒置显微镜观察计数,随机取5个视野,取平均值为趋化细胞数。
1.2.4 ELISA法检测MCP-1浓度收集对数生长期的THP-1细胞,4×105/mL,2 mL/孔接种于6孔板,无血清1640培养基孵育12 h,按实验分组条件孵育24 h。收集各组THP-1细胞培养上清液,用稀释液将各组样品稀释10倍后,按ELISA试剂盒说明书进行实验,用多功能酶标仪测定450 nm处的光密度值及MCP-1浓度。
1.2.5 流式细胞术检测CCR2THP-1细胞在相应的实验条件下孵育24 h后,收集1×106个细胞加PBS定容至100 μL,分别向细胞悬液中加入PE标记的抗人CCR2抗体与相应的同型对照抗体5 μL,4 ℃避光孵育1.5 h,冷PBS洗涤2次,离心去上清,每管细胞加入2%多聚甲醛300 μL,流式细胞仪检测THP-1细胞表面CCR2的表达情况。
1.3 统计学分析采用SPSS 18.0统计软件,计量资料以x±s表示,多组间差异比较采用单因素方差分析,组间两两比较采用LSD检验(方差齐时)或采用Tamhane’s T2检验(方差不齐时)。两组间差异比较使用成组t检验。
2 结 果 2.1 蛋白结合硫酸吲哚酚的鉴定高效液相色谱法结果显示,不同浓度蛋白结合IS(4% HSA+IS 100、200、400、800 μmol/L)的蛋白结合率分别为88.5%,87.2%,90.8%和92.15%。与文献[2]中硫酸吲哚酚蛋白结合率约为90%相符,表明蛋白结合IS制备成功,可用于后续实验。图 1为4% HSA+IS 200 μmol/L浓度组的高效液相色谱图。
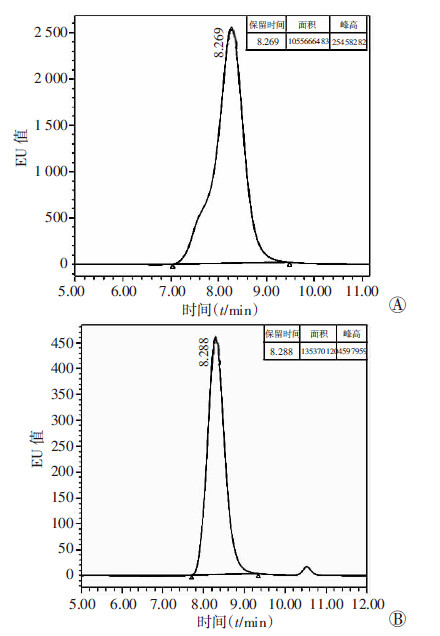 |
| A:硫酸吲哚酚标准品(IS 200 μmol/L);B:蛋白结合硫酸吲哚酚(4% HSA+IS 200 μmol/L)超滤液 图 1 高效液相色谱法检测IS的蛋白结合率 |
CCK-8结果(图 2)显示,游离IS组:与对照组比较,200、400、800 μmol/L浓度组细胞增殖出现不同程度抑制(P<0.05),但这3组间比较差异无统计学意义(P>0.05)。蛋白结合IS组:与对照组比较,200、400、800 μmol/L浓度组细胞增殖出现不同程度抑制(P<0.05),且随着药物浓度升高,细胞增殖抑制作用逐渐增强,呈浓度依赖性。同一浓度组间比较,蛋白结合IS对THP-1细胞的增殖抑制作用大于游离组(P<0.05)。根据CCK8结果,选取200 μmol/L作为后续实验浓度。
 |
| a:P<0.05,与0 μmol/L比较;b:P<0.05,与游离硫酸吲哚酚比较 图 2 硫酸吲哚酚对THP-1细胞的增殖抑制作用 |
Transwell趋化实验结果(图 3)显示,空白对照组(PBS溶液)穿膜细胞数为(14.4±7.5)个/视野;阴性对照组(4% HSA溶液)穿膜细胞数为(14.1±6.4)个/视野;游离IS组(IS 200 μmol/L)穿膜细胞数为(119.9±45.7)个/视野;蛋白结合IS组(4% HSA+IS 200 μmol/L)穿膜细胞数为(78.6±26.4)个/视野。空白对照组和阴性对照组之间差异无统计学意义(P>0.05);与两对照组比较,游离IS组和蛋白结合IS组趋化细胞数明显增多,且具有统计学差异(P<0.01);游离IS组趋化细胞数较蛋白结合IS组明显增多,差异有统计学意义(P<0.05)。说明IS可增强单核细胞的趋化活性,但蛋白结合IS增强单核细胞趋化的作用低于游离IS。
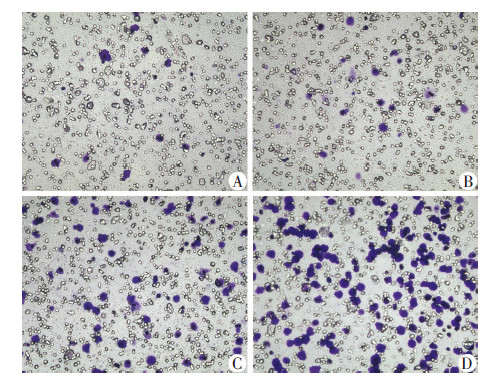 |
| A:空白对照组(PBS);B:阴性对照组(4% HSA);C:蛋白结合硫酸吲哚酚组(4% HSA+IS 200 μmol/L);D:游离IS组(IS 200 μmol/L) 图 3 硫酸吲哚酚对THP-1细胞趋化活性的影响 (结晶紫染色 ×200) |
ELISA检测结果显示,空白对照组和阴性对照组差异无统计学意义(P>0.05);与空白对照组比较,游离IS组MCP-1浓度明显升高,差异有统计学意义(P<0.05);与阴性对照组比较,游离IS组和蛋白结合IS组MCP-1浓度均明显升高,差异有统计学意义(P<0.05);游离IS组MCP-1浓度高于蛋白结合IS组,但差异无统计学意义。见表 1。
| (x±s) | ||
| 组别 | MCP-1(pg/mL) | CCR2(%) |
| 空白对照组(PBS) | 396.26±45.69 | 0.20±0.19 |
| 阴性对照组(4% HSA) | 358.80±38.33 | 0.13±0.07 |
| 游离IS组(IS 200 μmol/L) | 593.89±133.47 ab | 54.58±20.13 ab |
| 蛋白结合IS(4% HSA+IS 200 μmol/L)组 | 475.64±63.35 b | 21.65±2.17 abc |
| a: P<0.05,与空白对照组比较;b: P<0.05,与阴性对照组比较;c: P<0.05,与游离IS组比较 | ||
流式细胞仪检测THP-1细胞表面CCR2的表达,空白对照组和阴性对照组之间差异无统计学意义;与两对照组比较,游离IS组和蛋白结合IS组CCR2表达明显升高,差异有统计学意义(P<0.05);游离IS组CCR2表达阳性率高于蛋白结合IS组,差异具有统计学意义(P<0.05)。见表 1,图 4。
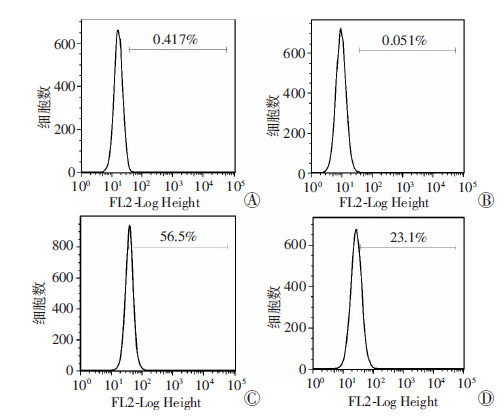 |
| A:空白对照组(PBS);B:阴性对照组(4% HSA);C:游离IS组(IS 200 μmol/L);D:蛋白结合IS组(4% HSA+IS 200 μmol/L) 图 4 流式细胞术检测THP-1细胞表面CCR2的表达 |
CKD患者体内IS蓄积,其血清浓度较健康人高43~88倍[1, 2]。循环中90%以上的IS与血浆白蛋白Sudlow site Ⅱ位点非共价结合,现有的透析手段难以将其清除[9, 10]。既往研究中,多以游离的IS进行体外实验,IS与血浆白蛋白结合后是否仍有 毒性尚不清楚。本研究参考欧洲尿毒素研究组(EUTox)建议[1, 2],以蛋白结合IS进行体外实验,更符合临床实际。
心血管事件和感染是CKD患者的主要死因。既往研究表明,IS可以通过损伤血管内皮细胞、促进血管平滑肌细胞增殖、诱导心肌细胞肥大等增加心血管事件的发生[11, 12, 13];通过使T细胞亚群分布异常、炎症细胞因子释放失调等增加CKD患者的感染风险[5, 14]。新近研究发现,IS可激活单核巨噬系统,使外周血中单核/巨噬细胞向损伤的血管内皮细胞迁移、黏附,促进血管炎症反应及组织因子释放,加速动脉粥样硬化和血栓形成[15, 16]。本课题组前期研究也发现,蛋白结合毒素可激活单核细胞,使促炎症细胞因子TNF-α释放增加,抑炎症细胞因子IL-10释放减少,从而导致炎症状态[17]。前述研究均提示IS可通过激活单核巨噬系统增加CKD患者心血管事件及其他炎症相关并发症的风险,但其具体机制尚不清楚。因此,本研究通过体外实验观察蛋白结合IS和游离IS对单核细胞趋化功能的影响,进一步揭示单核/巨噬细胞趋化功能的改变在CKD相关并发症中的作用。
既往研究发现,尿毒症患者体内平均IS浓度约为211 μmol/L[1]。本研究参考尿毒症患者体内平均IS浓度,以不同浓度的蛋白结合IS和游离IS进行实验,发现浓度为200 μmol/L的蛋白结合IS和游离IS均可抑制单核细胞增殖,提示CKD患者体内IS的蓄积可抑制单核细胞增殖,损伤单核细胞功能。同时,本研究发现蛋白结合IS对单核细胞的增殖抑制作用具有浓度依赖性,而游离组大于200 μmol/L的3组间比较差异无统计学意义;且同一浓度的蛋白结合IS对单核细胞的增殖抑制作用比游离IS更明显。表明蛋白结合IS和游离IS抑制单核细胞增殖的作用不同,可能为IS与白蛋白结合后理化性质改变,抑制细胞增殖毒性增强所致;但需考虑白蛋白是否对单核细胞有抑制作用(蛋白结合组加入4% HSA后胶体渗透压改变、实验所用白蛋白来自植物重组等),以及白蛋白所含共轭双键干扰光密度值的检测等因素,其具体原因有待于进一步研究。本研究选取接近尿毒症患者体内平均IS浓度的200 μmol/L浓度组进行后续实验。
本研究发现IS总浓度为200 μmol/L的蛋白结合IS和游离IS均可增强单核细胞的趋化功能,使单核细胞MCP-1及CCR2的表达上调。提示CKD患者体内 IS蓄积可激活单核细胞,使MCP-1表达上调,而MCP-1 可进一步诱导单核/巨噬细胞趋化和激活单核/巨噬细胞至炎症部位;单核细胞CCR2表达的上调,可增强单核细胞的趋化活性,使单核细胞向受损的血管内皮及其他炎症部位迁移。既往研究也发现MCP-1与CCR2结合后产生的细胞信号通路可促进外周血中单核细胞泡沫化,并向损伤的血管内皮细胞迁移、黏附,使粥样斑块发生炎症反应,加速动脉粥样硬化[8, 16],与本研究结果相一致。此外,本研究发现蛋白结合IS对单核细胞的趋化作用低于游离IS,可能是IS与白蛋白结合后诱导单核细胞趋化的毒性减小所致。本实验表明,IS与白蛋白结合后,对单核细胞仍有毒性,说明如果设法解离与白蛋白结合的IS并加以清除,可改善尿毒症患者的炎症状态,对降低心脑血管事件及感染等炎症相关并发症的发生有重要意义。
综上所述,蛋白结合IS可激活单核细胞,通过上调MCP-1及CCR2表达增强单核细胞的趋化活性,增加CKD患者发生动脉粥样硬化及其他炎症相关并发症的风险;如能清除体内与白蛋白结合的IS,对于改善CKD患者的长期预后,可能有益。
| [1] | Vanholder R, De-Smet R, Glorieux G, et al. Review on uremic toxins: classification, concentration, and interindividual variability[J]. Kidney Int, 2003, 63(5): 1934-1943. DOI: 10.1046/j.1523-1755.2003.00924.x |
| [2] | Duranton F, Cohen G, De-Smet R, et al. Normal and pathologic concentrations of uremic toxins [J]. J Am Soc Nephrol, 2012, 23(7): 1258-1270. DOI: 10.1681/ASN.2011121175 |
| [3] | Ito S, Yoshida M. Protein-bound uremic toxins: new culprits of cardiovascular events in chronic kidney disease patients [J]. Toxins (Basel), 2014, 6(2): 665-678. DOI: 10.3390/toxins6020665 |
| [4] | Ma Y X, Zhou L, Dong J, et al. Arterial stiffness and increased cardiovascular risk in chronic kidney disease[J]. Int Urol Nephrol, 2015, 47(7): 1157-1164. DOI: 10.1007/s11255-015-1009-x |
| [5] | Cohen G, Horl W H. Immune Dysfunction in Uremia-An Update[J]. Toxins (Basel), 2012, 4(11): 962-990. DOI: 10.3390/toxins4110962 |
| [6] | 梁新, 吴军, 韦杏雪, 等. 尿毒症血清蛋白对血管内皮细胞的损伤作用[J]. 第三军医大学学报, 2014, 36(24): 2485-2488. |
| [7] | Matsuo K, Yamamoto S, Wakamatsu T, et al. Increased proinflammatory cytokine production and decreased cholesterol efflux due to downregulation of ABCG1 in macrophages exposed to indoxyl sulfate[J]. Toxins (Basel), 2015, 7(8): 3155-3166. DOI: 10.3390/toxins7083155 |
| [8] | Trojanowicz B, Ulrich C, Seibert E, et al. Uremic conditions drive human monocytes to pro-atherogenic differentiation via an angiotensin-dependent mechanism [J]. PLoS One, 2014, 9(7): e102137. DOI: 10.1371/journal.pone.0102137 |
| [9] | Vaholder R, Schepers E, Pletinck A, et al. An update on protein-bound uremic retention solutes[J]. J Ren Nutr, 2012, 22(1): 90-94. DOI: 10.1053/j.jrn.2011.10.026 |
| [10] | Watanabe H, Noguchi T, Miyamoto Y, et al. Interaction between two sulfate-conjugated uremic toxins, p-cresyl sulfate and indoxyl sulfate, during binding with human serum albumin[J]. Drug Metab Dispos, 2012, 40(7): 1423-1428. DOI: 10.1124/dmd.112.045617 |
| [11] | Yu M, Kim Y J, Kang D H. Indoxyl sulfate-induced endothelial dysfunction in patients with chronic kidney disease via an induction of oxidative stress[J]. Clin J Am Soc Nephrol, 2011, 6(1): 30-39. DOI: 10.2215/CJN.05340610 |
| [12] | Mozar A, Louvet L, Morliere P, et al. Uremic toxin indoxyl sulfate inhibits human vascular smooth muscle cell proliferation[J]. Ther Apher Dial, 2011, 15(2): 135-139. DOI: 10.1111/j.1744-9987.2010.00885.x |
| [13] | Cerasola G, Nardi E, Palermo A, et al. Epidemiology and pathophysiology of left ventricular abnormalities in chronic kidney disease: a review [J]. J Nephrol, 2011, 24(1): 1-10. DOI: 10.5301/JN.2010.2030 |
| [14] | Meijers R W, Betjes M G, Baan C C, et al. T-cell ageing in end-stage renal disease patients: Assessment and clinical relevance[J]. World J Nephrol, 2014, 3(4): 268-276. DOI: 10.5527/wjn.v3.i4.268 |
| [15] | Capasso R, Sambri I, Cimmino A, et al. Homocysteinylated albumin promotes increased monocyte-endothelial cell adhesion and up-regulation of MCP1, Hsp60 and ADAM17[J]. PLoS One, 2012, 7(2): e31388. DOI: 10.1371/journal.pone.0031388 |
| [16] | Akdogan M F, Azak A, Denizli N, et al. MCP-1 and soluble TWEAK levels are independently associated with coronary artery disease severity in patients with chronic kidney disease[J]. Ren Fail, 2015, 37(8): 1297-1302. DOI: 10.3109/0886022X.2015.1065428 |
| [17] | 丁瑜, 王建, 梁新, 等. 尿毒症毒素对甲酚对单核细胞体外释放炎症因子的影响[J]. 解放军医学杂志, 2015, 40(1): 35-39. DOI: 10.11855/j.issn.0577-7402.2015.01.08 |



