脓毒症是临床常见重症[1, 2, 3]。血管渗漏是脓毒症的基本病理生理变化之一,其主要原因是血管内皮细胞受损,血管内大分子物质如蛋白质、脂质等大量渗出至组织器官,引起多器官功能障碍甚至衰竭,最终导致患者死亡[4]。目前针对血管渗漏的治疗措施,如纠正酸中毒、使用糖皮质激素等有一定作用,但治疗效果依然不佳[5]。因此阐明脓毒症血管渗漏的发生机制,寻找针对性治疗靶点有重要的临床意义。微粒(microparticle,MP)是细胞凋亡或受到刺激后分泌的微小膜性结构[6],直径为0.1~1 μm,几乎所有细胞可分泌。MP膜表面可表达母细胞表面抗原,同时可携带多种生物活性分子,如蛋白质、DNA、RNA等[7]。MP在多种疾病如动脉粥样硬化、心肌炎、急性肺损伤、慢性肾炎等的发生、发展过程中均有作用[8, 9]。既往研究结果显示,脓毒症时血管内皮细胞微粒(endothelial microparticles,EMP)、血小板微粒(platelet microparticles,PMP)及中性粒细胞微粒(neutrophilic granulocyte microparticles,NMP)含量明显增高。基础研究证实EMP与血管内皮功能关系最为密切,EMP可通过调节一氧化氮、内皮型一氧化氮合酶、活性氧簇等来影响内皮功能[10, 11],参与炎症、凝血等多种病理生理过程,但EMP是否在脓毒症血管渗漏中发挥重要作用及其是否与血管内皮细胞间紧密连接有关,目前尚不清楚。本研究采用盲肠结扎穿孔术(cecal ligation and puncture,CLP)复制脓毒症大鼠模型,观察脓毒症大鼠血液中MP变化及与血管渗漏的关系,检测不同细胞来源MP对血管渗漏的影响,明确MP及血管内皮细胞来源MP在脓毒症血管渗漏中的作用并初步了解其机制。
1 材料与方法 1.1 实验动物及主要试剂成年SD大鼠150只,雌雄各半,体质量(200±20)g,由第三军医大学大坪医院野战外科研究所实验动物中心提供。ECM内皮细胞培养基购自美国Scicell公司,FITC标记牛血清白蛋白(FITC-BSA)购自Sigma-Aldrich公司,ZO-1兔抗大鼠抗体、β-actin山羊抗大鼠抗体购自美国Life technologies公司,PE-Annexin V购自美国BD公司,FITC标记绿色荧光二抗、DAPI购自中国北京中杉金桥公司,驴抗山羊IRDye 800CW二抗、山羊抗兔IRDye 800CW二抗购自美国Odyssey公司,中性粒细胞提取试剂盒购自中国灏洋生物公司,Transwell 6孔培养板购自美国Costar公司,EVOM2细胞跨膜电阻测定仪购自美国World Precision Instruments公司。
1.2 脓毒症大鼠模型制备、细胞准备及微粒收集 1.2.1 脓毒症模型制备大鼠术前禁食12 h,自由饮水,戊巴比妥钠(30 mg/kg)腹腔注射麻醉后,无菌条件下开腹暴露盲肠,将粪便集中至盲肠末端,距末端约0.7 cm处丝线结扎,用锥形器在盲肠末端贯通穿刺,将盲肠复位后逐层缝合伤口,腹腔注射生理盐水5 mL,放回笼子正常饲养。
1.2.2 肺静脉内皮细胞、血小板、中性粒细胞制备及肺静脉内皮细胞制备大鼠戊巴比妥钠(30 mg/kg) 腹腔注射麻醉后剪开胸腔,分离出双侧下叶肺静脉,纵向剖开后无菌PBS洗涤5~6次,将肺静脉内面贴于培养瓶中,培养3 d后所得细胞即肺静脉内皮细胞[12],取3~5代的细胞进行后续实验。血小板制备:采集正常SD大鼠血液,200×g离心15 min,去除血细胞,取上清1 200×g离心15 min,沉淀即为血小板,使用PBS洗涤1次,加入培养基后培养备用[13]。中性粒细胞制备:采集正常SD大鼠血液,参照中性粒细胞提取试剂盒方法制备。
1.2.3 MP收集与鉴定细胞培养基中MP收集:收集MP前,使用浓度为100 ng/mL LPS处理细胞诱导MP产生。LPS孵育24 h后,收集培养基上清,500×g离 心20 min,以去除残余细胞,取上清2 000×g离心20 min,以去除细胞碎片,取上清20 000×g离心50 min,沉淀即为MP,使用PBS洗涤1次,100 μL PBS重悬,蛋白定量后置于-70 ℃保存备用[14, 15]。血液中MP收集:采集大鼠血液,500×g离心20 min,去除血中红细胞及白细胞,取上层血清继续离心,余步骤同细胞培养基中MP收集。MP流式鉴定:取MP样本加入5 μL PE-Annexin V抗体,避光孵育15 min后洗涤1次,加入100 μL Annexin V binding buffer(同型对照组不加binding buffer)后上机检测,Annexin V阳性结果即为MP[16]。MP透射电镜鉴定:取MP样本加至铜网状栅中,1 min后滤纸吸干,4%戊二醛固定1 min,PBS洗涤后使用2%磷钨酸钠固定,PBS洗涤后室温晾干后即可上机检测[17]。
1.3 实验方案 1.3.1 脓毒症大鼠肺、肾、肠血管通透性及MP含量变化取64只SD大鼠分为4组(每组16只):正常对照组、脓毒症2 h组、脓毒症8 h组、脓毒症16 h组。其中32只大鼠(每组8只)用于检测血管通透性变化,32只大鼠(每组8只)用于收集血液中MP并检测含量变化。血管通透性测定:分别取正常及CLP后2、8、16 h大鼠,正常大鼠以30 mg/kg戊巴比妥钠腹腔注射麻醉,CLP大鼠以15 mg/kg戊巴比妥钠腹腔注射麻醉,颈静脉插管后注射FITC-BSA(9 mg/kg),2 h后剪开腹部,髂动脉分叉上端结扎腹主静脉,剪破腹主动脉,从颈静脉缓慢推注生理盐水(约50 mL)灌注组织器官,直至肺、肾、肠均变白后处死大鼠,取左肺上叶、左肾、空肠(约5 cm),称量剪碎,匀浆后离心取上清液,使用荧光分光光度计测定组织上清液荧光光密度值,制作标准曲线后计算上清液中FITC-BSA浓度,使用多功能酶标仪测定上清液光密度值并计算上清液中总蛋白浓度,以组织上清液中FITC-BSA浓度与总蛋白浓度比值作为该组织血管通透性测定值。MP含量测定:采集正常及CLP后不同时相点大鼠血液,按照1.2.3 中方法收集血液中MP,使用多功能酶标仪测定光密度值,制作标准曲线后计算MP蛋白浓度,以蛋白浓度值反映血液中MP含量。
1.3.2 脓毒症大鼠来源MP对大鼠血管通透性的影响取20只大鼠制备CLP模型,16 h后采集CLP大鼠血液,按照1.3.1方法收集MP备用。取16只大鼠分为2组(每组8只):正常对照组、MP组。正常大鼠以30 mg/kg戊巴比妥钠腹腔注射麻醉,CLP大鼠以15 mg/kg 戊巴比妥钠腹腔注射麻醉,颈静脉插管后MP组给予0.6 mg/kg收集的MP,正常对照组给予同等容积PBS,2 h后按照1.3.1方法测定肺、肾、肠血管通透性。
1.3.3 EMP、PMP、NMP对大鼠肺血管通透性的影响取已制备好的肺静脉内皮细胞、血小板和中性粒细胞,用100 ng/mL LPS孵育24 h,按1.2.3中方法分别收集EMP、PMP和NMP备用。取32只大鼠分为4组(每组8只):正常对照组、EMP处理组、PMP处理组、NMP处理组。正常大鼠以30 mg/kg戊巴比妥钠腹腔注射麻醉,CLP大鼠以15 mg/kg戊巴比妥钠腹腔注射麻醉,颈静脉插管后EMP、PMP、NMP处理组分别给予0.6 mg/kg 的EMP、PMP和NMP,正常对照组给予同等容积PBS,2 h后按1.3.1中方法测定肺血管通透性。
1.3.4 EMP对单层肺静脉内皮细胞跨膜电阻的影响取3~5代的肺静脉内皮细胞消化接种至6孔Transwell 培养板上腔,1×105/孔,细胞长至80%融合后使用100 ng/mL LPS及收集的EMP(20 μg/mL)刺激单层肺静脉内皮细胞,24 h后测定单层内皮细胞跨膜电阻值,具体方法参照EVOM2操作说明书进行,设置不接种细胞的孔为空白对照,细胞跨膜电阻值=(实测电阻值-空白电阻值)×Transwell有效膜面积,单位为Ω·cm2。
1.3.5 免疫荧光法检测EMP对肺静脉内皮细胞紧密连接蛋白ZO-1表达的影响另取3~5代的肺静脉内皮细胞消化接种至激光共聚焦培养皿,1×105/孔,细胞长至80%融合后分别使用100 ng/mL LPS、20 μg/mL EMP刺激,24 h后使用4%多聚甲醛固定15 min,0.2%Triton破膜1 min,0.2% BSA封闭1 h,兔抗大鼠ZO-1抗体(1 :100稀释)4 ℃过夜,羊抗兔FITC标记二抗(1 :100稀释)室温避光孵育1 h,DAPI避光孵育5 min,使用激光共聚焦显微镜观察,ZO-1呈绿色。使用Image J软件分析荧光条带,以光密度/面积值(即单位面积平均光密度)反映ZO-1蛋白表达量。
1.3.6 Western blot检测EMP对肺静脉内皮细胞紧密连接ZO-1表达的影响取3~5代肺静脉内皮细胞,长至80%融合后使用100 ng/mL LPS、20 μg/mL EMP刺激,24 h后收集各组细胞,提取总蛋白,BCA检测蛋白浓度,取等量蛋白(20 μg)电泳跑胶,将目的蛋白转至PVDF膜,5%脱脂奶粉封闭2 h,加入山羊抗大鼠β-actin抗体(1 :800稀释)、兔抗大鼠ZO-1抗体(1 :600 稀释)4 ℃过夜,分别使用驴抗山羊IRDye 800CW二抗、山羊抗兔IRDye 800CW二抗室温孵育1 h,洗膜3次后使用Odyssey Clx红外成像仪扫描成像,条带使用Image J软件分析,以ZO-1平均光密度/β-actin平均光密度反映ZO-1蛋白表达量。检测PMP、NMP对ZO-1表达影响时,PMP、NMP浓度均与EMP浓度相同,提取总蛋白后检测各组ZO-1表达。
1.4 统计学方法计量资料以x±s表示,采用SPSS 17.0统计软件,对肺、肾、肠血管通透性比值,MP浓度,单层肺静脉内皮细胞跨膜电阻值,ZO-1单位面积平均光密度值进行t检验,P<0.05为差异有统计学意义。
2 结果 2.1 脓毒症大鼠肺、肾、肠血管通透性及血液中MP含量变化脓毒症大鼠不同时相点肺、肾、肠血管通透性均明显增加(P<0.05),2、8、16 h肺血管通透性比值增加率分别为20.83%、57.13%、66.09%,肾血管通透性比值增加率分别为39.36%、70.51%、100.65%,肠血管通透性比值增加率分别为23.10%、54.16%、72.53%(图 1A~C)。使用流式细胞仪及透射电镜检测脓毒症大鼠血液中收集的MP。流式细胞仪检测结果显示,所收集颗粒Annexin V阳性比例为87.9%,即大部分颗粒表面均表达MP膜表面共有抗原磷酯酰丝氨酸,提示所收集颗粒为MP(图 2A、B);透射电镜结果显示颗粒结构完整,直径0.1~1 μm,且具有双层分子膜,提示所收集颗粒为MP(图 2C)。脓毒症大鼠不同 时相点血液中MP含量明显增加(P<0.05),2、8、16 h 增加率分别为16.77%、37.81%、43.42%(图 1D),微粒与血管通透性变化趋势一致,提示可能在血管通透性调节中发挥一定作用。
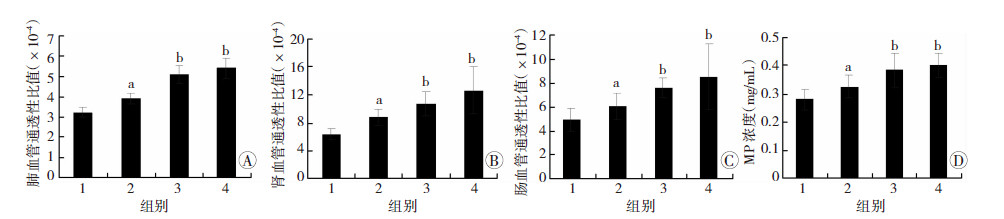 |
| 1:正常对照组;2~4:分别为脓毒症组2、8、16 h a:P<0.05,b:P<0.01,与正常对照组比较 A~C:脓毒症大鼠不同时相点肺、肾、肠血管通透性变化;D:脓毒症大鼠不同时相点MP浓度变化 图 1 脓毒症大鼠血管通透性及MP含量变化 |
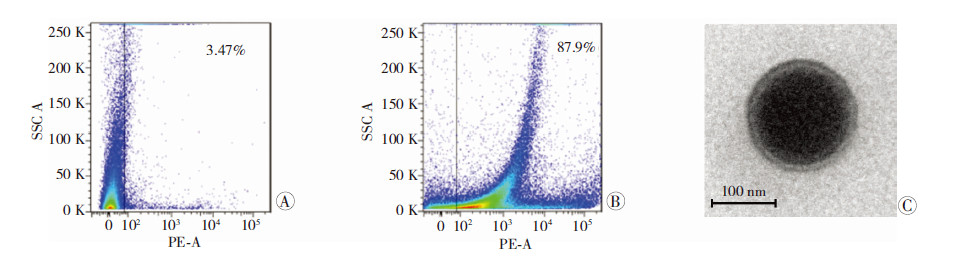 |
| A:PE-Annexin V同型对照;B:PE-Annexin V阳性标记;C:透射电镜检测MP 图 2 MP流式细胞术及电镜鉴定结果 |
收集脓毒症大鼠血液中MP作用于正常大鼠,发现MP刺激的正常大鼠血管通透性显著增加(P<0.01),肺、肾、肠血管通透性增加率分别为56.81%、37.74%、37.67%,肺血管通透性增加最为明显(图 3A~C)。进一步研究发现,EMP可以显著增加肺血管通透性(P<0.05),增加率为21.36%;同等剂量下PMP、NMP对肺血管通透性无明显作用(图 3D)。这说明EMP在脓毒症大鼠血管渗漏中发挥重要作用。
 |
| a:P<0.05,b:P<0.01,与正常对照组比较 A~C:分别为脓毒症大鼠血液中MP对正常大鼠肺、肾、肠血管通透性的影响1:正常对照组;2:MP组;D:不同来源MP对大鼠肺血管通透性的影响 1:正常对照组;2:EMP处理组;3:NMP处理组;4:PMP处理组 图 3 MP对大鼠血管通透性的影响 |
分别使用LPS及EMP作用于正常肺静脉内皮细 胞,发现LPS及EMP均能显著增加肺静脉内皮细胞的通透性,表现为内皮细胞跨膜电阻明显降低(P<0.01),降低率分别为66.16%、44.27%(图 4)。LPS及EMP可以明显降低肺静脉内皮细胞间ZO-1的表达(图 5),运用Image J软件进行荧光阳性灶平均光密度分析比较发现,正常对照组ZO-1平均光密度为(0.031 5±0.000 9),LPS处理组平均光密度为(0.019 5±0.002 7),EMP处理组平均光密度为(0.026 9±0.001 8),LPS处理组及EMP处理组与正常对照组相比,ZO-1表达均明显降低(P<0.05)。Western blot检测结果显示,LPS及EMP可以明显降低肺静脉内皮细胞中ZO-1的表达(P<0.05,图 6),而 同等剂量下PMP及NMP对ZO-1表达无明显影响(P>0.05,图 7)。
 |
| a: P<0.01,与正常对照组比较 1:正常对照组;2:LPS处理组;3:EMP处理组 图 4 LPS及EMP对肺静脉内皮细胞跨膜电阻值的影响 |
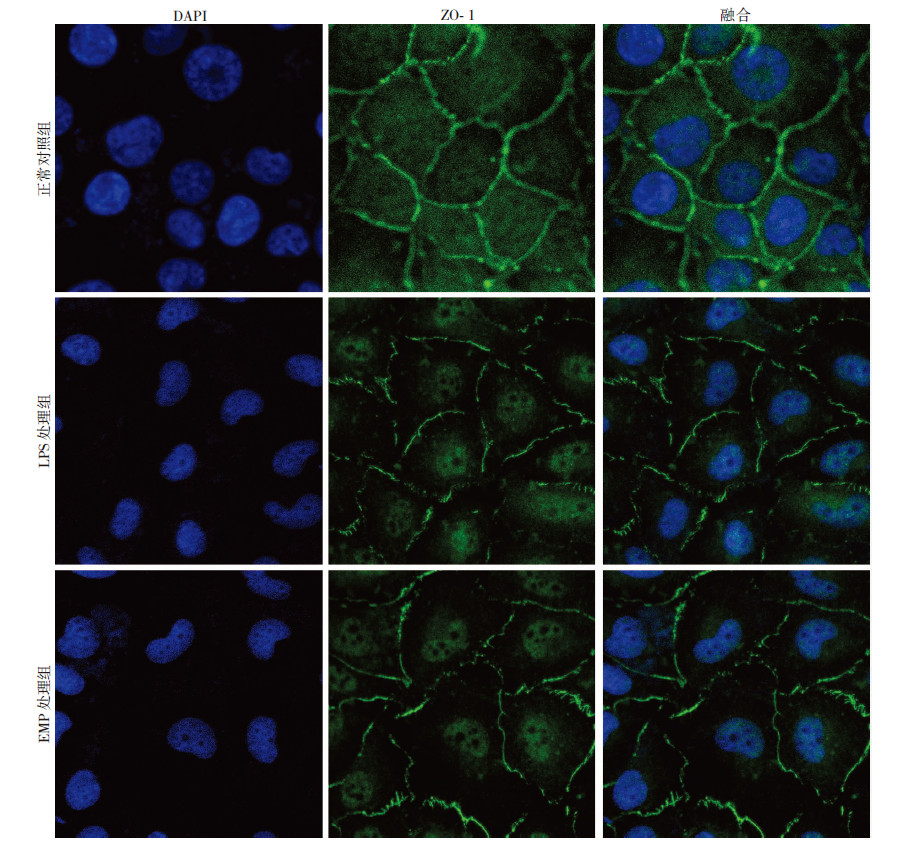 |
| 图 5 LPS及EMP对肺静脉内皮细胞ZO-1表达的影响 (激光共聚焦显微镜 ×400) |
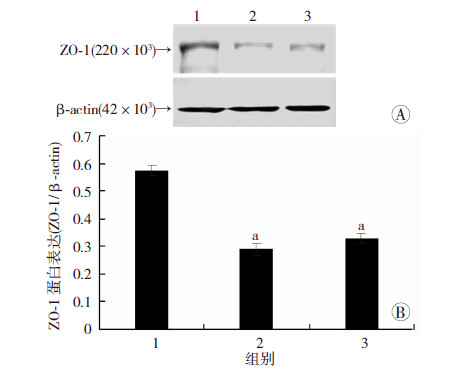 |
| 1:正常对照组;2:LPS处理组;3:EMP处理组A:Western blot检测结果;B:半定量分析结果 a: P<0.05,与正常对照组比较; 图 6 LPS、EMP对肺静脉内皮细胞ZO-1表达的影响 |
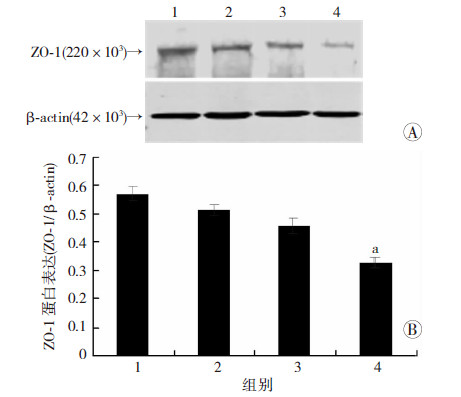 |
| 1:正常对照组;2:PMP处理组;3:NMP处理组;4:EMP处理组A:Western blot检测结果;B:半定量分析结果 a: P<0.05,与正常对照组比较 图 7 PMP、NMP、EMP对肺静脉内皮细胞ZO-1表达的影响 |
MP是细胞受到各种刺激后如激活或者凋亡时产生的膜性结构,可以在多种疾病如动脉粥样硬化、急性冠脉综合征、慢性肾炎、急性肺损伤、代谢综合征、脓毒症等发展过程中发挥重要作用,与其广泛参与到炎症、凝血、纤溶等病理生理过程密切相关。Tesse等[18]发现,MP可以通过激活转录因子NF-κB引起平滑肌细胞iNOS及COX-2合成增加,诱导NO及前列环素产生增加,导致血管低反应性。Nieuwland等[19]证实,脓毒症后MP具有促凝特性,在体内可以通过组织因子——Ⅶa因子途径启动凝血过程,诱导弥散性血管内凝血的发生,加重机体损伤。Brodsky等[11]发现,EMP可以通过增加内皮细胞超氧阴离子水平,激活氧化应激,降低NO表达,影响血管舒缩功能,加重内皮功能障碍。
血管渗漏是脓毒症重要的病理生理改变,脓毒症后机体在炎症刺激下释放大量炎症因子,促进氧自由基生成,引起内皮损伤,使内皮屏障功能减弱,血液内细胞、大分子可以异常透过内皮屏障引起器官功能障碍。研究已证实MP可在内皮功能调节中起到重要作用,而MP是否参与脓毒症后血管渗漏的调节尚不清楚。本实验结果显示,脓毒症大鼠2、8、16 h肺、肾、肠血管通透性及血液中MP含量均显著增加,随时间变化增加更为明显,且两者变化呈正相关关系。Pankoui-Mfonkeu等[16]发现在脑型疟疾中,PMP含量与疾病严重程度呈正相关,可与发热退散时间、Blantyre昏迷评分等一起作为反映昏迷程度的指标,结合本实验结果,我们认为MP含量也可以作为一种潜在指标反映内皮损伤程度,对判断脓毒症严重程度有一定的参考意义。收集脓毒症大鼠血液中MP作用于正常大鼠后,可以显著增加正常大鼠肺、肾、肠血管通透性;使用不同细胞来源MP作用于正常大鼠后,发现EMP可以显著增加肺血管通透性,而同等剂量PMP、NMP则对大鼠肺血管通透性无明显作用。此外,EMP还可以增加肺静脉内皮细胞通透性,在细胞水平上验证了其对血管渗漏的影响。综上所述,MP可在脓毒症大鼠血管渗漏中发挥重要作用,且对肺血管渗漏影响尤为显著,本研究进一步发现,脓毒症来源MP中在大鼠血管渗漏调节起到主要作用的是EMP,EMP还能显著增加肺静脉内皮细胞渗漏。
血管渗漏的发生机制主要包括跨细胞途径及细胞旁途径两种。跨细胞途径主要通过影响小囊液泡器、窗孔、小凹(caveolae)等结构实现,脓毒症后小囊液泡器表达增加,窗孔孔径增大,使大分子物质透过明显增加,加重组织水肿与内皮损伤。细胞旁途径主要通过影响细胞间连接如紧密连接、粘附连接实现,脓毒症后,机体产生的大量炎性因子及活性氧可以破坏细胞连接,使ZO-1、Claudin-5等连接分子降解,细胞间隙增大,内皮完整性受到破坏,导致血管严重渗漏。本研究发现EMP可通过作用于细胞间紧密连接ZO-1降低其表达来实现对血管渗漏的调节,但EMP如何调节ZO-1,以及EMP对其他紧密连接蛋白有无调节作用均需要进一步研究。Fu等[20]发现,心脏瓣膜病患者循环中MP可以明显抑制Akt及eNOS磷酸化,显著增加caveolin-1表达,减少NO产生,影响血管收缩。caveolin-1是跨细胞途径中小凹的重要组成蛋白,因此我们推测EMP也可能通过影响跨细胞途径调节血管渗漏,但其有无调节作用及具体机制仍有待进一步研究。
| [1] | ARISE Investigators; ANZICS Clinical Trials Group, Peake SL,Delaney A, et al. Goal-directed resuscitation for patients with early septic shock[J].N Engl J Med, 2014, 371(16): 1496-1506.DOI: 10.1056/NEJMoa1404380 |
| [2] | Jawad I, Luksic I, Rafnsson S B. Assessing available information on the burden of sepsis: global estimates of incidence,prevalence and mortality[J]. J Glob Health,2012, 2(1):010404.DOI: 10.7189/jogh.02.010404 |
| [3] | 姚咏明, 栾樱译. 外科脓毒症免疫功能障碍的监测与调理策略[J]. 中华消化外科杂志, 2014, 13(7): 516-519. DOI:10.3760/cma.j.issn.1673-9752.2014.07 .005 |
| [4] | Armstrong S M, Mubareka S, Lee W L. The lung microvascular endothelium as a therapeutic target in severe influenza[J]. Antiviral Res, 2013, 99(2): 113-118.DOI: 10.1016/j.antiviral.2013.05.003 |
| [5] | Cohen J, Opal S, Calandra T. Sepsis studies need new direction[J]. Lancet Infect Dis,2012, 12(7): 503-505.DOI: 10.1016/S1473-3099(12)70136-6 |
| [6] | Morel O, Jesel L, Freyssinet J M, et al. Cellular mechanisms underlying the formation of circulating microparticles[J]. Arterioscler Thromb Vasc Biol,2011, 31(1): 15-26.DOI: 10.1161/ATVBAHA.109.200956 |
| [7] | Meziani F, Delabranche X, Asfar P, et al. Bench-to-bedside review: circulating microparticles-a new player in sepsis?[J]. Crit Care, 2010, 14(5): 236.DOI: 10.1186/cc9231 |
| [8] | Distler J H, Huber L C, Gay S, et al. Microparticles as mediators of cellular cross-talk in inflammatory disease[J]. Autoimmunity, 2006, 39(8): 683-690. |
| [9] | Sinauridze E I, Kireev D A, Popenko N Y, et al. Platelet microparticle membranes have 50- to 100-fold higher specific procoagulant activity than activated platelets[J]. Thromb Haemost, 2007, 97(3): 425-434. |
| [10] | Werner N, Wassmann S, Ahlers P, et al. Circulating CD31+/annexin V+ apoptotic microparticles correlate with coronary endothelial function in patients with coronary artery disease[J]. Arterioscler Thromb Vasc Biol, 2006, 26(1): 112-116. |
| [11] | Brodsky S V, Zhang F, Nasjletti A, et al. Endothelium-derived microparticles impair endothelial function in vitro[J]. Am J Physiol Heart Circ Physiol, 2004, 286(5): H1910-H1915. |
| [12] | Yang G, Xu J, Li T, et al. Role of V1a receptor in AVP-induced restoration of vascular hyporeactivity and its relationship to MLCP-MLC20 phosphorylation pathway[J]. J Surg Res, 2010, 161(2): 312-320.DOI: 10.1016/j.jss.2009.01.005 |
| [13] | 刘成萨,邱悦,周馨茹.两种不同方法制备浓缩血小板的比较[J].实用医技杂志, 2012, 19(4): 391-392. |
| [14] | Jansen F, Yang X, Hoelscher M, et al. Endothelial microparticle-mediated transfer of MicroRNA-126 promotes vascular endothelial cell repair via SPRED1 and is abrogated in glucose-damaged endothelial microparticles[J]. Circulation,2013, 128(18): 2026-2038.DOI: 10.1161/CIRCULATIONAHA.113.001720 |
| [15] | Dinkla S, Brock R, Joosten I, et al. Gateway to understanding microparticles: standardized isolation and identification of plasma membrane-derived vesicles[J]. Nanomedicine(Lond), 2013, 8(10): 1657-1668. DOI: 10.2217/nnm.13.149 |
| [16] | Pankoui-Mfonkeu J B, Gouado I, Fotso-Kuate H, et al. Elevated cell-specific microparticles are a biological marker for cerebral dysfunctions in human severe malaria[J]. PLoS One, 2010, 5(10): e13415. DOI: 10.1371/journal.pone.0013415 |
| [17] | Zhang Y, Liu D, Chen X, et al. Secreted monocytic miR-150 enhances targeted endothelial cell migration[J]. MolCell, 2010, 39(1): 133-144.DOI: 10.1016/j.molcel.2010.06.010 |
| [18] | Tesse A, Martinez MC,Hugel B, et al. Upregulation of proinflammatory proteins through NF-kappaB pathway by shed membrane microparticles results in vascular hyporeactivity[J]. Arterioscler Thromb Vasc Biol, 2005, 25(12): 2522-2527. |
| [19] | Nieuwland R, Berckmans R J, McGregor S, et al. Cellular origin and procoagulant properties of microparticles in meningococcal sepsis[J]. Blood, 2000, 95(3): 930-935. |
| [20] | Fu L, Hu X X, Lin Z B, et al. Circulating microparticles from patients with valvular heart disease and cardiac surgery inhibit endothelium-dependent vasodilation[J]. J Thorac Cardiovasc Surg, 2015, 150(3): 666-672. DOI: 10.1016/j.jtcvs.2015.05.069 |



