2.400038 重庆,第三军医大学西南医院全军临床病理学研究所
2.Institute of Pathology, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
脓毒症是由严重感染引起的全身炎症反应综合征,是机体受病原刺激后诱发的一种失控性免疫反应[1]。既往研究表明,革兰阴性菌是引发这种高致死性疾病的主要病原分子,其细胞壁上的脂多糖(lipopolysaccharide,LPS)能激活宿主免疫细胞上的Toll样受体-4(toll like receptor-4,TLR-4)跨膜信号通路,释放炎症介质[2, 3]。大量炎症介质的过度释放是导致脓毒症患者多器官功能衰竭甚至死亡的主要原因[4, 5]。在调控TLR-4跨膜信号通路的诸多种信号蛋白/受体中,髓样分化蛋白-2(myeloid differentiation protein-2,MD-2)被认为是活化该通路所必需的受体分子,在其中发挥着不可或缺的作用[2, 6]。因此,在防治脓毒症研究中,MD-2是一个非常关键的拮抗靶点[6]。我们基于MD-2结构与功能的关系设计构建了1条模拟肽(MD-2 mimetic peptide,MDMP),并经体内外实验证实MDMP能明显抑制LPS诱导的过度炎症反应[7]。但MDMP是否同样能抑制革兰阴性菌感染引起的炎症反应,以及是否影响巨噬细胞对革兰阴性菌的吞噬作用尚不清楚。因此,本实验拟通过构建表达增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的大肠杆菌EGFP-BL21,观察MDMP对RAW264.7细胞吞噬EGFP-BL21的影响,并探讨该过程中炎症因子TNF-α和IL-6分泌水平的变化,以期进一步阐释MDMP的抗炎作用机制。
1 材料与方法 1.1 材料模板质粒pEGFP-C3购自Clontech公司;E.coli DH5α、表达菌BL21(DE3)PLysS和表达载体pET-32a(+)购自Novagen公司;质粒小样快速提取试剂盒和DNA胶回收试剂盒购自Omega公司;2×PCR Solution Premix PrimeSTAR HS、100 bp DNA Ladder Marker、λ-HindⅢ digest DNA标准、限制性内切酶HindⅢ和BamHⅠ、T4 DNA连接酶,均购自TaKaRa公司;MDMP由钟鼎生物采用FMOC固相合成法合成;RAW264.7细胞购自上海细胞库;DMEM培养基、胎牛血清均购自Gibco公司;异丙基硫代半乳糖苷(IPTG)购自Solarbio公司;氨苄青霉素、4S green核酸染色剂、琼脂糖和PCR引物合成均由上海生工生物工程有限公司提供;TNF-α和IL-6 ELISA试剂盒购自欣博盛生物科技有限公司。
1.2 方法 1.2.1 EGFP基因的扩增通过检索GenBank数据库中pEGFP-C3质粒的基因序列,用Primer Premier 5.0软件设计引物扩增EGFP的编码序列。引物上游:5′-GAAGGATCCATGGTGAGCAAGGGCG-3′;下游:5′-CCTAAGCTTCTTGTACAGCTCGTCCA-3′。在上游引物5′端加入BamHⅠ限制性酶切位点和3个保护碱基,下游引物5′端加入HindⅢ限制性酶切位点和3个保护碱基,拟扩增序列长度为735 bp。取2×PCR Solution Premix PrimeSTAR HS 25 μL,pEGFP-C3质粒2 μL,上、下游引物(10 nmol/μL)各1.5 μL,最后用20 μL无菌水将反应液总体积调至50 μL,混匀,置PCR仪中进行扩增;反应条件为:94 ℃预变性2 min,94 ℃变性45 s,65 ℃退火30 s,72 ℃延伸45 s,35个循环,再于72 ℃延伸5 min。扩增产物经1.0%琼脂糖凝胶电泳验证。
1.2.2 原核表达载体pET-32a(+)-EGFP的构建、酶切鉴定及序列测定将经DNA胶回收试剂盒纯化后的PCR产物与pET-32a(+)载体同时用BamHⅠ和HindⅢ进行双酶切,对酶切产物进行纯化,T4 DNA连接酶16 ℃反应过夜,即得到pET-32a(+)-EGFP重组质粒。然后以热休克法将重组质粒转化至感受态E.coli DH5α中,用含氨苄青霉素的LB平板筛选出阳性克隆,扩增后提取质粒,PCR进行鉴定并将产物送往上海Invitrogen公司测序。
另以空白质粒pET-32a(+)为对照,用限制性内切酶BamHⅠ对重组质粒pET-32a(+)-EGFP进行酶切鉴定,酶切反应体系为20 μL,反应时间为3 h,然后经1.0%琼脂糖凝胶电泳观察酶切结果。
1.2.3 EGFP基因的原核表达和检测将测序正确的pET-32a(+)-EGFP质粒转化至感受态E.coli BL21(DE3)PLysS中,用含氨苄青霉素的平板筛选阳性克隆,接种到LB液体培养基中扩大培养,培养2 h后加入IPTG(1.0 mmol/L)进行诱导,再培 养10 h后收获细菌。提前在6孔板中接种5×105/孔RAW264.7 细胞,过夜培养后以不含血清的DMEM培养基饥饿细胞2 h。另外,取1 mL菌液于5 000 r/min离心5 min,沉淀以灭菌PBS洗涤2遍后用含2%胎牛血清(FBS)在37 ℃水浴中调理30 min备用。最后,以加入空白菌BL21(DE3)PLysS作为对照,实验组中加入感染复数(multiplicity of infection,MOI)=50调理过的重组菌液,用激光共聚焦观察吞噬10、20 min和30 min后细胞中的绿色荧光的变化情况,流式细胞术检测吞噬的荧光强度和阳性细胞比率。
1.2.4 流式细胞术检测MDMP对RAW264.7细胞吞噬革兰阴性菌的影响在6孔板中接种5×105/孔RAW264.7细胞,过夜培养后以DMEM培养基换液;根据MDMP浓度将实验分为0(阳性对照)、1.0、10、100 μg/mL 4组,再加上空白组(不加细菌)共5组。提前将革兰阴性菌(MOI=50)与MDMP于37 ℃预孵育30 min后以2%FBS调理,加入6孔板中,空白组加入相同体积的PBS;37 ℃,5%CO2孵箱中吞噬30 min后以PBS洗去未吞噬细菌,胰酶消化后1 000 r/min离心5 min,去上清,细胞重悬于200 μL PBS中上机检测。以吞噬系数(phagocytic index,PI)评价MDMP对巨噬细胞吞噬革兰阴性菌的影响。PI=阳性细胞百分比×平均荧光强度。
1.2.5 MDMP对革兰阴性菌诱导的炎症反应的影响接种5×105/孔RAW264.7细胞于6孔板中过夜培养,换上不含FBS的DMEM培养基。提前将革兰阴性菌(MOI=50)与MDMP于37 ℃共孵育30 min后以2%FBS调理,加入至RAW264.7细胞培养的6孔板中,空白孔加入相同体积的PBS;37 ℃,5%CO2孵箱中培养12 h后收取培养上清液,以ELISA试剂盒分别检测上清液中TNF-α和IL-6的表达水平。
1.3 统计学方法数据以x±s表示。采用GraphPad Prism 6软件进行t检验,以P<0.05表示差异具有统计学意义。
2 结果 2.1 EGFP基因片段的扩增电泳检测结果显示,经PCR成功扩增出单一的大小700~800 bp的产物(图 1A),与预计产物的大小735 bp一致,此说明目的条带得到了成功的扩增。
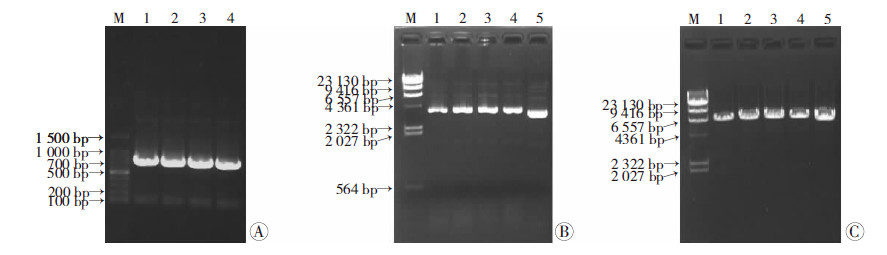 |
| A:PCR反应扩增出的EGFP基因片段电泳结果 1~4:目的基因序列;M:100 bp DNA梯度标准;B:重组质粒pET-32a(+)-EGFP的电泳结果 1~4:pET-32a(+)-EGFP重组质粒;5:pET-32a(+)空白质粒;M:酶切标准;C:重组质粒pET-32a(+)-EGFP的酶切鉴定 1~4:pET-32a(+)-EGFP重组质粒单酶切产物;5:pET-32a(+)空白质粒单酶切产物; M: 酶切标准 图 1 重组质粒的构建与鉴定 |
将双酶切后pET-32a(+)质粒和EGFP的PCR产物经连接酶连接后,对阳性克隆进行PCR检验。以pET-32a(+)空白质粒作为阴性对照,结果见图 1B。pET-32a(+)-EGFP重组质粒条带明显比pET-32a(+)空白质粒要大,与理论相符,可初步确定重组质粒构建成功。另外,酶切鉴定结果表明,pET-32a(+)-EGFP重组质粒单酶切产物条带大小一致且均较单酶切后的pET-32a(+)空白质粒要大,提示重组质粒应为阳性质粒(图 1C)。
进一步将重组质粒回收、提纯,送往上海Invitrogen公司测序,测序结果显示重组质粒中插入的序列与pEGFP-C3质粒中EGFP蛋白的编码序列完全一致,且读码框也相同,故pET-32a(+)-EGFP原核表达载体构建成功。
2.3 流式细胞术和激光共聚焦检测EGFP的原核表达重组质粒pET-32a(+)-EGFP成功构建并不意味着EGFP就能够在原核系统中得到高表达,通过利用热休克法将质粒pET-32a(+)-EGFP转化感受态E.coli BL21(DE3)PLysS,以流式细胞术和共聚焦分别检测RAW264.7细胞吞噬转化菌后的荧光强度,即可反映EGFP的表达量。共聚焦检测结果显示对照组未见绿色荧光,而实验组随着吞噬时间的增加,胞浆内可明显观察到绿色荧光逐渐增多(图 2)。这说明EGFP的原核表达是成功的,而且通过IPTG诱导后能够得到EGFP的高表达,从而证明该表达菌可很好地用于示踪和定量。流式细胞术检测结果见图 3,实验组荧光强度明显高于阳性对照组,进一步证明该细菌中EGFP得到了很好的表达,该细菌可作为可视化工具用于后续实验。
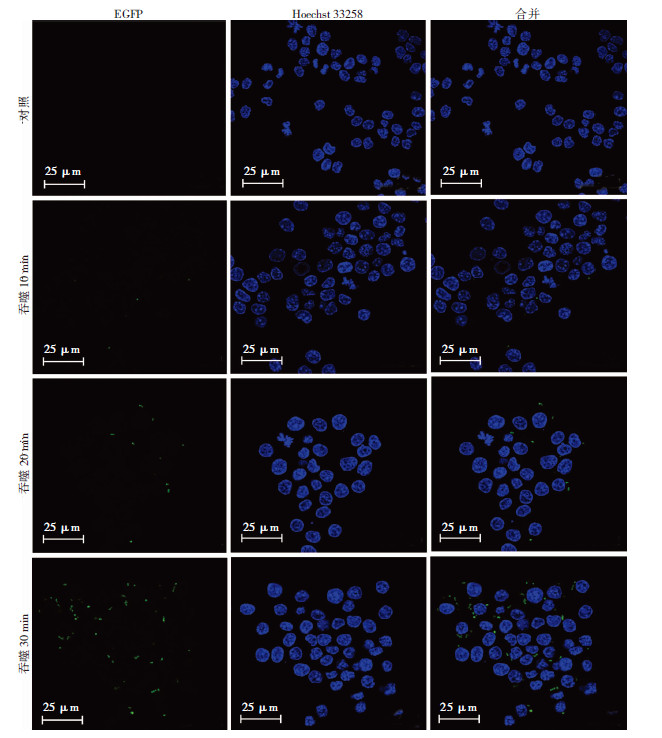 |
| 图 2 激光共聚焦检测RAW264.7细胞对荧光细菌的吞噬 |
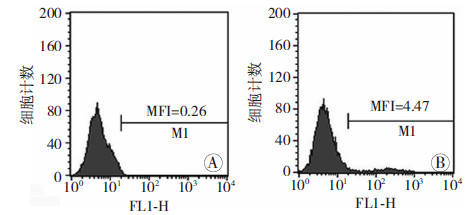 |
| A:阳性对照组;B:实验组 图 3 流式细胞术检测RAW264.7细胞对荧光细菌的吞噬 |
通过流式细胞术检测各组细胞中EGFP的荧光强度,以反映细胞吞噬革兰阴性菌的量。与空白组比较,用EGFP-BL21刺激的阳性对照组中EGFP的阳性细胞比率明显上升。与阳性对照组比较,预处理组随MDMP浓度的升高(1.0~100 μg/mL),EGFP的阳性细胞比率依次降低(图 4)。阳性对照组PI值显著高于空白组(P<0.01);10、100 μg/mL MDMP组PI值显著低于阳性对照组(P<0.01),且呈剂量依赖效应。因此,MDMP可抑制RAW264.7细胞对革兰阴性菌的吞噬作用。
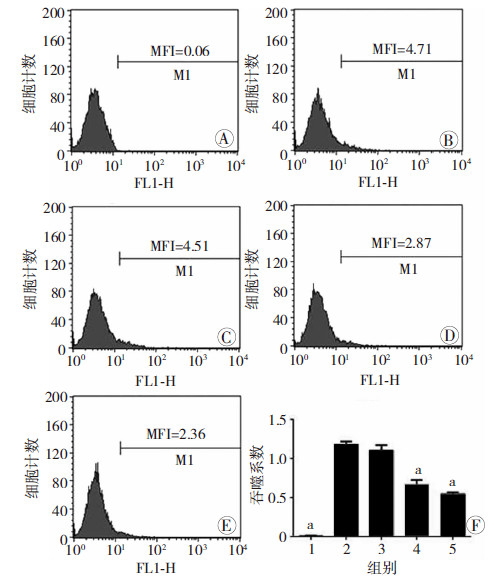 |
| A:空白组;B:阳性对照组;C:1.0 μg/mL MDMP组;D: 10 μg/mL MDMP组;E:100 μg/mL MDMP组;F:各组 吞噬系数比较 1:空白组;2:阳性对照组;3:1.0 μg/mL MDMP组;4:10 μg/mL MDMP组; 5:100 μg/mL MDMP组 a:P<0.01, 与阳性对照组比较 图 4 MDMP对RAW264.7细胞吞噬革兰阴性菌的影响 |
如图 5所示,与空白组比较,用EGFP-BL21诱导的阳性对照组中TNF-α和IL-6表达量显著上升(P<0.01);与阳性对照组比较,10、100 μg/mL MDMP组TNF-α和IL-6分泌水平显著降低(P<0.01),表明MDMP可明显抑制RAW264.7细胞促炎因子的表达。
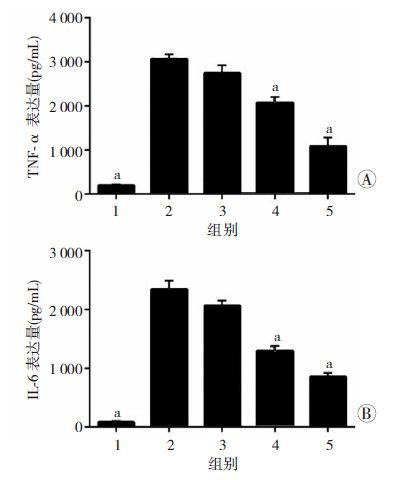 |
| 1:空白组; 2:阳性对照组; 3:1.0 μg/mL MDMP组; 4: 10 μg/mL MDMP组; 5: 100 μg/mL MDMP组 a:P<0.01,与阳性对照组比较 图 5 MDMP抑制革兰阴性菌诱导的TNF-α(A)及IL-6(B)的分泌 |
革兰阴性菌是引起人类感染性疾病的主要病原之一,在感染性疾病的病原构成中占有重要的地位。其细胞壁上的LPS可与体内巨噬细胞表面MD-2结合,然后募集TLR-4二聚化,形成受体复合体,激活LPS信号转导通路,进而引起炎症介质的释放,诱发炎症反应[2, 3, 4]。该过程是革兰阴性菌感染造成炎性疾病的基本途径。过度促炎症介质释放可引起全身炎症反应综合征,即脓毒症[8]。所以,早期干预革兰阴性菌与巨噬细胞的相互作用是抗脓毒症的有效途径之一。
MDMP是我们模拟MD-2结构上与LPS及TLR-4结合区域的氨基酸序列而合成的一个短肽。前期的研究表明,MDMP能明显地抑制LPS诱导的过度炎症反应,并有效地降低脓毒症模型小鼠的死亡率[7]。但MDMP在完整革兰阴性菌感染引起的炎症反应的作用尚不清楚。为此,本实验以RAW264.7细胞为研究对象,利用革兰阴性菌刺激建立体外细胞炎症模型,观察MDMP对革兰阴性菌诱导的炎症反应的抑制作用。本研究结果显示,不同浓度的MDMP对革兰阴性菌活化的巨噬细胞分泌TNF-α和IL-6具有明显的抑制作用,且呈剂量依赖效应,表明MDMP可抑制革兰阴性菌感染引起的炎症反应。
由于MDMP源于MD-2,其结构中包含有MD-2分子上与LPS结合的氨基酸序列。我们推测,在MDMP与革兰氏阴性细菌预孵育过程中,该序列由于空间位阻小,可能更易与细菌胞壁上的LPS结合,从而阻断了细菌经MD-2/TLR-4信号通路被巨噬细胞吞噬,进而抑制炎症因子的分泌。为了证实这一假设,我们拟进一步检测MDMP是否对巨噬细胞吞噬革兰阴性菌有影响。
众所周知,吞噬是细胞进化出的一个内化固体颗粒和溶质的功能,是天然免疫的一个重要部分。作为链接天然免疫和适应性免疫的重要免疫机制,细胞吞噬对病原清除和保护机体免受异物侵害具有重要作用[9]。MD-2和TLR-4是介导革兰阴性菌内化吞噬必不可少的成分[10, 11]。常规的评价免疫细胞吞噬作用的一个重要指标是检测其对细菌的吞噬率,传统的方法采用对吞噬细菌的巨噬细胞涂片染色后在显微镜下观察的方法进行[12]。但由于该方法操作繁琐,且因细菌形态较小,染色后显微镜下观察、计数很困难[13]。
基于此,我们首先通过克隆稳定表达EGFP的革兰阴性菌EGFP-BL21,作为可视化工具观察MDMP对巨噬细胞吞噬革兰阴性菌的影响。然后采用流式细胞术检测各实验组RAW264.7细胞中EGFP的荧光强度,结果显示,MDMP预处理组的吞噬系数明显低于阳性对照组(P<0.01),且随MDMP浓度增加依次降低。这表明MDMP可抑制RAW264.7细胞对革兰氏阴性细菌的吞噬作用,证实了前述推测。
综上所述,本研究通过构建稳定表达EGFP的革兰阴性菌EGFP-BL21,以其作为研究工具,证明了MDMP可明显抑制巨噬细胞对革兰阴性菌的吞噬作用,并降低该过程中炎症因子TNF-α和IL-6的分泌。本实验结果进一步阐明了MDMP的抗炎作用机制,为抗炎多肽的研制奠定了理论基础。
| [1] | de-Jong H K, van-der-Poll T, Wiersinga W J. The systemic pro-inflammatory response in sepsis[J]. J Innate Immun, 2010, 2(5): 422-430. DOI: 10.1159/000316286 |
| [2] | Park B S, Song D H, Kim H M, et al. The structural basis of lipopolysaccharide recognition by the TLR4-MD-2 complex[J]. Nature, 2009, 458(7242): 1191-1195. DOI: 10.1038/nature07830 |
| [3] | 梁华平, 姚咏明, 王正国. 创伤后脓毒症的治疗现状不容乐观——预警研究值得重视[J]. 第三军医大学学报, 2011, 33(21): 2223-2226.DOI: 10.16016/ j.1000-5404.2011.21.041 |
| [4] | Duan G, Zhu J, Xu J, et al. Targeting myeloid differentiation 2 for treatment of sepsis[J]. Front Biosci (Landmark Ed), 2014, 19: 904-915. |
| [5] | Bassetti M, Righi E. New antibiotics and antimicrobial combination therapy for the treatment of gram-negative bacterial infections[J]. Curr Opin Crit Care, 2015, 21(5): 402-411. DOI: 10.1097/MCC.0000000000000235 |
| [6] | Park S H, Kim N D, Jung J K, et al. Myeloid differentiation 2 as a therapeutic target of inflammatory disorders[J]. Pharmacol Ther, 2012, 133(3): 291-298. DOI: 10.1016/j.pharmthera.2011.11.001 |
| [7] | Duan G J, Zhu J, Wan J Y, et al. A synthetic MD-2 mimetic peptide attenuates lipopolysaccharide-induced inflammatory responses in vivo and in vitro[J]. Int Immunopharmacol, 2010, 10(9): 1091-1100. DOI: 10.1016/j.intimp.2010.06.010 |
| [8] | Annane D, Bellissant E, Cavaillon J M. Septic shock[J]. Lancet, 2010, 365(9453): 63-78. |
| [9] | Aderem A, Underhill D M. Mechanisms of phagocytosis in macrophages[J]. Annu Rev Immunol, 1999, 17: 593-623. |
| [10] | Jain V, Halle A, Halmen K A, et al. Phagocytosis and intracellular killing of MD-2 opsonized gram-negative bacteria depend on TLR4 signaling[J]. Blood, 2008, 111(9): 4637-4645. DOI: 10.1182/blood-2007-11-126862 |
| [11] | Tissieres P, Pugin J. The role of MD-2 in the opsonophagocytosis of Gram-negative bacteria[J]. Curr Opin Infect Dis, 2009, 22(3): 286-291. DOI: 10.1097/QCO.0b013e 32832ae2fc |
| [12] | 曹雪涛. 免疫学技术及其应用[M]. 北京:科学出版社, 2010: 15-16. |
| [13] | White-Owen C, Alexander J W, Sramkoski R M, et al. Rapid whole-blood microassay using flow cytometry for measuring neutrophil phagocytosis[J]. J Clin Microbiol, 1992, 30(8): 2071-2076. |



