目前,缺血性心脏病的患病率和病死率持续上升[1]。缺血性心脏病心肌因缺血缺氧致心肌细胞死亡,细胞数目不断减少,因此,如何有效减少心肌细胞死亡成为治疗缺血性心肌病需优先考虑的问题。虽然有研究尝试心肌细胞增殖与再生[2],但增殖极缓,不能补充病变状态下的心肌丢失。研究证实持续性缺血缺氧可造成不可逆的心肌细胞凋亡[3],那么阻断缺血缺氧诱导的心肌细胞凋亡进程,可能成为治疗缺血性心脏病的重要策略。近年来研究发现,阴阳1(yin yang 1,YY1)在细胞凋亡中发挥重要作用。 YY1是核转录因子GLI-Kruppel家族成员之一[4],可调控多个细胞凋亡家族[5, 6],抑制细胞凋亡。研究证实YY1在心肌细胞中表达,而且还在许多心血管疾病包括先天性心脏病[7]、病理性心肌肥大[8]时呈差异性表达。然而,目前YY1与心肌细胞凋亡之间的关系、其是否能抑制缺血缺氧诱导的心肌细胞凋亡及其机制尚不清楚。本研究利用原代乳鼠心肌细胞,以无糖培养基和缺氧装置建立心肌细胞缺血缺氧凋亡模型,观察YY1对心肌细胞凋亡的影响,并研究其可能的机制。
1 材料与方法 1.1 材料1~3 d 龄SD乳鼠40只,雌雄不拘。由第三军医大学大坪医院实验动物中心提供。新生胎牛血清、DMEM高糖培养基、DMEM无糖培养基、D-Hanks液(Hyclone公司),胶原酶Ⅱ、胰蛋白酶(Worthington公司),YY1抗体(Abcam公司),Akt、磷酸化Aktser473、Survivin抗体(Cell Signal Technology公司),β-actin抗体(美国Santa Crusz公司),YY1重组质粒(重庆大学生物工程研究院),Lipofectamine 2000(Invitrogen公司),反转录聚合酶链式反应(RT-PCR)试剂盒(日本TaKaRa公司),LY294002、5-溴-2-尿嘧啶脱氧核苷(Brdu)(美国Sigma公司),原位末端转移酶标记(TUNEL法)试剂盒(Roche公司),CCK-8检测试剂盒(日本同仁化学研究所),荧光显微镜(日本Nikon公司)。
1.2 方法 1.2.1 新生大鼠心肌细胞原代培养心肌细胞分离采用胰酶和胶原酶混合消化法,纯化采用差速贴壁法和Brdu化学抑制法。具体如下:取出生1~3 d的乳鼠,全身酒精消毒后至无菌操作台,剪开胸腔,取下心脏,D-Hanks液洗去残血,除去心耳及心房,将心肌组织剪碎至沙砾大小,加入0.125%胰酶洗涤,组织静置沉降后移去上清液,转入100 mm培养皿,将0.125%胰酶和0.08%胶原酶按1:1比例体积加入,置CO2孵箱37 ℃消化30 min,用等体积含50 %胎牛血清的培养液终止消化。800×g 4 ℃离心5 min,弃上清并用含10 %体积胎牛血清及0.01 mmol/L Brdu的培养液重悬。以200目钢网过滤重悬液,接种至培养皿,置5 % CO2孵箱37 ℃培养60 min,使成纤维细胞贴壁,以获得较纯的心肌细胞。计数、调整细胞密度至1×105cfu/mL,接种至培养板内,置入细胞培养箱24 h后换液,72 h后更换为不含Brdu的培养液。
1.2.2 心肌细胞转染质粒细胞培养至第3天,转染前2 h更换无血清opti-MEM培养液,将质粒2 μg和Lipfectamine 2000 5 μL分别加入50 μL opti-MEM培养基,混匀室温孵育5 min,将质粒混合液与Lipfectamine 2000混合液合并混匀,室温孵育20 min后加入细胞中,6 h更换为DMEM高糖培养基。24 h检测YY1 mRNA表达水平,48 h检测YY1蛋白表达水平。
1.2.3 模拟缺血缺氧环境缺氧为缺氧试剂Na2S2O4 与缺氧装置(Billups-rothenberg)双重缺氧模型。具体如下:细胞培养在含10 mmol/L Na2S2O4的培养液中,迅速放入缺氧装置,将95 %N2+5 %CO2混合气体以10 L/min流量充入密闭容器,持续15 min,同时关闭进出口,间隔5 min再次充气,重复3次。缺血为细胞培养至第5天,缺氧刺激前PBS液洗两遍,加入无糖DMEM培养液,模拟缺血环境。
1.2.4 实验分组及干预将纯化的心肌细胞进行分组及干预。①对照组:DMEM高糖培养基培养心肌细胞。②YY1组:转染YY1重组质粒,DMEM高糖培养基正常培养心肌细胞。③缺血缺氧组:在缺氧环境中,以 无糖DMEM培养基,37 ℃、CO2培养心肌细胞6 h 诱导细胞凋亡。④缺血缺氧+YY1组:转染YY1重组质粒,48 h后放入在缺氧环境,以无糖DMEM培养基,37 ℃、CO2培养心肌细胞6 h诱导细胞凋亡。⑤缺血缺氧+LY294002组:缺氧前1 h 加入PI3K/Akt通路抑制剂LY294002 50 μmoL/L,在缺氧装置中,以无糖无血清DMEM培养基,37 ℃、CO2培养心肌细胞6 h诱导细胞凋亡。⑥缺血缺氧+YY1+LY294002组:转染YY1质粒48 h,缺血缺氧前1 h加入PI3K/Akt通路抑制剂LY294002 50 μmoL/L,在缺氧环境中,以无糖DMEM培养基,37 ℃、CO2培养心肌细胞6 h诱导细胞凋亡。
1.2.5 CCK-8法检测心肌细胞活力心肌细胞调整密度为2×105/mL,加入96孔板,100 μL/孔,设置6复孔。分组干预后更换为含10 %CCK-8试剂的培养液100 μL,另取不含细胞的空白培养液与CCK-8反应作为本底,于37 ℃、5 % CO2培养箱中1 h,使用酶标仪在450 nm处测定光密度值。
1.2.6 TUNEL染色阳性率检测心肌细胞凋亡情况分组干预后按照TUNEL试剂盒说明进行操作。荧光显微镜下观察凋亡的心肌细胞核呈绿色。每组标本观察10张细胞爬片,每张爬片在以200倍镜下为单位视野,随机选择5个视野观察,记录阳性细胞数目。凋亡指数=心肌细胞核TUNEL阳性细胞数/视野内心肌细胞核总数×100%,记录并计算各组凋亡指数。
1.2.7 反转录聚合酶链式反应(RT-PCR)法检测mRNA 表达水平干预后收集各组细胞,依据TRIzol说明书裂解,氯仿提取细胞总RNA,核酸蛋白定量仪进行定量。按反转录试剂盒说明进行反转录为cDNA,产物直接用于QT-PCR反应,建立20 μL反应体系。设β-actin 为内参,扩增条件分别为:94 ℃预变性3 min;94 ℃变性30 s;59 ℃退火45 s,72 ℃延伸45 s,40个循环。扩增产物在QT-PCR仪记录并分析各组相对表达量。
1.2.8 细胞总蛋白提取和Western blot法检测蛋白表达水平细胞干预后,收集各组细胞,依据蛋白裂解液RIPA说明书(使用前加入10-苯甲基酰氟PMSF)裂解,4 ℃ 12 000×g离心20 min提取蛋白,采用考马斯亮蓝法测定总蛋白表达水平,将等量蛋白质分别采用10 %SDS聚丙烯酰胺凝胶垂直电泳进行分离。然后转至聚偏二氟乙烯膜上,室温下摇动封闭[TBST(Tris-HCl、NaCl、Tween20,pH:7.4)+5%脱脂奶粉]1 h,洗膜15 min,加入一抗(1:800稀释),4 ℃过夜,室温下洗膜3次,每次15 min,加入二抗(1:10 000稀释)避光孵育1.5 h,室温下洗膜3次,自动电泳凝胶扫描仪扫描,Quantity One分析结果。
1.3 统计学方法所有数据以x±s表示,采用GraphPad Prism 5统计软件进行数据分析,多组间比较采用单因素方差分析,两组之间均数比较采用t检验分析。
2 结果 2.1 YY1重组质粒转染和缺血缺氧后YY1表达情况与对照组相比,转染YY1重组质粒后,YY1组YY1 mRNA表达水平增加约30倍(P < 0.01)、YY1 蛋白表达增加3.45倍(P < 0.01,图 1)。缺血缺氧刺激 心肌细胞6 h后,与对照组相比,缺血缺氧组YY1 mRNA 表达水平增加3.02倍(P < 0.01)、YY1 蛋白表达水平增加1.63倍(P < 0.05,图 1)。
 |
| 1:对照组;2:YY1组;3:缺血缺氧组;4:缺血缺氧+YY1组 图 1 Western blot法检测各组心肌细胞YY1蛋白的表达水平 |
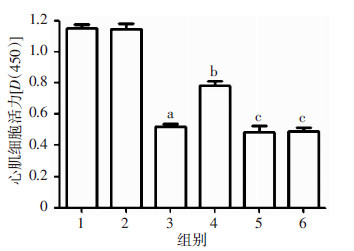
对照组与YY1组心肌细胞活力差异无统计学意义(P>0.05)。与对照组相比,缺血缺氧刺激心肌细胞6 h,缺血缺氧组心肌活力下降(P < 0.01)。缺血缺氧前预转染YY1重组质粒后,缺血缺氧+YY1组与缺血缺氧相比,心肌细胞活力上升(P < 0.01)。经PI3K/Akt通路抑制剂LY294002处理后,缺血缺氧+YY1+LY294002组与缺血缺氧+YY1组相比,心肌细胞活力显著下降(P < 0.01)。见图 2。
 |
|
1:对照组;2:YY1组;3:缺血缺氧组;4:缺血缺氧+YY1组;5:缺血缺氧+LY294002组;6:缺血缺氧+YY1+LY294002组 a:P < 0.01,与对照组比较;b:P < 0.01,与缺血缺氧组比较;c:P < 0.01,与缺血缺氧+YY1组比较 图 2 CCK-8法检测各组心肌细胞活力情况 (n=4, x±s) |
对照组与YY1组心肌细胞凋亡率差异无统计学意义(P>0.05)。心肌细胞缺血缺氧6 h,缺血缺氧组凋亡率显著高于对照组(P < 0.01)。缺血缺氧前预转染YY1重组质粒后,缺血缺氧+YY1组细胞凋亡率明显低于缺血缺氧组(P < 0.01)。心肌细胞运用 PI3K/Akt抑制剂LY294002干预后,缺血缺氧+YY1+LY294002组与缺血缺氧+YY1组相比,凋亡率显著升高(P < 0.01),而与缺血缺氧组相比,凋亡率下降(P < 0.01)。提示YY1能降低心肌细胞凋亡率,但抑制剂LY294002不能完全抵消YY1的抗凋亡作用。见图 3。
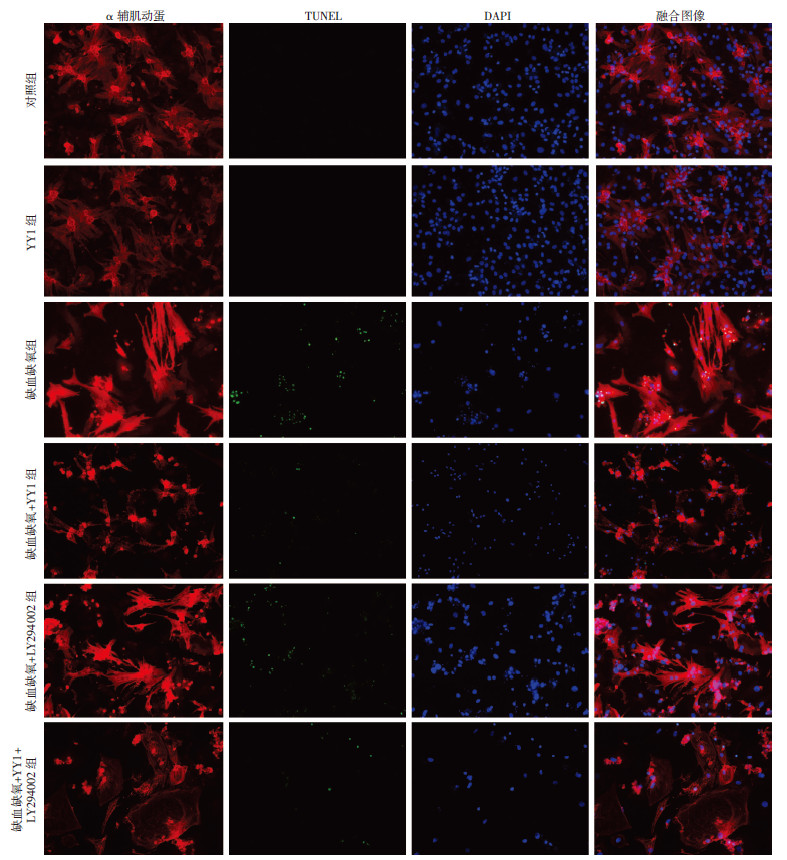 |
| 图 3 TUNEL法检测各组乳鼠心肌细胞的凋亡率 (荧光显微镜 ×200) |
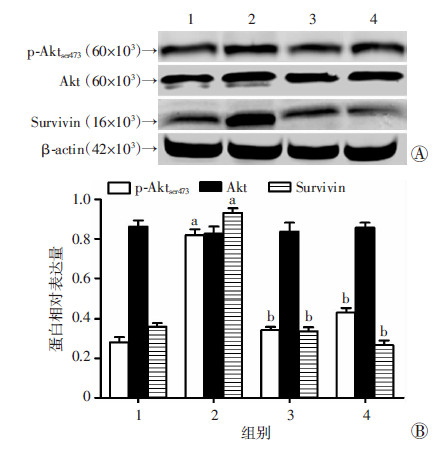
缺血缺氧刺激心肌细胞6 h,与缺血缺氧组相比,缺血缺氧+YY1组Akt磷酸化水平及Survivin蛋白表达量明显增加(P < 0.01)。而抑制剂LY294002处理心肌细胞后,缺血缺氧+LY294002组和缺血缺氧+ YY1+LY294002组与缺血缺氧+YY1组相比,Akt磷酸化水平及Survivin蛋白表达量降低(P < 0.01)。见图 4。提示YY1能上调Aktser473和Survivin表达,同时暗示不同处理条件下,p-Aktser473和Survivin表达变化一致。
 |
|
1:缺血缺氧组;2:缺血缺氧+YY1组;3:缺血缺氧+LY294002组;4:缺血缺氧+YY1+LY294002组 A:Western blot分析;B:各组p-Aktser473、Akt及Survivin相对表达量(n=4, x±s) a:P < 0.01,与缺血缺氧组比较; b:P < 0.01,与缺血缺氧+YY1组比较 图 4 Western blot法检测各组心肌细胞磷酸化p-Aktser473、 Akt及Survivin蛋白的表达 |
缺血缺氧是缺血性心脏病心肌细胞发生凋亡最强的诱导因素。心肌缺血缺氧导致心肌细胞有氧代谢减弱,心肌因供能不足致细胞活力下降。同时,产生的代谢废物如果不能及时有效地清除,就会激活心肌细胞凋亡基因和凋亡信号通路[9, 10],导致细胞凋亡的发生。细胞凋亡的显著特征是受基因调控,因此干预引起凋亡的基因或基因信号传导途径,阻断细胞凋亡进程可能对治疗缺血性心脏病有着重要意义。
YY1作为抗细胞凋亡的重要转录因子[5],能够通过多种途径发挥抗细胞凋亡作用。研究发现YY1蛋白能结合Akt丝氨酸第473号磷酸化位点,促进Akt磷酸化[11],从而促进细胞存活。另外,YY1能够促进Survivin表达发挥抗凋亡功能[6]。同时,YY1可抑制凋亡终末效应酶活性[12],阻断各种刺激诱导的细胞凋亡过程。本研究发现缺血缺氧刺激后YY1 mRNA及蛋白表达显著上调,提示YY1可能参与了心肌细胞缺血缺氧后凋亡过程。在进一步探讨YY1对心肌细胞凋亡的影响研究中,我们通过缺血缺氧前预转染YY1 质粒后,观察到心肌细胞活力上升,细胞凋亡率降低,表明YY1能够维持心肌细胞活性,抑制心肌细胞凋亡。
Akt是一种Ser/Thr蛋白激酶,与磷脂酰肌醇3激酶(PI3K)构成PI3K/Akt信号通路,Akt的Ser473或Thr308磷酸化位点是PI3K/Akt信号通路激活的必要条件。研究证实,缺血缺氧刺激可活化Akt,活化后的Akt通过磷酸化作用激活或抑制下游靶基因,提高细胞对缺血缺氧的耐受性,促进细胞存活[13]。Survivin作为Akt下游蛋白起着关键的抗凋亡作用[9],Survivin是迄今发现最强的细胞凋亡抑制因子[14],Santini等[14]发现心肌细胞在受到缺血缺氧等外界刺激后,会产生Survivin抵抗刺激。缺血缺氧前预转染YY1重组质粒后,Aktser473和Survivin蛋白表达均增加,提示YY1激活PI3K/Akt通路,Akt的磷酸化诱导Survivin表达,减轻缺血缺氧刺激对心肌细胞造成的凋亡。若需进一步明确YY1抗心肌细胞凋亡是否完全依赖PI3K/Akt信号通路,还需阻断PI3K/Akt信号通路观察心肌细胞凋亡情况。本研究在转染YY1质粒的基础上,使用抑制剂LY294002完全阻断PI3K/Akt信号通路,该通路的失活直接导致YY1过表达心肌细胞的凋亡比例显著增加,但仍低于单纯缺血缺氧状态下凋亡比例,提示LY294002未完全抵消YY1的抗心肌凋亡作用,表明YY1抑制心肌凋亡可能存在其他非PI3K/Akt信号通路途径[15]。因此,除PI3K/Akt信号通路途径之外,是否存在其他信号通路参与YY1对心肌细胞的保护调控,有待进一步研究。
综上所述,我们认为YY1参与了缺血缺氧条件下心肌细胞的内源性保护,YY1抑制缺血缺氧诱导的心肌细胞凋亡,在其抗凋亡过程中PI3K/Akt信号通路起到了重要作用。本研究关于YY1对缺血缺氧心肌细胞的抗凋亡作用可能为提高心肌细胞存活率、改善缺血性心脏病的疗效提供新的思路。
| [1] | Mozaffarian D, Benjamin E J, Go A S, et al. Heart disease and stroke statistics—2015 update: a report from the American Heart Association[J]. Circulation, 2015, 131(4): e29-e322. DOI: 10.1161/CIR.0000000000000152 |
| [2] | Lin Z, von-Gise A, Zhou P, et al. Cardiac-specific YAP activation improves cardiac function and survival in an experimental murine MI model[J]. Circ Res, 2014, 115(3): 354-363. DOI: 10.1161/CIRCRESAHA.115.303632 |
| [3] | Zhang Y, Kohler K, Xu J, et al. Inhibition of p53 after acute myocardial infarction: reduction of apoptosis is counteracted by disturbed scar formation and cardiac rupture[J]. J Mol Cell Cardiol, 2011, 50(3): 471-478. DOI: 10.1016/j.yjmcc.2010.11.006 |
| [4] | Zhang Q, Stovall D B, Inoue K, et al. The oncogenic role of Yin Yang 1[J]. Crit Rev Oncog, 2011, 16(3/4): 163-197. |
| [5] | Deng Z, Cao P, Wan M M, et al. Yin Yang 1: a multifaceted protein beyond a transcription factor[J]. Transcription, 2010, 1(2): 81-84. DOI: 10.4161/trns.1.2.12375 |
| [6] | Sui G, Affarel B, Shi Y, et al. Yin Yang 1 is a negative regulator of p53[J]. Cell, 2004, 117(7): 859-872. |
| [7] | Gregoire S, Karra R, Passer D, et al. Essential and unexpected role of Yin Yang 1 to promote mesodermal cardiac differentiation[J]. Circ Res, 2013, 112(6): 900-910. DOI: 10.1161/CIRCRESAHA.113.259259 |
| [8] | Sucharov C C, Dockstader K, McKinsey T A. YY1 protects cardiac myocytes from pathologic hypertrophy by interacting with HDAC5[J]. Mol Biol Cell, 2008, 19(10): 4141-4153. DOI: 10.1091/mbc.E07-12-1217 |
| [9] | Yin Q, Jin P, Liu X, et al. SDF-1α inhibits hypoxia and serum deprivation-induced apoptosis in mesenchymal stem cell through PI3K/Akt and ERK1/2 signaling pathway[J]. Mol Bio Rep, 2011, 38(1): 9-16. DOI: 10.1007/s11033-010-0071-9 |
| [10] | Wang X, Cui L, Joseph J, et al. Homocysteine induces cardiomyocyte dysfunction and apoptosis through p38 MAPK-mediated increase in oxidant stress[J]. J Mol Cell Cardiol, 2012, 52(3): 753-760. DOI: 10.1016/j.yjmcc.2011.12.009 |
| [11] | de-Nigris F, Crudele V, Giovane A, et al. CXCR4/YY1 inhibition impairs VEGF network and angiogenesis during malignancy[J]. Proc Natl Acad Sci USA, 2010, 107(32): 14484-14489. DOI: 10.1073/pnas.1008256107 |
| [12] | Riman S, Rizkallah R, Kassardjian A, et al. Phosphorylation of the transcription factor YY1 by CK2α prevents cleavage by caspase 7 during apoptosis[J]. Mol Cell Biol, 2012, 32(4): 797-807. DOI: 10.1128/MCB.06466-11 |
| [13] | 宋华培, 黄跃生, 党永明, 等. PI3K/Akt信号途径抑制烧伤后大鼠缺血缺氧心肌细胞凋亡[J]. 第三军医大学学报, 2009, 31(1): 52-55. DOI: 10.16016/j .1000-5404.2009.01.031 |
| [14] | Santini D, Abbate A, Scarpa S, et al. Surviving acute myocardial infarction: survivin expression in viable cardiomyocytes after infarction[J]. J Clin Pathol, 2004, 57(12): 1321-1324. |
| [15] | Zhang N, Li X, Wu C W, et al. microRNA-7 is a novel inhibitor of YY1 contributing to colorectal tumorigenesis[J]. Oncogene, 2013, 32(42): 5078-5088. DOI: 10.1038/onc.2012.526 |



