临床中核磁共振检测到的膝关节软骨下骨髓病变(bone marrow lesions,BMLs)较为常见,引起此类信号改变的疾病较多,相关研究逐渐深入,但多是针对骨性关节炎(osteoarthritis,OA)相关的BMLs,且对应的组织病理学研究很少[1]。对于髌股关节、股骨后髁等非负重区的非创伤性局灶性BMLs信号研究较少,而由于此类病变多未行手术或活检,其基础病理学研究报道更为少见[2],在临床中常冠以髌骨软化、骨软骨损伤、骨水肿等诊断,治疗处置缺乏针对性。本研究以合并非负重区软骨下局灶性BMLs信号的膝关节OA患者为研究对象,通过全膝关节置换手术获取病灶标本,并观察其组织病理学变化,为明确此类疾病诊断,进一步研究其发病机制和治疗方法提供理论依据。
1 资料与方法 1.1 筛选病例2013年9月至2015年2月,因膝关节骨性关节炎在本科接受关节置换手术的40~70岁患者115例,关节退变以负重的胫股关节为主,除外RA、创伤、感染等其他疾病。术前完善患膝MRI检查(0.2T常导Artoscan四肢关节专用MRI,意大利百胜公司),发现非负重区(髌股关节、股骨后髁)存在软骨下局灶性BMLs信号(T1加权低信号区,T2加权及STIR脂肪抑制序列高信号区[3-4],图 1)者10例,其中男性3例,女性7例。
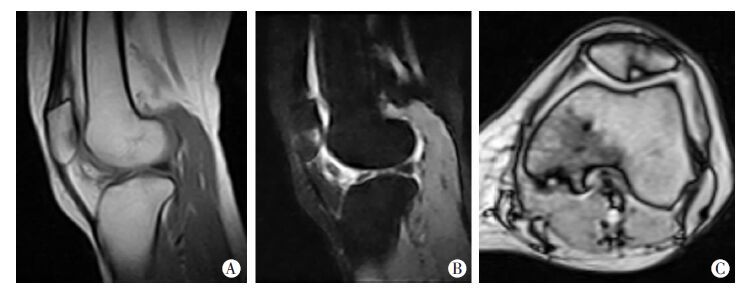
|
| A:髌骨关节面下病灶在T1WI为低信号; B: STIR脂肪抑制序列为高信号; C: T2WI为高信号,边缘有一低信号边界 图 1 BMLs患者MRI表现 |
1.2 获取标本
术中获取病灶标本5例纳入组织学研究,其中男性2例,女性3例,年龄53~67(61±6)岁;另5例病
灶均位于髌骨,因未行髌骨置换而未能获取标本。
1.3 组织病理学检查和半定量分析5例标本行大体观察后用10%福尔马林固定,5.5%乙二胺四乙酸(EDTA)脱钙液脱钙后,石蜡包埋并切片,层厚5 μm,分别行HE和番红O/固绿染色。CKX31显微镜及图像采集系统(Olympus公司,日本)采集病理图像,镜下确定病灶区和相邻对照区范围,软骨下骨髓区域作为测量对象(图 2)。Image Pro Plus 6.0图像分析软件(Media Cybernetics公司,美国)测量病灶区及相邻对照区面积,半定量分析各区域内组织学表现,不同组织通过软件工具勾绘边界,测量面积,所占面积比例按百分比表示[2]。骨小梁体积分数(trabecular bone volume,BV/TV):测量范围内骨小梁面积/(骨小梁+骨髓腔面积)×100%。每例病灶取不连续切片3张,测量结果取平均值。

|
| 病灶为黑线间区域,表面软骨退变缺损,软骨下骨减少,白线间为相邻对照区,软件勾绘出软骨下测量区域 图 2 光镜确定软骨下骨髓区测量范围 (HE×40) |
1.4 统计学分析
计量资料以x±s表示,采用SPSS 22.0统计软件行配对t检验。
2 结果 2.1 大体观察5例患者病灶分别位于髌骨2例,股骨前髁2例,股骨后髁1例。病灶表面软骨均存在不同程度损伤,Ⅰ~Ⅲ度各1例,Ⅳ度2例。病灶截面观察:病例1(髌骨)病灶为明显的囊性变,病例2~5为松质骨表现(图 3)。
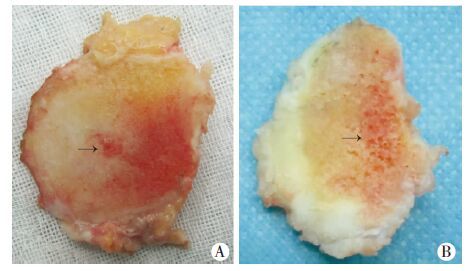
|
| A:髌骨BMLs病灶区截面为一囊性变(箭头示);B:股骨后髁BMLs病灶区截面为松质骨表现(箭头示) 图 3 BMLs病灶区截面大体观 |
2.2 组织学观察和分析
病例1(髌骨)病灶区为囊变表现,其内骨小梁破坏、吸收,大量渗液伴纤维肉芽组织形成,可见软骨样组织异位沉积;周围区域骨小梁形态相对正常,髓腔亦可见炎性渗出。因病灶区结构较紊乱,分辨不清,且可明确诊断为OA合并的骨囊性变,未行进一步组织学分析。病例2~5病灶区组织分辨较清晰,按所占面积比例计算,包含正常组织:完整骨小梁23.0%,正常骨髓53.6%,血管0.3%,红 骨髓为0;异常组织:骨髓水肿3.2%,骨髓坏死12.9%,骨髓纤维化1.6%,骨髓 出血1.7%,异常骨小梁(坏死、重塑)3.7%(图 4);BV/TV为26.7%。病灶区与对照区相比,骨髓坏死、异常骨小梁和BV/TV差异均有统计学意义(P <0.05,表 1)。
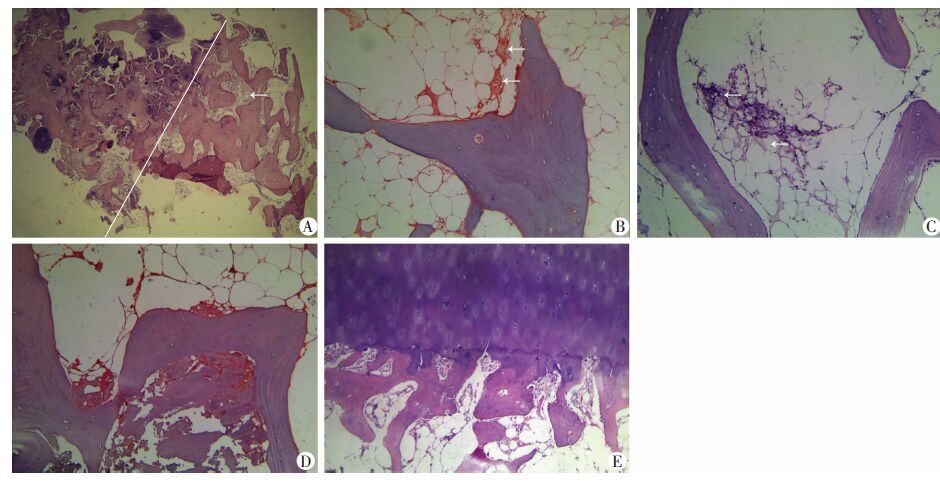
|
| A:以白线分界,左侧囊变区骨小梁破坏、吸收,大量渗液,纤维肉芽组织形成,右侧为相对正常骨小梁,其间有大量炎性渗出(箭头示)(HE×40);B:骨髓水肿区域脂肪细胞肿胀,红染细胞外液积聚(箭头示)(HE×100);C:骨髓坏死区域泡沫细胞形成(箭头示),脂肪细胞破坏、吸收(HE×100);D :骨小梁重塑、增厚,局部骨坏死(HE×100);E :局部潮线中断,骨小梁重塑增加,少量骨髓坏死、水肿(HE×40) 图 4 BMLs各类异常组织学表现 |
| 组别 | 骨髓水肿 | 骨髓坏死 | 骨髓纤维化 | 骨髓出血 | 异常骨小梁 | 正常骨髓 | 正常骨小梁 | 血管 | BV/TV |
| 病灶区 | 3.2±2.1 | 12.9±6.3 | 1.6±1.6 | 1.7±0.7 | 3.7±1.3 | 53.6±11.6 | 23.0±6.2 | 0.3±0.3 | 26.7±9.9 |
| 对照区 | 2.1±1.0 | 1.9±0.9 | 0.4±0.4 | 1.4±0.4 | 0.9±0.3 | 56.6±8.7 | 35.5±7.1 | 0.6±0.4 | 36.4±9.7 |
| t值 | -3.1 | -4.0 | -1.7 | -2.1 | -4.0 | - | - | - | 6.4 |
| P值 | 0.052 | 0.029 | 0.182 | 0.128 | 0.028 | - | - | - | 0.008 |
3 讨论
Wilson等[5]最早对关节MRI上发现的局部骨髓信号强度改变进行描述,将该表现称作“骨髓水肿(bone marrow edema,BME)”。这类病变常伴有疼痛症状,在X线片中多无特征性异常表现,而在MRI的T1加权相中表现为低信号,T2加权及STIR脂肪抑制序列则为高信号,类似水肿表现,故以BME命名。但已有研究证实BME病灶中除骨髓水肿外还存在另外多种病理组织[2, 6]。因此,“BME”作为此类病变的专业术语显得不够准确,近年来“骨髓病变(BMLs)”使用日益广泛,尤其是在骨性关节炎的研究中[1]。进一步研究发现,BMLs作为影像学表现缺乏特异性,许多病变均能引起BMLs信号改变。通过患者年龄、外伤史、症状特点、实验室检查等方面可以相对容易地鉴别出骨挫伤、肿瘤、感染、重度骨性关节炎等诊断,但对于轻度OA、软骨损伤或缺血性坏死的诊断则较困难[3]。本组研究对象为膝关节OA患者,其退变以负重的胫股关节为主,术前判断BMLs病灶所在的髌股关节、股骨后髁等部位没有或仅有较轻的退变,软骨损伤、特发性/缺血性骨坏死、一过性骨水肿等病因均不能排除。
既往针对BMLs的组织学研究极少。Zenetti等[2]在16例膝关节OA关节置换术中取胫骨平台BMLs病灶行病理研究后报道,病灶区组成包括正常组织:黄骨髓53%,骨小梁16%,血管2%;异常组织:骨髓坏死11%,坏死或重塑骨小梁8%,骨髓纤维化4%,水肿4%,骨髓出血2%。Saadat等[6]报道在3例膝关节OA患者的BMLs病灶中观察到纤维组织生长和骨重塑增强,但没有发现骨髓水肿。另外在髋关节OA的BMLs病理研究中,Leydet-Quilici等[7]将BMLs信号进一步细分为类水肿型和类坏死型,其中类坏死型包括骨髓坏死和纤维化等病理学表现。本组5例病灶中1例为骨囊变,单纯的软骨下骨囊肿通过MRI比较容易诊断,通常表现为边界清楚的类圆形液性信号区,许多研究发现其与BMLs密切相关。Carrino等[8]报道92%的软骨下骨囊肿发生在BMLs区域,且BMLs体积的变化常伴随囊肿的发展。一项多中心研究提示BMLs可能就是一种骨囊肿形成前的病变[9]。该病例术前MRI并未发现典型囊肿征象,通过术后病理分析考虑可能是因为囊变区周围存在大量炎性渗出,信号混杂,影响边界判断,而所用磁共振仪器为低场强设备,精密度不足所致。本组另外4例病灶组织学表现则存在一定的共性:①不同程度的表面软骨损伤;②正常组织所占面积比例较异常组织高;③异常组织中骨髓坏死、异常骨小梁比例相对较高,与对照区存在统计学差异;④骨小梁体积分数低。大量研究证实OA或软骨损伤与BMLs的发生关系密切[10-11],而长期随访研究显示:起始的BMLs程度、BMLs的进展以及新产生的BMLs均可作为独立风险因素预测软骨的丢失[12-14]。可见软骨损伤可能导致BMLs信号产生,而BMLs反过来可作为软骨损伤发生和进展的监测指标。本组患者病灶部位均存在不同程度软骨损伤,考虑BMLs的发生与其有关,所发现的骨髓坏死、纤维化等表现结合发现的血管数量少,需与缺血性坏死进行鉴别,但其分布散在,面积较小,故考虑缺血表现可能是局部病变结果而非起因。BMLs的MRI表现基础多为充血、炎性水肿,本组病灶的信号改变考虑主要由骨髓坏死和水肿产生[2],纤维组织在形成过程中也能在STIR相产生高信号[15],本组病例骨髓纤维化所占面积比例较低,对该信号改变影响较小,而充血表现在本组病例中则未涉及。
BMLs病灶另一组织学特点为骨组织改变。Lowitz等[16]通过QCT研究证实膝关节OA的BMLs病灶处骨密度增加。Driban等[17]研究发现,骨性关节炎的BMLs病灶随时间推移不论是扩大还是缩小,局部骨密度和骨硬化均有增加。Hunter等[18]报道膝关节OA的胫骨平台软骨下BMLs病灶是骨硬化区,骨的体积及骨小梁厚度增加,但因矿化不良反而出现骨密度下降,导致局部容易出现机械磨损。而Ratzlaff等[19]则发现膝关节OA的BMLs与骨质疏松有一定相关性。本组病灶的骨小梁体积分数下降明显,低于相邻对照区,亦低于单纯OA或正常软骨下骨[20]。这与膝关节OA负重退变区常见的骨硬化、骨量增加正好相反,可以推测局部的骨量减少、骨质疏松是此类病变的一个特异性表现。
本研究发现的BMLs病灶区骨量减少、表面软骨损伤等病理学表现,为目前临床对该现象的干预提供了线索和依据,诸如治疗OA、软骨损伤的透明质酸钠、氨基葡萄糖、软骨素以及改善骨质疏松的二磷酸盐类药物均可进行使用,这也得到了部分临床研究的验证:唑来膦酸和硫酸软骨素对于缩小BMLs体积、改善疼痛症状均能发挥积极作用[21-22]。
综上所述,本研究发现:膝关节软骨下局灶性BMLs病灶表面合并不同程度软骨损伤,其内部组成以正常组织为主,异常组织包括骨髓坏死、骨小梁异常等;病灶区骨量减少明显,提示该病变与OA软骨损伤和骨质疏松相关。但本研究仍存在缺陷:①此类病灶取材只能来源于合并OA的关节置换或各种原因导致的截肢手术,且关节置换中髌骨置换比例低,位于髌骨的BMLs病灶更加难以获得,故取材资源有限,导致研究例数少;②所研究的病灶部位为非负重区,与负重的胫股关节(既往研究涉及区域)本身存在解剖结构的差异,故其各自的BMLs病因、发病机制可能存在差别,二者的研究可能缺乏相关性和可比性;③BMLs处于动态的发展和变化中,目前研究不能很好地反映和揭示这一动态过程,以上问题均需要纳入更大量的研究样本和引入科学、可行的技术方法进行解决。
| [1] | Xu L, Hayashi D, Roemer F W, et al. Magnetic resonance imaging of subchondral bone marrow lesions in association with osteoarthritis[J]. Semin Arthritis Rheum,2012, 42 (2) : 105 –118. DOI:10.1016/j.semarthrit.2012.03.009 |
| [2] | Zanetti M, Bruder E, Romero J, et al. Bone marrow edema pattern in osteoarthritic knees: correlation between MR imaging and histologic findings[J]. Radiology,2000, 215 (3) : 835 –840. |
| [3] | Roemer F W, Frobell R, Hunter D J, et al. MRI-detected subchondral bone marrow signal alterations of the knee joint: terminology, imaging appearance, relevance and radiological differential diagnosis[J]. Osteoarthritis Cartilage,2009, 17 (9) : 1115 –1131. DOI:10.1016/j.joca.2009.03.012 |
| [4] | Crema M D, Roemer F W, Marra M D, et al. MR imaging of intra- and periarticular soft tissues and subchondral bone in knee osteoarthritis[J]. Radiol Clin North Am,2009, 47 (4) : 687 –701. DOI:10.1016/j.rcl.2009.04.001 |
| [5] | Wilson A J, Murphy W A, Hardy D C, et al. Transient osteoporosis: transient bone marrow edema?[J]. Radiology,1988, 167 (3) : 757 –760. |
| [6] | Saadat E, Jobke B, Chu B, et al. Diagnostic performance of in vivo 3-T MRI for articular cartilage abnormalities in human osteoarthritic knees using histology as standard of reference[J]. Eur Radiol,2008, 18 (10) : 2292 –2302. DOI:10.1007/s00330-008-0989-7 |
| [7] | Leydet-Quilici H, Le-Corroller T, Bouvier C, et al. Advanced hip osteoarthritis: magnetic resonance imaging aspects and histopathology correlations[J]. Osteoarthritis Cartilage,2010, 18 (11) : 1429 –1435. DOI:10.1016/j.joca.2010.08.008 |
| [8] | Carrino J A, Blum J, Parellada J A, et al. MRI of bone marrow edema-like signal in the pathogenesis of subchondral cysts[J]. Osteoarthritis Cartilage,2006, 14 (10) : 1081 –1085. |
| [9] | Crema M D, Roemer F W, Zhu Y, et al. Subchondral cystlike lesions develop longitudinally in areas of bone marrow edema-like lesions in patients with or at risk for knee osteoarthritis: detection with MR imaging: the MOST study[J]. Radiology,2010, 256 (3) : 855 –862. DOI:10.1148/radiol.10091467 |
| [10] | Davies-Tuck M L, Wluka A E, Wang Y, et al. The natural history of bone marrow lesions in community-based adults with no clinical knee osteoarthritis[J]. Ann Rheum Dis,2009, 68 (6) : 904 –908. DOI:10.1136/ard.2008.092973 |
| [11] | Crema M D, Felson D T, Roemer F W, et al. Prevalent cartilage damage and cartilage loss over time are associated with incident bone marrow lesions in the tibiofemoral compartments: the MOST study[J]. Osteoarthritis Cartilage,2013, 21 (2) : 306 –313. DOI:10.1016/j.joca.2012.11.005 |
| [12] | Dore D, Martens A, Quinn S, et al. Bone marrow lesions predict site-specific cartilage defect development and volume loss: a prospective study in older adults[J]. Arthritis Res Ther,2010, 12 (6) : R222 . DOI:10.1186/ar3209 |
| [13] | Kothari A, Guermazi A, Chmiel J S, et al. Within-subregion relationship between bone marrow lesions and subsequent cartilage loss in knee osteoarthritis[J]. Arthritis Care Res (Hoboken),2010, 62 (2) : 198 –203. DOI:10.1002/acr.20068 |
| [14] | Tanamas S K, Wluka A E, Pelletier J P, et al. Bone marrow lesions in people with knee osteoarthritis predict progression of disease and joint replacement: a longitudinal study[J]. Rheumatology (Oxford),2010, 49 (12) : 2413 –2419. DOI:10.1093/rheumatology/keq286 |
| [15] | Reinus W R, Fischer K C, Ritter J H. Painful transient tibial edema[J]. Radiology,1994, 192 (1) : 195 –199. |
| [16] | Lowitz T, Museyko O, Bousson V, et al. Bone marrow lesions identified by MRI in knee osteoarthritis are associated with locally increased bone mineral density measured by QCT[J]. Osteoarthritis Cartilage,2013, 21 (7) : 957 –964. DOI:10.1016/j.joca.2013.04.006 |
| [17] | Driban J B, Lo G H, Price L, et al. Bone marrow lesion volume reduction is not associated with improvement of other periarticular bone measures: data from the Osteoarthritis Initiative[J]. Arthritis Res Ther,2013, 15 (5) : R153 . |
| [18] | Hunter D J, Gerstenfeld L, Bishop G, et al. Bone marrow lesions from osteoarthritis knees are characterized by sclerotic bone that is less well mineralized[J]. Arthritis Res Ther,2009, 11 (1) : R11 . DOI:10.1186/ar2601 |
| [19] | Ratzlaff C, Guermazi A, Collins J, et al. A rapid, novel method of volumetric assessment of MRI-detected subchondral bone marrow lesions in knee osteoarthritis[J]. Osteoarthritis Cartilage,2013, 21 (6) : 806 –814. DOI:10.1016/j.joca.2013.03.007 |
| [20] | 宋伟, 杨柳, 王富友. 膝关节原发性骨关节炎软骨和软骨下骨病理改变的定量研究[J]. 中国修复重建外科杂志,2011, 25 (12) : 1434 –1439. |
| [21] | Laslett L L, Dore D A, Quinn S J, et al. Zoledronic acid reduces knee pain and bone marrow lesions over 1 year: a randomised controlled trial[J]. Ann Rheum Dis,2012, 71 (8) : 1322 –1328. DOI:10.1136/annrheumdis-2011-200970 |
| [22] | Wildi L M, Raynauld J P, Martel-Pelletier J, et al. Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double-blind, placebo-controlled pilot study using MRI[J]. Ann Rheum Dis,2011, 70 (6) : 982 –989. DOI:10.1136/ard.2010.140848 |



