少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)是少突胶质细胞系发育的起始细胞,是未成熟的少突胶质细胞,有较强 的增殖分化能力,在一连串信号作用下在体内可增殖、迁移,最后分化为成熟的少突胶质细胞并形成髓鞘,在中枢神经系统 发育和损伤修复过程中具有重要作用[1, 2, 3, 4]。趋化因子12(CXCL12) 又称前B细胞刺激因子或者基质细胞衍生因子1,归属于CXC亚家族,由基质细胞持续产生,通过与受体CXCR4、CXCR7结合,在炎症反应、各种肿瘤、造血系统方面发挥重要作用。研究表明,CXCL12除了传统的对B淋巴细胞和骨髓造血干细胞起归巢作用[5]外,还与OPCs增殖、迁移、分化等过程密切相关[6, 7, 8, 9, 10],最终参与中枢神经系统发育和损伤修复过程。目前,CXCL12对OPCs是否有促进增殖的作用还不完全清楚。有研究表明CXCL12只能促进OPCs迁移和分化成熟,不能促进OPCs的增殖[8],但缺乏相关机制的研究。本研究拟通过体外实验观察不同浓度的CXCL12对OPCs在增殖方面的影响,初步探讨其可能的调控机制。
1 材料与方法 1.1 实验动物与主要试剂新生SD大鼠,鼠龄<48 h,雌雄不限,体质量10~ 20 g,由第三军医大学实验动物中心提供。DMEM、胎牛血清(Gibco公司),山羊抗小鼠ALexaFLuor® 488IgM、山羊抗兔ALexaFLuor® 488IgG、BCA Protein Assay Kit(Lifetech公司),兔抗大鼠髓磷脂碱性蛋白抗体、兔抗大鼠血小板源性生长因子受体α抗体(Santa Cruz公司),血小板源性生长因子-AA、碱性成纤维细胞生长因子、大鼠CXCL12重组蛋白(Peprotech公司),小鼠抗大鼠O4抗体(R&D公司),兔抗大鼠CXCR4 IgG抗体、兔抗大鼠CXCR7 IgG抗体(Abcam公司),CCK-8试剂盒(DOJINDO公司),CXCR4 siRNA、CXCR7 siRNA、siRNA对照(上海生博)。
1.2 方法 1.2.1 SD大鼠OPCs细胞分离、培养及鉴定根据Armstrong[11]、Itoh[12]介绍的方法行OPCs原代培养。根据OPCs初期表面特异性表达血小板源性生长因子受体α(PDGFR-α),OPCs诱导中期叉头蛋白O4表达呈阳性,诱导晚期髓鞘碱性蛋白(myelin basic protein,MBP)表达呈阳性,采用免疫细胞化学技术鉴定OPCs并观察其分化成熟情况。
1.2.2 不同浓度CXCL12对OPCs增殖的影响CCK-8检测OPCs经不同浓度CXCL12(0、5、10、20 ng/mL) 处理0、24、48、72 h的增殖能力。将各组样本细胞加入96孔板,每组设3个复孔。各组培养基加入96孔板剩余孔,作为空白对照组。总共铺4张完全相同的板,分别于培养0、24、48、72 h后各取出1张板,斜贴培养板壁向相应孔中迅速加入10 μL CCK-8溶液,孵育2 h后取出培养板用酶标仪测定在450 nm处的光密度值[D(450)],各组细胞增殖率=[D(450)实验组-D(450)空白对照组]/D(450)空白对照组×100%。
1.2.3 不同浓度CXCL12对OPCs蛋白表达的影响Western blot检测不同浓度CXCL12(0、5、10、20 ng/mL) 作用72 h后(每组设3个复孔)OPCs的CXCR4、CXCR7、MMP9蛋白表达。将收集的细胞样本依次提取蛋白、上样、电泳、转膜,以含5%胎牛血清的TBST室温封闭1 h,一抗采用兔抗大鼠CXCR4 IgG抗体、兔抗大鼠CXCR7 IgG抗体、山羊抗大鼠MMP9 IgG抗体,于4 ℃孵育过夜,二抗37 ℃ 2 h,ECL显影。
1.2.4 siRNA分别干扰CXCR4、CXCR7后OPCs的增殖能力利用经过Western blot筛选后能够有效干扰CXCR4、CXCR7蛋白表达的CXCR4 siRNA、CXCR7 siRNA和干扰对照siRNA进行实验,CXCL12浓度均为20 ng/mL。分为CXCL12、CXCL12+对照siRNA、CXCL12+CXCR4 siRNA、CXCL12+CXCR7 siRNA4组,采用CCK-8检测OPCs在不同时间点(0、24、48、72 h)的增殖能力。 1.2.5 siRNA分别干扰CXCR4和CXCR7后下游MMP9蛋白表达
分组和实验条件与1.2.4相同,采用Western blot检测MMP9蛋白培养后72 h后的表达。
1.2.6 siRNA干扰MMP9后OPCs的增殖变化利用经过Western blot筛选后能够有效干扰MMP9蛋白表达的MMP9 siRNA和对照siRNA,分为CXCL12、CXCL12+对照siRNA、CXCL12+MMP9 siRNA 3组,CXCL12浓度均为20 ng/mL,采用CCK-8检测OPCs在各时间点(0、24、48、72 h)的增殖能力。
1.3 统计学分析采用SPSS 19.0统计软件,计量资料以x±s表示,进行t检验,P<0.05为差异有统计学意义。
2 结果 2.1 SD大鼠OPCs分离、培养、鉴定获得大量OPCs,细胞体较小,直径6~10 μm,近似圆形,表现为折光性较强的小亮点,部分细胞体周围具有纤细的两极或三极细胞突起(图 1A)。免疫细胞化学检测结果显示:分离后OPCs能特异性表达PDGFR-α(图 1B)。OPCs经诱导分化为较成熟少突胶质细胞后,周围纤细突起较未诱导前稍增多,诱导中期O4表达呈阳性(图 1C),诱导晚期胞体网状纤细突起更加明显,呈“分枝”状或“蜘蛛网”状分布,BMP表达呈阳性(图 1D),是成熟的髓鞘形成细胞的标志。
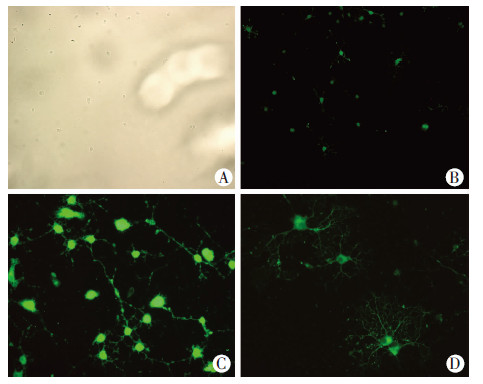 |
| A:OPCs白光(倒置显微镜);B:绿色为OPCs上PDGFR-α染色,蓝色为DAPI染核(荧光显微镜);C:绿色为OPCs诱导分化中期O4的染色,蓝色为DAPI染核(荧光显微镜);D:绿色为OPCs诱导分化晚期MBP的染色,蓝色为DAPI染核(荧光显微镜) 图 1 大鼠OPCs的分离、培养与鉴定 (激光共聚焦显微镜 ×200) |
在CXCL12浓度相同时,随着培养时间在一定范围内增加,OPCs增殖逐渐增加;在培养时间相同时,随着CXCL12在一定浓度范围内增加,OPCs增殖逐渐增加。与0 ng/mL CXCL12相比,10 ng/mL CXCL12处理72 h后,D(450)值明显增加(t=4.48,P<0.05);20 ng/mL CXCL12处理48 h和72 h后,D(450)值均明显增加(t=7.74,P<0.05;t=4.94,P<0.05)。结果见表 1。
| (n=3, x±s) | ||||
| CXCL12浓度 | 培养0 h | 培养24 h | 培养48 h | 培养72 h |
| 0 ng/mL | 0.197±0.052 | 0.233±0.060 | 0.378±0.055 | 0.559±0.067 |
| 5 ng/mL | 0.200±0.039 | 0.230±0.053 | 0.419±0.048 | 0.638±0.063 |
| 10 ng/mL | 0.229±0.073 | 0.296±0.056 | 0.533±0.045 | 0.820±0.035a |
| 20 ng/mL | 0.224±0.081 | 0.363±0.044 | 0.648±0.078a | 0.891±0.058a |
| a: P<0.05, 与0 ng/mL CXCL12比较 | ||||
随着CXCL12浓度增加,CXCR4、CXCR7、MMP9蛋白表达逐渐增加。与0、5 ng/mL CXCL12相比,10、20 ng/mL CXCL12时CXCR4蛋白相对表达均明显增加(t=9.59,P<0.05;t=11.67,P<0.01);与10 ng/mL CXCL12相比,20 ng/mL CXCL12时CXCR4蛋白增加趋势明显(t=6.10,P<0.05)。与0、5 ng/mL CXCL12相比,20 ng/mL CXCL12时CXCR7蛋白相对表达均明显增加(t=5.42,P<0.05);与10 ng/mL CXCL12相比,20 ng/mL CXCL12时CXCR7蛋白有增加趋势,但差异无统计学意义 (t=2.36,P>0.05)。与0、5 ng/mL CXCL12相比,10、20 ng/mL CXCL12时MMP9蛋白相对表达均明显增加(t=9.22,P<0.05; t=11.80,P<0.01);与10 ng/mL CXCL12相比,20 ng/mL CXCL12时MMP9蛋白明显增加(t=19.75,P<0.01)。结果见图 2。
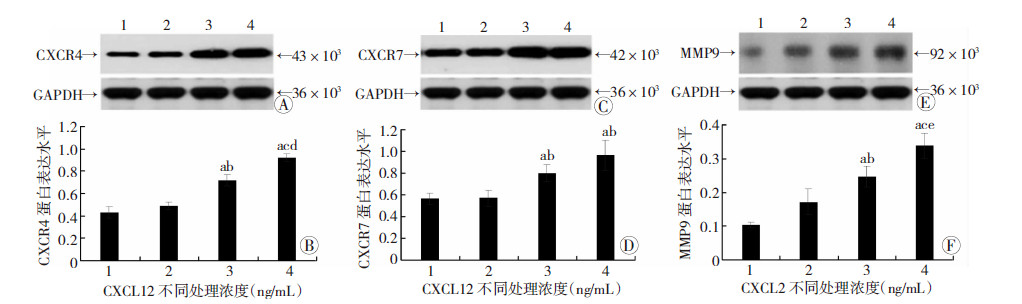 |
| 1:0 ng/mL CXCL12; 2: 5 ng/mL CXCL12; 3: 10 ng/mL CXCL12; 4: 20 ng/mL CXCL12 A、B: Western blot检测CXCR4蛋白表达及半定量分析结果;C、D:Western blot检测CXCR7蛋白表达及半定量分析结果;E、F:Western blot检测MMP9蛋白表达及半定量分析结果 a: P<0.05,与0 ng/mL CXCL12比较;b: P<0.05, c: P<0.01,与5 ng/mL CXCL12比较;d:P<0.05,e: P<0.01,与10 ng/mL CXCL12比较 图 2 Western blot检测不同浓度CXCL12对OPCs下游信号通路蛋白表达的影响 |
CXCR4和CXCR7分别阻断后各时间点OPCs增 殖均降低。与CXCL12+对照siRNA组相比,CXCL12+ CXCR4 siRNA组和CXCL12+CXCR7 siRNA组处理48 h和72 h后,D(450)值明显降低(t=-8.518,P<0.05;t=-5.338,P<0.05;t=-12.314, P<0.01;t=-9.595,P<0.05)。结果见表 2。
| (n=3, x±s) | ||||
| 组别 | 培养0 h | 培养24 h | 培养48 h | 培养72 h |
| CXCL12组 | 0.274±0.065 | 0.402±0.058 | 0.752±0.057 | 1.039±0.108 |
| CXCL12+对照siRNA组 | 0.265±0.064 | 0.362±0.063 | 0.712±0.060 | 0.905±0.056 |
| CXCL12+CXCR4 siRNA组 | 0.264±0.063 | 0.358±0.038 | 0.504±0.028a | 0.752±0.058b |
| CXCL12+CXCR7 siRNA组 | 0.253±0.062 | 0.351±0.070 | 0.517±0.056a | 0.807±0.044a |
| a: P<0.05, b: P<0.01,与CXCL12+对照siRNA组比较 | ||||
CXCR4 siRNA可阻断CXCR4蛋白表达,CXCR7 siRNA可阻断CXCR7蛋白表达,CXCR4 siRNA、CXCR7 siRNA均可阻断下游MMP9蛋白的表达。与CXCL12组相比,CXCL12+对照siRNA组CXCR4、CXCR7和MMP9蛋白的表达没有明显的变化(P>0.05);与CXCL12+对照siRNA组相比,CXCL12+CXCR4 siRNA中CXCR4和MMP9蛋白的表达明显降低(t=-8.661,P<0.05;t=-8.718,P<0.05),而CXCR7蛋白的表达没有明显的变化(P>0.05);与CXCL12+对照siRNA组相比,CXCL12+CXCR7 siRNA中CXCR7和MMP9蛋白的表达明显降低(t=-11.047,P<0.01;t=-7.604,P<0.05),而CXCR4蛋白的表达没有明显的变化(P>0.05)。结果见图 3。
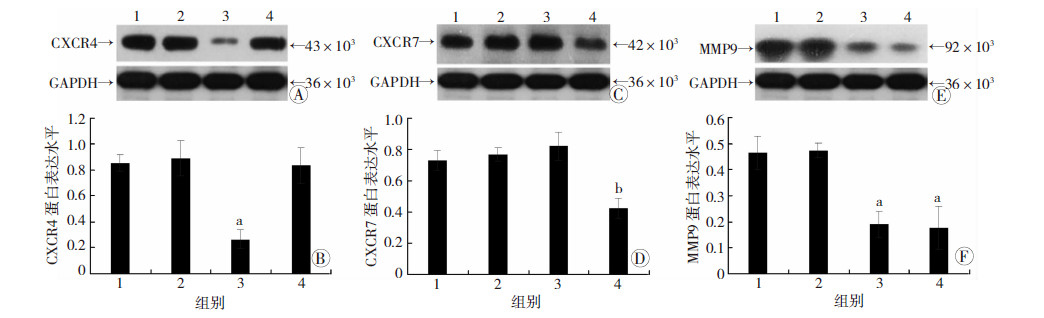 |
| CXCL12组; 2: CXCL12+对照siRNA组; 3: CXCL12+CXCR4 siRNA组; 4: CXCL12+CXCR7 siRNA组 A、B: Western blot检测CXCR4蛋白表达及半定量分析结果;C、D:Western blot检测CXCR7蛋白表达及半定量分析结果;E、F:Western blot检测MMP9蛋白表达及半定量分析结果 a: P<0.05, b: P<0.01,与CXCL12+对照siRNA组比较 图 3 Western blot检测CXCR4和CXCR7分别干扰后CXCL12对OPCs下游信号通路蛋白表达的影响 |
MMP9阻断后OPCs增殖明显降低。与CXCL12+ 对照siRNA组相比,CXCL12+MMP9 siRNA组处理48 h 和72 h后,D(450)值明显降低(t=-5.249,P<0.05;t=-5.024,P<0.05,表 3)。
| (n=3, x±s) | ||||
| 组别 | 培养0 h | 培养24 h | 培养48 h | 培养72 h |
| CXCL12组 | 0.252±0.061 | 0.358±0.062 | 0.713±0.036 | 0.927±0.052 |
| CXCL12+对照siRNA组 | 0.217±0.034 | 0.299±0.085 | 0.676±0.071 | 0.841±0.114 |
| CXCL12+MMP9 siRNA组 | 0.209±0.057 | 0.272±0.031 | 0.430±0.040a | 0.668±0.063a |
| a: P<0.05,与CXCL12+对照siRNA组比较 | ||||
脊髓损伤是一种常见的中枢神经系统损伤,损伤后常出现神经、感觉、运动功能严重障碍。脊髓损伤不仅会直接造成神经元的丢失,而且还将导致少突胶质细胞大量的死亡进而引起神经轴突脱髓鞘改变[13, 14]。脱髓鞘反应是一种慢性、渐进性病理变化过程,持续到脊髓损伤后相当一段时间,最终影响神经轴突的功能发挥[15],在脊髓损伤后自身修复过程中虽然局部可见少量OPCs增殖,但仅靠机体自身反应性增生的OPCs作用甚微,而外源性补充的OPCs经增殖、迁移、分化等一系列复杂过程后可改善残留神经轴突髓鞘化,促进损伤脊髓神经功能的恢复[1]。本研究发现,CXCL12对OPCs具有明显的促增殖作用,并在一定范围内具有浓度依赖性,随着CXCL12浓度的增高,促增殖作用更加明显。这种促增殖作用与OPCs的CXCR4、CXCR7、MMP9蛋白上调相关。
本实验检测不同浓度CXCL12培养72 h后CXCR4、CXCR7、MMP9蛋白的变化,发现CXCL12具有促进CXCR4、CXCR7、MMP9蛋白表达的作用,并在一定范围内具有浓度依赖性。随着CXCL12浓度的增高,这种促进蛋白表达的作用更加明显。我们推测,CXCL12可能通过影响受体CXCR4、CXCR7表达,影响下游MMP9蛋白的表达,最终影响OPCs的增殖。为了验证假设,我们用CXCR4 siRNA、CXCR7 siRNA对CXCR4、CXCR7分别进行干扰,发现下游MMP9蛋白的表达明显降低,对OPCs增殖作用也降低,说明干扰CXCR4、CXCR7抑制了下游MMP9蛋白的表达,进而抑制了OPCs的增殖。本实验进一步单独验证MMP9蛋白在细胞增殖过程中的作用,用MMP9 siRNA进行干扰,发现CXCL12对OPCs的增殖作用也受到了抑制。这表明CXCL12可分别通过促进CXCR4、CXCR7表达,进而促进下游的MMP9蛋白的表达,最终促进OPCs的增殖。
在正常生理条件下,CXCL12起着介导神经元前体细胞向最终功能区域定向迁移后增殖分化的作用。CXCL12基因缺失的小鼠因为中枢神经系统发育异常而不能存活[16];在病理条件下CXCL12更是与神经系统损伤、修复过程密切相关[17]。Lipfert等[18]发现CXCL12可以通过与CXCR4和CXCR7组成的功能性受体单元结合,激活下游的ERK1/2和Akt通路,从而促进初级小胶质细胞的增殖;Wu等[19]发现CXCL12也可通过激活下游的Akt通路促进人神经前体细胞增殖; Kadi等[6]应用小鼠少突胶质细胞前体样细胞系、Oli-neu细胞和小鼠大脑皮质混合培养实验模型研究趋化因子对OPCs增殖、分化成熟和髓鞘形成的影响,发现CXCL12通过与细胞表面受体CXCR4结合,促进小鼠A2B5前体样细胞系的增殖和MBP的合成,最终促进OPCs增殖和髓鞘形成;早期研究发现TNF-α可促进OPCs增殖[8],但原因不明。在进一步的脱髓鞘疾病相关研究中发现,小胶质细胞受到激活产生TNF-α,诱导产生的TNF-α与星形胶质细胞表面的TNFR2受体结合后刺激星形胶质细胞产生CXCL12,CXCL12再与OPCs表面的CXCR4结合,最终影响少突胶质前体细胞的增殖[20];Barkho等[21]研究发现,CXCL12影响MMP3、MMP9的变化,从而影响神经前体细胞的增殖。类似的,CXCL12通过提高MMP9表达在促进肿瘤细胞的增殖和侵袭、转移方面的研究较多,均表明CXCL12在促进细胞增殖、生长过程中具有重要作用。本实验结果也与以上研究结果相符:CXCL12对OPCs增殖有明显促进作用,这种促进增殖的作用与CXCR4、CXCR7、MMP9蛋白表达上调相关,本研究只是对CXCL12促进少突胶质前体细胞增殖机制的粗略研究,在此基础上还可以进一步研究增殖的少突胶质前体细胞是否有可以修复脱髓鞘的脊髓,最终利于脊髓损伤的修复。
综上所述,CXCL12对OPCs有明显的促进增殖的作用,但其调控机制是一个十分复杂的过程,仍有待进行深层次的探索。
| [1] | Wu B, Sun L, Li P, et al. Transplantation of oligodendrocyte precursor cells improves myelination and promotes functional recovery after spinal cord injury[J]. Injury, 2012, 43(6): 794-801. DOI:10.1016/j.injury.2011.09.013 |
| [2] | Sharp J, Frame J, Siegenthaler M, et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants improve recovery after cervical spinal cord injury[J]. Stem Cells, 2010, 28(1): 152-163. DOI:10.1002/stem.245 |
| [3] | Keirstead H S, Nistor G, Bernal G, et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury[J]. J Neurosci, 2005, 25(19): 4694-4705. DOI: 10.1523/JNEUROSCI.0311-05.2005 |
| [4] | Yune T Y, Lee J Y, Jung G Y, et al. Minocycline alleviates death of oligodendrocytes by inhibiting pro-nerve growth factor production in microglia after spinal cord injury[J]. J Neurosci, 2007, 27(29): 7751-7761. DOI:10.1523/JNEUROSCI.1661-07.2007 |
| [5] | Nagasawa T. A chemokine, SDF-1/PBSF, and its receptor, CXC chemokine receptor 4, as mediators of hematopoiesis[J]. Int J Hematol, 2000, 72(4): 408-411. |
| [6] | Kadi L, Selvaraju R, de-Lys P, et al. Differential effects of chemokines on oligodendrocyte precursor proliferation and myelin formation in vitro[J]. J Neuroimmunol, 2006, 174(1/2): 133-146. DOI:10.1016/j.jneuroim.2006.01.011 |
| [7] | Patel J R, McCandless E E, Dorsey D, et al. CXCR4 promotes differentiation of oligodendrocyte progenitors and remyelination[J]. Proc Natl Acad Sci U S A, 2010, 107(24): 11062-11067. DOI:10.1073/pnas.1006301107 |
| [8] | Maysami S, Nguyen D, Zobel F, et al. Modulation of rat oligodendrocyte precursor cells by the chemokine CXCL12[J]. Neuroreport, 2006, 17(11): 1187-1190. DOI: 10.1097/01.wnr.0000227985.92551.9a |
| [9] | Gottle P, Kremer D, Jander S, et al. Activation of CXCR7 receptor promotes oligodendroglial cell maturation[J]. Ann Neurol, 2010, 68(6): 915-924. DOI:10.1002/ana.22214 |
| [10] | Patel J R, Williams J L, Muccigrosso M M, et al. Astrocyte TNFR2 is required for CXCL12-mediated regulation of oligodendrocyte progenitor proliferation and differentiation within the adult CNS[J]. Acta Neuropathol, 2012, 124(6): 847-860. DOI:10.1007/s00401-012-1034-0 |
| [11] | Armstrong R C. Isolation and characterization of immature oligodendrocyte lineage cells[J]. Methods, 1998, 16(3): 282-292. DOI:10.1006/meth.1998.0685 |
| [12] | Itoh K. Culture of oligodendrocyte precursor cells (NG2(+)/O1(-)) and oligodendrocytes (NG2(-)/O1(+)) from embryonic rat cerebrum[J]. Brain Res Brain Res Protoc, 2002, 10(1): 23-30. |
| [13] | McDonald J W, Belegu V. Demyelination and remyelination after spinal cord injury[J]. J Neurotrauma, 2006, 23(3/4): 345-359. DOI:10.1089/neu.2006.23.345 |
| [14] | Radtke C, Spies M, Sasaki M, et al. Demyelinating diseases and potential repair strategies[J]. Int J Dev Neurosci, 2007, 25(3): 149-153. DOI:10.1016/j.ijdevneu.2007.02.002 |
| [15] | Totoiu M O, Keirstead H S. Spinal cord injury is accompanied by chronic progressive demyelination[J]. J Comp Neurol, 2005, 486(4): 373-383. DOI:10.1002/cne.20517 |
| [16] | Lu M, Grove E A, Miller R J. Abnormal development of the hippocampal dentate gyrus in mice lacking the CXCR4 chemokine receptor[J]. Proc Natl Acad Sci U S A, 2002, 99(10): 7090-7095. DOI:10.1073/pnas.092013799 |
| [17] | Momcilovic M, Mostarica-Stojkovic M, Miljkovic D. CXCL12 in control of neuroinflammation[J]. Immunol Res, 2012, 52(1/2): 53-63. DOI: 10.1007/s12026-012-8282-x |
| [18] | Lipfert J, Odemis V, Wagner D C, et al. CXCR4 and CXCR7 form a functional receptor unit for SDF-1/CXCL12 in primary rodent microglia[J]. Neuropathol Appl Neurobiol, 2013, 39(6): 667-680. DOI:10.1111/nan.12015 |
| [19] | Wu Y, Peng H, Cui M, et al. CXCL12 increases human neural progenitor cell proliferation through Akt-1/FOXO3a signaling pathway[J]. J Neurochem, 2009, 109(4): 1157-1167. DOI: 10.1111/j.1471-4159.2009.06043.x |
| [20] | Arnett H A, Mason J, Marino M, et al. TNF alpha promotes proliferation of oligodendrocyte progenitors and remyelination[J]. Nat Neurosci, 2001, 4(11): 1116-1122. DOI:10.1038/nn738 |
| [21] | Barkho B Z, Munoz A E, Li X, et al. Endogenous matrix metalloproteinase (MMP)-3 and MMP-9 promote the differentiation and migration of adult neural progenitor cells in response to chemokines[J]. Stem Cells, 2008, 26(12): 3139-3149. DOI:10.1634/stemcells.2008-0519 |



