白血病是一类白血病细胞增殖失控,分化障碍,凋亡受阻,而停滞在细胞发育的不同阶段的恶性血液肿瘤。化疗曾是治疗急性髓细胞白血病的首选方法,但白血病细胞的耐药现象常导致化疗失败和疾病复发,是目前亟待解决的难题,改变耐药的策略已集中在改变细胞的增殖和促进细胞凋亡的生物治疗方面。Wnt信号是近30年发现的与胚胎发育、细胞增殖和迁移等密切相关的信号通路,其经典Wnt信号通路(Wnt/β-catenin通路)在白血病中的促癌效应已经得到广泛认同[1],但非经典Wnt信号在血液肿瘤中的作用不甚清楚。近年来,国外和我们课题组的一系列研究均充分证明:非经典Wnt信号的重要起始分子——Wnt5a在白血病中是一种抑癌因子,如Wnt5a在白血病患者的骨髓中表达降低,而过表达Wnt5a可抑制白血病细胞的增殖。Wnt5a抑癌机制与其结合了ROR2受体,激活非经典信号通路进而抑制Wnt/β-catenin通路有关。我们进一步研究还发现:Wnt5a可上调ROR2受体;ROR2在白血病病例中表达降低,而在治疗缓解,良性病例和正常人中表达较高[2]。那么ROR2与白血病的发生有何关系?其可能的机制是什么?目前尚不清楚。本研究以慢性髓细胞白血病细胞株K562为模型,过表达ROR2后,观察其对细胞生长的影响,并对可能的机制进行了初步探讨,为深入揭示ROR2在白血病中的作用机制奠定基础,并为寻找白血病治疗新靶点提供依据。
1 材料与方法 1.1 材料与试剂K562细胞为本实验室保存,重组ROR2腺病毒、重组RFP腺病毒由美国芝加哥大学分子肿瘤研究室何通川教授馈赠。ROR2多克隆抗体购自美国Cell Signal Technology公司,β-actin抗体、HRP标记羊抗兔的二抗购自北京中杉金桥公司,增强化学发光显色试剂盒购自美国Pierce公司;7-AAD染色试剂盒及Annexin V购自美国BD公司,流式细胞仪Accuri C6 为美国BD公司生产,Polybrene促转染试剂(美国Sigma公司 ),用PBS液配制为1 mg/mL的工作液,置于-20 ℃ 保存备用。
1.2 方法 1.2.1 细胞培养及转染K562细胞置于含10%的胎牛血清的DMEM培养液中,于37 ℃、5% CO2培养箱内培养,将ROR2腺病毒、RFP腺病毒、Polybrene促转染试剂加入K562中,培养3 d收集细胞后进行后续实验。
1.2.2 CCK-8法测定细胞增殖能力取对数生长期的K562细胞,AdROR2感染K562细胞为实验组,AdRFP感染K562细胞为对照组,每组设3个复孔,分别于感染后的1、2、3、4、5 d收集细胞,向每孔中加入10 μL的CCK-8溶液,将培养板置于37 ℃,5%CO2培养箱内孵育,并采用酶标仪在450 nm处检测各孔的光密度值。
1.2.3 流式细胞仪检测细胞周期变化取对数生长期细胞,AdROR2、AdRFP分别感染细胞30、48 h后离心收集细胞(1 200 r/min,5 min),PBS轻轻重悬并计数,取2×106 /mL,PBS洗2遍,加入75%的乙醇,4 ℃ 固定过夜,PBS再洗2遍,再次离心收集细胞后,加入100 μL的PBS,20 μL的7-AAD染液,混匀,室温避光,反应10~15 min,流式细胞仪检测。实验重复3次。
1.2.4 流式细胞仪检测细胞凋亡取对数生长期细胞,AdROR2、AdRFP分别感染细30、48 h后离心收集细胞(1 200 r/min,5 mim),PBS轻轻重悬并计数,取2×106/mL的细胞密度,PBS洗2遍,加入Binding Buffer溶液100 μL,7-AAD染色试剂10 μL,AnnexinV 2 μL,室温避光10~15 min,于流式细胞仪检测细胞凋亡。实验重复3次。
1.2.5 Western blot检测ROR2对凋亡相关分子表达的影响ROR2腺病毒感染K562细胞为实验组,RFP腺病毒感染K562细胞为对照组,处理3 d后,Western blot 检测ROR2、caspase3 和survivin蛋白表达。分别提取实验组和对照组的总蛋白,上样30 μg,5%脱脂奶粉封闭液封闭,室温封闭1 h,TBST 洗膜后,加1 :1 000稀释的一抗,4 ℃ 孵育过夜,TBST洗去一抗后,加入1 :2 000稀释的二抗,室温孵育1~2 h,TBST洗膜后,用增强型化学发光试剂显色。内参选用β-actin抗体。用Quantity one图像分析软件对条带进行分析。
1.3 统计学分析采用SPSS 19.0统计软件,两样本或两组间的比较采用两样本t检验,检验水准:α=0.05。
2 结果 2.1 外源性ROR2在K562细胞中的表达ROR2腺病毒与RFP腺病毒在Polybrene促转染试剂作用下,成功感染K562细胞,Western blot检测到ROR2蛋白在AdROR2感染的K562细胞中高表达,而AdRFP感染的细胞中未检测到(图 1)。
 |
| 1: AdRFP感染的细胞; 2: AdROR2感染的细胞 图 1 Western blot检测外源性ROR2在K562细胞中的表达 |
CCK-8法检测结果显示:AdROR2感染的细胞明显受到抑制(P<0.05),AdRFP感染的细胞没有明显变化(图 2)。
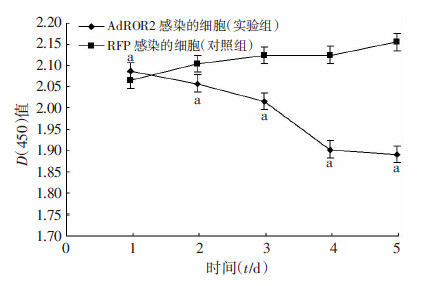 |
| a:P<0.05,与对照组比较 图 2 CCK-8法检测ROR2对细胞增殖的影响 |
流式细胞仪检测结果显示:实验组ROR2感染 K562细胞30 h后,处于G2/M期的细胞比例[(34.95± 0.41)%]高于对照组[(21.26±0.64)%],且随着作用时间的延长,差异更加显著,48 h时实验组处于G2/M期的细胞比例[(59.88±0.25)%]与对照组[(34.96±0.16)%]比较差异具有统计学意义(P<0.05)。提示ROR2可抑制K562细胞增殖,并将其阻滞在G2/M期(图 3)。
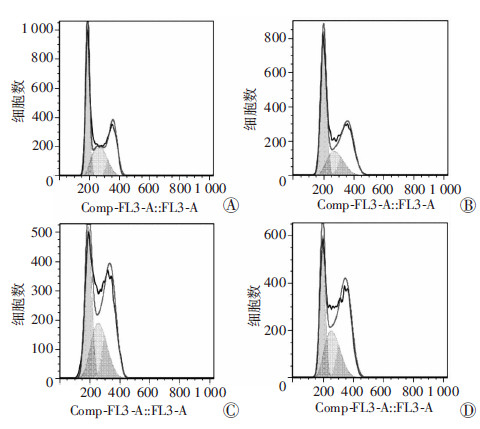 |
| A:AdRFP感染细胞(对照组)30 h;B:AdROR2感染细胞(实验组)30 h;C:AdRFP感染细胞(对照组)48 h;D:AdROR2感染细胞(实验组)48 h 图 3 流式细胞仪检测ROR2对K562细胞周期的影响 |
流式细胞仪检测结果显示:感染30 h,实验组的凋亡率[(6.94±0.34)%]略高于对照组[(6.24±0.44)%];感染48 h,实验组的凋亡率[(13.52±0.48)%]明显高于对照组[(10.71±0.50)%],差异具有统计学意义(P<0.05,图 4)。
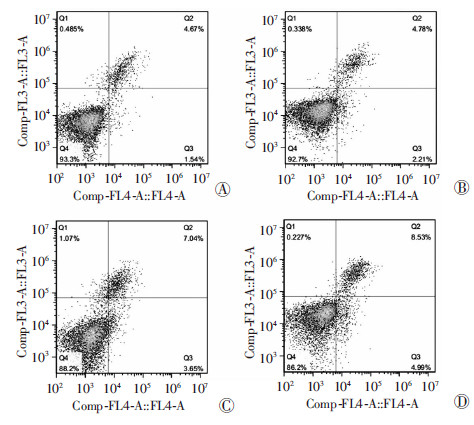 |
| A:AdRFP感染细胞(对照组)30 h;B:AdROR2感染细胞(实验组)30 h;C:AdRFP感染细胞(对照组)48 h;D:AdROR2感染细胞(实验组)48 h 图 4 流式细胞仪检测ROR2对K562细胞凋亡的影响 |
与对照组比较,过表达ROR2上调了caspase3的表达[1.12±0.03 vs 0.56±0.04,P<0.05],但下调了survivin表达[0.45±0.06 vs 1.22±0.06,P<0.05,图 5]。
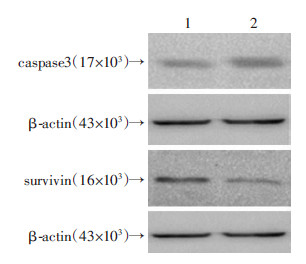 |
| 1:AdRFP感染的细胞(对照组);2:AdROR2感染的细胞(实验组) 图 5 Western blot检测ROR2对K562细胞中caspase3和 survivin蛋白表达的影响 |
孤儿受体ROR是酪氨酸激酶样受体(receptor tyrosine kinase-like orphan receptor ROR),是Ⅰ型酪氨酸激酶受体(receptor tyrosine kinase,RTK)家族中的成员,它参与细胞间信号交流和胞内信号传导等,调节细胞增殖、分化、转移和存活。由于ROR最初发现时配体未知,所以被定义为孤儿受体[3]。孤儿受体ROR家族含有两大成员——ROR1和ROR2。在慢性淋巴细胞白血病中,ROR1被认为具有致癌效应,是一致癌因子[4]。近来ROR2在多种肿瘤中的作用已有报道,如在骨肉瘤[5]、宫颈癌[6]、肾细胞癌[7]、黑色素瘤[7, 8]中ROR2表达上调,它可促进肿瘤迁移和进展,是一种促癌因子。但在鼻咽癌、胃癌[8]中表达下调,表现出抑癌因子的作用。这可能与ROR2能够结合不同的配体、转导不同的信号通路有关。如在293细胞中,ROR2与Wnt5a结合转导Wnt5a/ROR2非经典信号通路,抑制Wnt/β-catenin信号转导,阻断β-catenin下游基因的表达[9],如C-myc和Cyclin D1。ROR2与Wnt5a结合可激活钙离子途径(CamKⅡ)来抑制Wnt/β-catenin的途径[10]。在小鼠体内,敲降ROR2基因后,Wnt/β-catenin信号通路被激活,充分证明了ROR2对Wnt经典通路具有抑制作用。但ROR2在白血病中的作用和机制至今尚未探明。
我们前期研究发现Wnt5a在白血病中是抑癌因子[11],在K562细胞中Wnt5a可上调ROR2受体,并优先与之结合,进而转导非经典通路来抑制经典通路,发挥抑制细胞增殖的作用。随后在髓系白血病骨髓标本检测中发现ROR2表达降低,而在治疗缓解病例、良性病例和正常人中表达较高。本研究采用Polybrene增强重组ROR2腺病毒感染细胞的方法[12],获得过表达ROR2的细胞模型,研究发现ROR2对K562细胞生长不但具有抑制作用,细胞周期阻滞在G2/M期,而且发生了细胞凋亡现象,这是我们以前期Wnt5a抑制K562细胞增殖中没有观察的[11]。这似乎提示:ROR2比Wnt5a有更强的抑癌作用?是否ROR2除了结合Wnt5a外,还可募集其他抑癌因子,发挥更强的抗癌作用呢?还有待进一步研究。我们还对ROR2诱导K562细胞凋亡的机制进行了初步的探讨。细胞凋亡可通过死亡受体凋亡途径、线粒体凋亡途径和内质网凋亡三条途径发挥作用,三条凋亡通路均需caspase的参与,caspase家族作为最终执行者,在细胞凋亡过程中通过对骨架蛋白的剪切,引起细胞核固缩、碎裂等,其中caspase3是以上两种途径的共同交汇点[13, 14, 15]。survivin是凋亡抑制因子(inhibitor of apoptosis proteins,IAPs)家族成员,它在抗凋亡效应中具有重要作用,它主要通过线粒体细胞色素C的释放和天冬氨酸特异的半胱氨酸蛋白酶(caspase)的激活 [16]。本研究主要选择了这两个靶分子,初步研究表明:ROR2上调了促凋亡蛋白caspase3的表达,下调了抗凋亡蛋白survivin的表达,但mRNA水平变化不明显,这是否提示ROR2参与调控二者的翻译水平,而对转录水平影响不明显。其具体的机制还待进一步研究。本研究对寻找白血病新的治疗靶点和研发新的诊断标志物具有重要价值,也为进一步探讨ROR2抑制白血病的作用和机制奠定了基础。
| [1] | Coluccia A M,Vacca A,Dunach M,et al.Bcr-Abl stabilizes beta-catenin in chronic myeloid leukemia through its tyrosine phosphorylation[J].EMBO J,2007,26(5): 1456-1466.DOI: 10.1038/sj.emboj.7601485 |
| [2] | Deng G,Li Z Q,Zhao C,et al.WNT5A expression is regulated by the status of its promoter methylation in leukaemia and can inhibit leukemic cell malignant proliferation[J].Oncol Rep,2011,25(2): 367-376.DOI: 10.3892/or.2010.1108 |
| [3] | Forrester W C.The Ror receptor tyrosine kinase family.Cell Mol Life Sci,2002,59(1): 83-96. |
| [4] | Widhopf G F 2nd,Cui B,Ghia E M,et al.ROR1 can interact with TCL1 and enhance leukemogenesis in Eμ-TCL1 transgenic mice[J].Proc Natl Acad Sci USA,2014,111(2): 793-798.DOI: 10.1073/pnas.1308374111 |
| [5] | Morioka K,Tanikawa C,Ochi K,et al.Orphan receptor tyrosine kinase ROR2 as a potential therapeutic target for osteosarcoma[J].Cancer Sci,2009,100(7): 1227-1233.DOI: 10.1111/j.1349-7006.2009.01165.x |
| [6] | Sun B,Ye X,Lin L,et al.Up-regulation of ROR2 is associated with unfavorable prognosis and tumor progression in cervical cancer[J].Int J Clin Exp Pathol,2015,8(1): 856-861. |
| [7] | Rasmussen N R,Wright T M,Brooks S A,et al.Receptor tyrosine kinase-like orphan receptor 2(Ror2)expression creates a poised state of Wnt signaling in renal cancer[J].J Biol Chem,2013,288(36): 26301-26310.DOI: 10.1074/jbc.M113.466086 |
| [8] | Li L,Ying J,Tong X,et al.Epigenetic identification of receptor tyrosine kinase like orphan receptor2 as a functional tumor suppressor inhibiting β-catenin and AKT sigaling but frequently methylated in commom carcinomas[J].Cell Mol Life Sci,2013,71(11): 2179-92.DOI: 10.1007/s00018-013-1485-z |
| [9] | Mikels A J,Nusse R.Purified Wnt5a protein activates or inhibits beta-catenin-TCF signaling depending on receptor context[J].PLoS Biol,2006,4(4): e115.DOI: 10.1371/journal.pbio.0040115 |
| [10] | Oishi I,Suzuki H,Onishi N,et al.The receptor tyrosine kinase Ror2 is involved in non-canonical Wnt5a/JNK signalling pathway[J].Genes Cells,2003,8(7): 645-654. |
| [11] | Yuan Y,Niu C C,Deng G,et al.The Wnt5a/Ror2 noncanonical signaling pathway inhibits canonical Wnt signaling in K562 cells[J].Int J Mol Med,2011,27(1): 63-69.DOI: 10.3892/ijmm.2010.560 |
| [12] | Zhao C,Wu N,Deng F,et al.Adenovirus-mediated gene transfer in mesenchymal stem cells can be significantly enhanced by the cationic polymer polybrene[J].PLoS One,2014,9(3): e92908.DOI: 10.1371/journal.pone.0092908 |
| [13] | 王会玲,李燕,田军,等.力竭运动对大鼠肾小管凋亡和缺氧诱导因子-1α表达的影响及人参总皂苷干预研究[J].解放军医学杂志,2014,39(2): 161-166. |
| [14] | 于光艳,宋祥福,赵淑华,等.苯通过激活线粒体凋亡通路对小鼠骨髓细胞凋亡的诱导作用及其机制[J].吉林大学学报:医学版,2014,40(5): 943-946. |
| [15] | Rubio N,Garcia-Segura L M,Arevalo M A.Survivin prevents apoptosis by binding to caspase-3 in astrocytes infected with the BeAn strain of Theiler’s murine encephalomyelitis virus[J].J Neurovirol,2012,18(5): 354-363.DOI: 10.1007/s13365-012-0112-3 |
| [16] | Dohi T,Beltrami E,Wall N R,et al.Mitochondrial survivin inhibits apoptosis and promotes tumorigenesis[J].J Clin Invest,2004,114(8): 1117-1127.DOI: 10.1172/JCI22222 |



