microRNA通过与基因的3′UTR片段结合来调控基因的表达,参与细胞生长、凋亡等多个生理过程。近年来,已报道了一系列参与胃癌发生和发展的miRNAs,如miR-25、miR-141和miR-29c等[1, 2, 3]。我们在前期研究中,证实microRNA-30(miR-30)家族中的miR-30b在胃癌中低表达,且能够参与调控胃癌细胞的凋亡,然而对于miR-30家族的另一重要成员miR-30a的表达和功能仍需深入研究。
成纤维活化蛋白α(fibroblast activation protein α,FAPα)是一种具有明胶酶活性的膜型丝氨酸酶。其具有降解细胞外基质、促进肿瘤细胞的侵袭、转移等作用。Baird等[4]研究发现FAPα在体外实验中不仅可以与整合素相互作用增强HT1080细胞的转移能力,同时还可调节整合素下游的胞内信号通路。而在LX-2细胞中过表达FAPα,除可引起星形孢菌素诱导的凋亡增强,也可引起该细胞在细胞外基质蛋白上的粘附和迁移增加[5]。由此可见,FAPα在肿瘤中发挥的作用不容忽视,尤其是在肿瘤的侵袭转移过程中。但目前有关FAPα在胃癌中的具体作用及相关机制尚不清楚。因此,本研究检测胃癌中miR-30a的表达情况,采用生物信息学方法预测到miR-30a的靶基因FAPα,并开展了相应的验证实验,为后续探究关于miR-30a在胃癌中的作用提供基础。
1 材料与方法 1.1 仪器与试剂人胃腺癌细胞株SGC-7901、人胚肾细胞HEK293和pMIR-REPORT为本室保存;RPMI 1640培养基购于美国Hyclone公司;FBS购于美国GIBCO公司;TRIzol Reagent、转染试剂购于Invitrogen公司;SYBR Green Realtime PCR Master Mix购于日本TOYOBO公司;dNTP Mix和荧光素酶购于Pomega公司;BCA蛋白定量试剂盒购于Thermo Scientific公司;PVDF膜购于美国Bio Rad公司;FAPα一抗购于美国Abcam公司;GAPDH一抗购于天津三箭生物技术有限公司;辣根过氧化物酶标记二购于北京中杉金桥公司;ChemiDocTMXRS+仪器(美国Bio Rad公司);SpectraL Max190仪器(Molecular Device)。
1.2 临床样本来源所用临床样本来自于第三军医大学西南医院普外科进行手术治疗的胃癌患者,术中取出胃癌组织和癌旁正常组织(癌旁组织距肿瘤边缘>5 cm),于液氮中冻存。术后取病理切片,经鉴定为胃腺癌组织共29例,其中Ⅰ期3例,Ⅱ期9例和Ⅲ期17例。
1.3 方法 1.3.1 细胞培养 人胃腺癌细胞株SGC-7901和人胚肾细胞HEK293分别用含10%FBS的RPMI 1640和DMEM/H,在5%CO2、37 ℃培养箱中培养。 1.3.2 总RNA提取将癌旁正常组织和胃癌组织从液氮中取出后,于DEPC处理后的匀浆器中按比例50 mg/mL加入Trizol。后续步骤按照说明书操作,最后用50 μL DEPC水溶解总RNA,-80 ℃保存。
1.3.3 qRT-PCR反应按照加Ploy A尾法加入总RNA、RNase Inhibitor等试剂于PCR仪上反应,反应条件为65 ℃,5 min。在第一步产物中加入相应逆转录试剂,PCR仪上反应50 ℃,90 min;70 ℃,15 min。反应完成后加入120 μL Tricine-EDTA buffer稀释产物。以cDNA为模板,加入miR-30a引物等试剂进行qPCR反应,反应条件为95 ℃,2 min;40个循环于95 ℃,10 s;48 ℃,10 s;72 ℃,20 s,在65 ℃采集荧光。以U6为内参。
1.3.4 miR-30a的靶基因预测根据靶基因预测数据库TargetScan,在网站http://mirbase.org/上预测mir-30a的靶基因。
1.3.5 双荧光素酶报告基因载体的构建根据NCBI上查找FAPα(NM_004460.3)3′UTR序列,设计合成退火引物。退火引物序列上游: 5′-CTAGTGGGCCCCA-GAAGTTCAAGCTAAATATTGTTTACATTTTCTGGTACTC-TGTGA-3′;下游:5′-AGCTTCACAGAGTACCAGAAAATGTAAACAAT ATTTAGCTTGAACTTCTGGGGCCCA-3′。反应条件为95 ℃,2 min;每8秒下降0.1 ℃;至25 ℃。用SpelⅠ和HindⅢ双酶切pMIR-REPORT载体;然后4 ℃连接酶切后载体与退火产物过夜;转化大肠杆菌DH5α,挑取阳性克隆进行扩增;提取质粒并测序鉴定。
1.3.6 双荧光素酶报告实验在96孔板中将miR-30a mimic/mimic control与已构建好的FAPαWT 3′UTR Luciferase repoter或FAPαMut3′UTR Luciferase repoter及pRL-TK共转染HEK293细胞。各孔miR-30a/mimic control转染终浓度为50 nmol/L,pRL-TK载体为10 ng,pMIR-REPORT载体为200 ng。按照Lipofectamine LTX and Plus Reagent说明书进行转染。24 h后用Dual Luciferase Assay System裂解细胞,进行荧光素酶活性检测。采用海肾荧光素酶作为内参,结果用萤火虫荧光素酶相对活性表示。
1.3.7 Western blot检测收集转染后细胞,RIPA提取总蛋白;经BCA法测定总蛋白浓度,取30 μg蛋白样品上样,经SDS-PAGE电泳分离;蛋白分离后将其转移至PVDF膜上,洗膜后用含0.3%BSA封闭液室温封闭1 h;缓冲液洗膜,加入FAPα一抗,4 ℃孵育过夜;缓冲液洗膜,室温下孵育二抗(辣根过氧化物酶山羊抗小鼠)1 h;缓冲液洗膜,将PVDF膜置于ChemiDocTMXRS+仪器上,加入显色液,运行系统检测荧光。
1.4 统计学方法实验数据采用GraphPad 6.0软件进行分析;计量资料数据以x±s表示,多组数据比较采用单因素方差分析,两组数据比较采用t检验,临床样本数据资料服从正态分布,P<0.05差异有统计学意义。
2 结果 2.1 miR-30a在胃癌组织中低表达将收集所得胃癌及癌旁正常组织共29对样本分别提取总RNA。以U6作为内参,经qRT-PCR反应对miR-30a的表达水平进行检测。结果显示,miR-30a在胃癌组织中的表达水平(0.98±0.85)低于正常组织(2.01±1.86)(P<0.05)。结合患者临床资料分析,胃癌Ⅲ期患者miR-30a水平(0.64±0.46)显著低表达于Ⅰ+Ⅱ期患者(1.47±1.05)(P<0.05)。然而,miR-30a的表达水平与患者的年龄、淋巴结转移情况无明显相关性(表 1)。
| 临床因素 | 例数 | miR-30a表达 | P值 |
| 年龄 | 0.69 | ||
| ≤50岁 | 10 | 0.91±0.94 | |
| >50岁 | 19 | 1.03±0.84 | |
| 临床分期 | <0.05 | ||
| Ⅰ+Ⅱ期 | 12 | 1.47±1.05 | |
| Ⅲ期 | 17 | 0.64±0.46 | |
| 淋巴结转移 | 0.52 | ||
| 无 | 7 | 0.80±0.90 | |
| 有 | 22 | 1.04±0.84 |
经靶基因预测软件TargetScan分析发现,FAPα3′UTR区存在与miR-30a结合的互补序列。因此,选取FAPα作为miR-30a的候选靶基因。图 1中FAPα3′UTR WT竖线部分即为miR-30a靶向结合FAPα3′UTR序列。FAPα3′UTR Mutant为突变后的FAPα3′UTR与miR-30a互补结合序列。
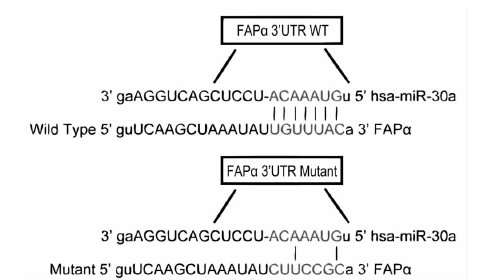 |
| 图 1 miR-30a作用于FAPα3′UTR互补区域 |
将miR-30a mimic或mimic control、pMIR-FAPα或pMIR-FAPα-mut及对照质粒pRL-TK共转染96孔板中HEK293细胞,24 h后裂解细胞进行荧光素酶活性检测。图 2结果显示,miR-30a和pMIR-FAPα共转染组相对荧光素酶活性较阴性对照组受到明显抑制(n=4,P<0.05),表明miR-30a可与FAPα的3′UTR区结合,FAPα是miR-30a的靶基因。
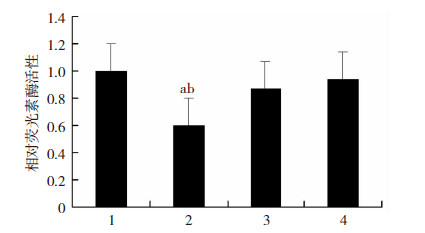 |
| 1:对照模拟物+FAPα3′UTR野生型;2:miR-30a模拟物+FAPα3′UTR野生型;3:对照模拟物+FAPα3′UTR突变型;4:miR-30a模拟物+FAPα3′UTR突变型 a:P<0.05,与对照模拟物+FAPα3′UTR野生型组比较;b:P<0.05,与对照模拟物+FAPα3′UTR突变型组比较图 2 miR-30a mimic抑制FAPα3′UTR野生型荧光素酶活性 |
将SGC-7901细胞接种于6孔板上,分别转染miR-30a mimic和mimic control。24 h后提取总RNA经qRT-PCR检测其mRNA表达水平,48 h后提取总蛋白经Western blot进行检测。结果显示,miR-30a过表达组的FAPα mRNA水平(0.96±0.03)较对照组(1.13±0.07)明显降低(P<0.05);同样,过表达miR-30a显著抑制FAPα蛋白的表达(P<0.05,图 3)。提示miR-30a能够调控靶基因FAPα的表达。
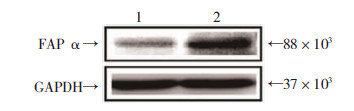 |
| 1:miR-30a模拟物,2:对照模拟物图 3 过表达miR-30a抑制FAPαmRNA和蛋白质表达水平 |
胃部肿瘤的形成过程中抑癌基因和致癌基因的改变及其遗传表观学的改变都与胃癌的发生密切相关。就目前关于miR-30家族与肿瘤的报道,多数研究表明其发挥抑癌作用[6]。Zhang等[7]研究发现miR-30c在结肠癌中表达下调,通过靶向调控ADAM19的表达可抑制肿瘤细胞的生长和转移。而后,其研究团队又发现miR-30a与结肠癌的临床分期相关,并且其不仅可以通过对靶基因IRS2表达的抑制作用抑制结肠癌细胞的增殖和转移,同时,还可以抑制Akt的磷酸化水平[8]。然而,miR-30b/d被报道在黑色素瘤中具有促进侵袭转移的作用[9]。我们在前期研究中,通过基因芯片筛选出了胃癌组织中表达差异的基因,芯片结果显示FAPα在胃癌组织中表达上调[1, 3]。本研究通过对29对胃癌患者临床样本进行检测分析,结果显示miR-30a在胃癌组织中较癌旁正常组织明显降低,并且Ⅲ期患者胃癌组织中miR-30a的表达显著低于Ⅰ+Ⅱ期患者,提示miR-30a在胃癌的发展中可能发挥着抑制肿瘤的作用。这与之前有研究报道称,miR-30a在胃癌可能起着保护性microRNA的作用这一结果相吻合,并且该研究指出联合检测其他6个microRNA的表达水平可预测胃癌患者的预后[10]。因此,miR-30a可能在胃癌的发生与发展过程中发挥重要的调控作用。
FAPα主要表达在人上皮性肿瘤的成纤维细胞中,但研究发现其在乳腺癌细胞系、肿瘤相关巨噬细胞等细胞中也有表达[11, 12],并且越来越多的研究证实FAPα与恶性肿瘤的形成和发展密切相关。FAPα起着促进肿瘤和抑制肿瘤的双重作用。FAPα在口腔鳞状细胞癌细胞的表达水平与患者肿瘤体积大小、淋巴结转移和临床分期密切相关。通过对FAPα基因的沉默或敲除可抑制肿瘤细胞的增殖和侵袭转移[13]。Misemer等[14]在检测侵袭性纤维瘤患者组织样本时发现,FAPα、WISP1及ADAM12的高表达和SOX11的低表达的患者预后较差。在乳腺癌临床样本检测分析中,FAPα的表达水平与患者的存活期呈负相关[11]。在本实验室前期通过胃癌组织样本芯片结果发现FAPα在胃癌组织中表达上调,并结合生物信息学方法预测FAPα3′UTR有miR-30a互补结合序列。因此,本研究在胃癌中验证FAPα为miR-30a的靶基因,通过mircroRNA对靶基因的靶向作用这一思路来阐明FAPα参与胃癌发生、发展的机制。
| [1] | Li B S, Zuo Q F, Zhao Y L, et al. MicroRNA-25 promotes gastric cancer migration, invasion and proliferation by directly targeting transducer of ERBB2, 1 and correlates with poor survival[J]. Oncogene, 2015, 34(20): 2556-2565. DOI:10.1038/onc.2014.214 |
| [2] | Han T S, Hur K, Xu G, et al. MicroRNA-29c mediates initiation of gastric carcinogenesis by directly targeting ITGB1. Gut[J], 2015, 64(2): 203-214. DOI:10.1136/gutjnl-2013-306640 |
| [3] | Zuo Q F, Zhang R, Li B S, et al. MicroRNA-141 inhibits tumor growth and metastasis in gastric cancer by directly targeting transcriptional co-activator with PDZ-binding motif, TAZ[J]. Cell Death Dis, 2015, 6: e1623. DOI:10.1038/cddis.2014.573 |
| [4] | Baird S K, Allan L, Renner C, et al. Fibroblast activation protein increases metastatic potential of fibrosarcoma line HT1080 through upregulation of integrin-mediated signaling pathways[J]. Clin Exp Metastasis, 2015, 32(5): 507-516. DOI:10.1007/s10585-015-9723-4 |
| [5] | Wang X M, Yu D M, McCaughan G W, et al. Fibroblast activation protein increases apoptosis, cell adhesion, and migration by the LX-2 human stellate cell line[J]. Hepatology, 2005, 42(4): 935-945. DOI:10.1002/hep.20853 |
| [6] | Kao C J, Martiniez A, Shi X B, et al. miR-30 as a tumor suppressor connects EGF/Src signal to ERG and EMT[J]. Oncogene, 2014, 33(19): 2495-2503. DOI:10.1038/onc.2013.200 |
| [7] | Zhang N, Wang X, Huo Q, et al. MicroRNA-30a suppresses breast tumor growth and metastasis by targeting metadherin[J]. Oncogene, 2014, 33(24): 3119-3128. DOI:10.1038/onc.2013.286 |
| [8] | Zhang Q, Tang Q, Qin D, et al. Role of microRNA 30a targeting insulin receptor substrate 2 in colorectal tumorigenesis[J]. Mol Cell Biol, 2015, 35(6): 988-1000. DOI:10.1128/MCB.01242-14 |
| [9] | Gaziel-Sovran A, Segura M F, Di M R, et al. miR-30b/30d regulation of GalNAc transferases enhances invasion and immunosuppression during metastasis[J]. Cancer Cell, 2011, 20(1): 104-118. |
| [10] | Li X, Zhang Y, Zhang Y, et al. Survival prediction of gastric cancer by a seven-microRNA signature[J]. Gut, 2010, 59(5): 579-585. DOI:10.1136/gut.2008.175497 |
| [11] | Jia J, Martin T A, Ye L, et al. FAP-alpha (Fibroblast activation protein-alpha) is involved in the control of human breast cancer cell line growth and motility via the FAK pathway[J]. BMC Cell Biol, 2014, 15: 16. |
| [12] | Tchou J, Zhang P J, Bi Y, et al. Fibroblast activation protein expression by stromal cells and tumor-associated macrophages in human breast cancer[J]. Hum Pathol, 2013, 44(11): 2549-2557. DOI:10.1016/j.humpath.2013.06.016 |
| [13] | Wang H, Wu Q, Liu Z, et al. Downregulation of FAP suppressed cell proliferation and metastasis through PTEN/PI3K/AKT and Ras-ERK signaling in oral squamous cell carcinoma[J]. Cell Death Dis, 2014, 5:e1155. |
| [14] | Misemer B S, Skubitz A P, Carlos-Manivel J, et al. Expression of FAP, ADAM12, WISP1, and SOX11 is heterogeneous in aggressive fibromatosis and spatially relates to the histologic features of tumor activity[J]. Cancer Med, 2014, 3(1): 81-90. DOI:10.1002/cam4.160 |



