Barrett食管(Barrett’s esophagus,BE)是指食管下段鳞状上皮被柱状上皮取代的一种病理现象,是食管腺癌的癌前病变。一般认为BE的发生与胃食管反流病( gastroesophageal reflux disease,GERD) 所导致的长期胆酸刺激有关[1]。国外亦有文献报道体外培养的正常食管鳞状上皮细胞经脱氧胆酸(deoxycholic acid,DCA)处理后,表达肠道柱状上皮细胞表型,但其具体分子机制尚未明确[2]。Krüppel样锌指转录因子4(Krüppel-like factor 4,KLF4) 参与早期胚胎发育,在胃肠道形态发生、肠道黏膜生成以及功能的发挥过程中起重要作用[3, 4]。尾型同源异型框转录因子2(caudal-related homeodomain transcription factor 2,CDX2)属于果蝇尾部相关同源基因家族成员,参与细胞的增殖和分化,在胚胎发育调控中亦非常重要[5]。因此,我们推测KLF4和CDX2共同参与BE的发生和发展。本研究采用免疫组化方法观察KLF4、CDX2在不同组织中的表达;使用Real-time PCR、Western blot分别检测经过DCA处理不同时间、siRNA干扰及慢病毒过表达KLF4后,正常食管鳞状上皮Het-1A细胞KLF4、CDX2及粘蛋白2(Mucin2,MUC2)的表达变化,旨在探索KLF4与CDX2在BE发生中的作用及相互关系,为更深入认识BE提供新的线索。
1 材料与方法 1.1 材料与试剂 1.1.1 组织与细胞选取西南医院2012年3-12月的71例消化内科门诊患者,其中男性37例,女性34例,平均年龄50.94(35~65)岁。纳入标准:BE患者的诊断均符合中华医学会消化病学分会Barrett食管诊治共识修订的标准。共制作49例正常食管组织标本、22例 Barrett食管组织标本。病例均有完整的病历资料,并且均经病理检查证实。标本的搜集均获得患者同意并签署知情同意书,通过医院伦理委员会批准。永生化的正常食管鳞状上皮Het-1A细胞株购于美国细胞菌种库(ATCC) 。
1.1.2 主要试剂BEBM培养基购自Lonza公司,TRIzol试剂购自Invitrogen公司(15596-026),逆转录、实时荧光定量PCR试剂盒购于本TaKaRa公司(RR047A、RR820A),引物购于生工公司,全蛋白提取试剂盒购于凯基公司(KGP250),一抗(兔抗人) KLF4、CDX2、MUC2单克隆抗体购自美国Abcam公司,GADPH多克隆抗体以及二抗均购自北京中杉金桥生物技术有限公司,化学发光液购于Thermo scientific公司,KLF4过表达慢病毒购于吉凯公司,KLF4的干扰siRNA购于吉玛公司。
1.2 方法 1.2.1 免疫组化取材后立即中性福尔马林固定,石蜡包埋,连续切片,染色、封片,采用免疫组化S-P法,分别检测正常鳞状上皮组和BE组样本各基因的表达。KLF4的工作浓度为1 :100,CDX2的工作浓度为1 :150,以PBS作为阴性对照,用光镜观察结果。阳性标准:在人体组织中,KLF4阳性颗粒定位于细胞核,CDX2阳性颗粒定位于细胞核,两者出现棕褐色颗粒为免疫组化阳性。由2名病理医师双盲独立阅片,根据每张切片染色强度及阳性细胞数确定表达程度。具体标准:①根据染色强度:无着色为0分,黄色为1分,棕黄色为2分,棕褐色为3分。②根据阳性细胞数:<5%为0分,5%~25%为1分,25%~50%为2分,>50%为3分。等级评分:<2分为阴性(-),2~3分为弱阳性(+),3~5分为阳性(+ +),>5分为强阳性(+ + +),为便于统计分析,将(+)、(+ +)、(+ + +)定义为阳性表达。
1.2.2 细胞培养采用BEBM培养基常规培养Het-1A细胞。
1.2.3 DCA处理细胞取生长状态良好的Het-1A细胞接种6孔板,分为4组:DCA处理4、8、12 h组和对照组(0 h组,未加DCA),每组设计3孔,每孔加入2 mL 无抗生素的DMEM完全培养基。待新接种的细胞长到80%时,更换新培养基。 为了模拟体内胃食管反流对食管上皮细胞的影响,我们向体外培养的细胞中加入200 μL的DCA(200 μmol/L),分别处理4、8、12 h。
1.2.4 KLF4的干扰siRNA转染细胞以GenBank收录的KLF4基因序列(NM_004235)作为分析序列,分别设计3对不同的siRNA干扰序列(表 1)。正常培养Het-1A细胞至密度为70%,筛选实验设5组:正常对照组(未经任何处理)、阴性对照组(转染阴性对照siRNA)、KLF4-siRNA1组和KLF4-siRNA2组和KLF4- siRNA3组。转染操作按转染试剂说明书,分组转染48 h后看荧光确认转染成功,随后提蛋白,应用Western blot 检测KLF4蛋白表达的差异。根据Western blot检测结果,选择一种干扰效果最佳的siRNA进行后续正式干扰实验,正式干扰实验设计5组:空白对照组(未加处理)、阴性对照组(转染阴性对照siRNA)、阴性DCA处理组(转染阴性对照siRNA并用DCA处理12 h)、 KLF4-siRNA组(转染干扰效果最佳的KLF4-siRNA组),KLF4-siRNA DCA处理组(转染效果最佳的KLF4-siRNA组并用DCA处理12 h),每组设3个副孔,继续培养36 h,并向阴性对照DCA处理组、KLF4-siRNA DCA处理组分别加入200 μL的DCA(200 μmol/L),处理12 h。再用Rea1-time PCR和Western blot检测各基因表达。
| 组别 | 序列 | 片段大小(bp) |
| KLF4-siRNA1序列 | 正义链:5′-GAAAUUCGCCCGCUCAGAUTT-3′ 反义链:5′-CTTTGGTATCGTGGAAGGACTC-3′ | 21 |
| KLF4-siRNA2序列 | 正义链5′- GACCAGAAUUCCCUUGAAUTT-3′ 反义链: 5′-AUUCAAGGGAAUUCUGGUCTT-3′ | 21 |
| KLF4-siRNA3序列 | 正义链:5′-GGUGAGUCUUGGUUCUAAATT-3′ 反义链:5′-UUUAGAACCAAGACUCACCTT-3′ | 21 |
| 阴性对照序列 | 正义链:5′-UUCUCCGAACGUGUCACGUTT-3′ 反义链:5′-UUUAGAACCAAGACUCACCTT-3′ | 21 |
转染前24 h将Het-1A细胞接种至24孔板上,当细胞密度至30%~50%时,按感染复数(MOI)分别为 5、10、30、50加入LV-KLF4重组慢病毒,为提高转染效率每孔加入8 μg/mL 的polybrene提高转染效率,置于5%CO2的37 ℃孵箱中孵育,12 h后换液,继续培养2 d,用倒置荧光显微镜观察绿色荧光蛋白的表达情况。 根据不同MOI值所对应细胞的荧光表达强度估算慢病毒感染效率,确定最佳MOI值为10,依据此MOI正式转染细胞,48 h后传代并加入1 μg/mL嘌呤霉素筛选。通过镜下观察细胞内绿色荧光蛋白表达情况,初步判断筛选结果,并通过Western blot验证经过筛选的Het-1A细胞是否稳定表达KLF4蛋白。利用稳定表达KLF4的细胞进行后续实验,实验设计4组:空白对照组(未加处理)、阴性对照组(转染阴性对照病毒)、阴性DCA处理组(转染阴性对照病毒并用DCA处理12 h)、阳性组(转染LV-KLF4重组慢病毒),每组设3个副孔。待细胞长到50%时,更换新培养基,然后按MOI为10、向阴性对照组、阴性对照DCA处理组、阳性组中加入对应病毒和8 μg/mL的转染增强液polybrene,12 h后换液,继续培养24 h,并向阴性对照DCA处理组加入200 μL的DCA(200 μmol/L),处理12 h。再用Rea1-time PCR和Western blot检测各基因表达。
1.2.6 Rea1-time PCR检测各组细胞KLF4、CDX2的mRNA表达使用TRIzol试剂提取各实验组细胞的 总RNA,并利用紫外分光光度计检测其纯度和浓度,按照逆转录试剂盒所列步骤,将RNA逆转录成cDNA,每组样本设3个副孔,按照Rea1-time PCR检测试剂盒SYBR Green法说明书加样并进行测定,PCR仪器条件设定如下:95 ℃ 预变性1 min 30 s;95 ℃变性5 s,57 ℃ 退火30 s,扩增40个循环。各基因引物信息见表 2。
| 基因 | 引物序列 | 扩增片段长度(bp) |
| KLF4 | 上游5′-GGAGAGAGACCGAGGAGTTCA-3′ 下游 5′-ACGACGAAGAGGAGGCTGAC-3′ | 126 |
| CDX2 | 上游 5′-GGAACCTGTGCG AGTGGATG-3′ 下游 5′-CGGATGGTGATGTAGCGACTGTA-3′ | 115 |
| MUC2 | 上游 5′-GCTGCTATGTCGAGGACACC-3′ 下游 5′-GGGAGGAGTTGGTACACACG-3′ | 115 |
| GAPDH | 上游 5′-GTAGAGGCAGGGATGATGTTCT-3′ 下游 5′-CTTTGGTATCGTGGAAGGACTC-3′ | 132 |
各组实验结束后,常规方法提取总蛋白,测浓度、上样、跑胶、转膜和封闭,依次加入CDX2和KLF4一抗(稀释倍数均为1 :1 000),GAPDH一抗(稀释倍数为1 :1 500),4 ℃孵育过夜。TBST漂洗3次后,加入对应辣根过氧化物偶联的二抗(稀释倍数1 :5 000),孵育2 h后,再用TBST漂洗3次,应用化学荧光法检测目的蛋白表达强度。采用Image Lab软件分析图像。
1.3 统计学分析数据以x±s表示,采用SPSS 17.0统计软件,组间比较采用单因素方差分析,构成比之间的比较采用χ2检验。
2 结果 2.1 CDX2、KLF4在正常食管和BE组织中的表达49例正常食管组织中,KLF4阴性表达41例,阳性8例,阳性率16.33%,阳性染色主要集中在胞核;CDX2阴性表达42例,阳性7例,阳性率14.29%,阳性染色也主要集中在胞核。22例BE组织中,KLF4阴性表达7例,阳性15例,阳性率68.18%,阳性染色主要集中在胞核;CDX2阴性表达6例,阳性16例,阳性率72.73%,阳性染色也主要集中在胞核。BE组织中KLF4和CDX2的阳性率均高于正常食管组织(χ2=18.642,P<0.05;χ2=23.678,P<0.05;图 1)。
 |
| A:KLF4在正常食管组织中的表达;B:KLF4在BE组织中的表达;C:CDX2在正常食管组织中的表达;D:CDX2在BE组织中的表达 图 1 免疫组织化学检测KLF4和CDX2在不同组织中的表达和分布 (S-P ×400) |
在mRNA和蛋白水平,KLF4、CDX2、MUC2表达均随DCA处理时间的增加而升高,且较对照组差异具有统计学意义(P<0.05,图 2、3)。
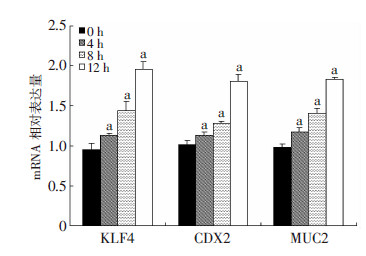 |
| a: P<0.05,与0 h(对照组)比较 图 2 Real-time PCR检测DCA处理Het-1A细胞各时间点 KLF4、CDX2、MUC2 mRNA的表达 |
 |
| A:Western blot检测;B:半定量分析 a: P<0.05,与0 h(对照组)比较 图 3 Western blot检测DCA处理Het-1A细胞各时间点 KLF4、CDX2、MUC2 蛋白质的表达 |
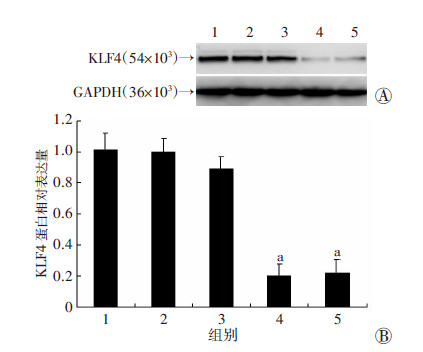
转染48 h后,Western blot 检测结果显示:KLF4-siRNA2 组对KLF4的干扰效果最佳,空白对照组和阴性对照组之间差异无统计学意义(图 4)。根据筛选实验结果,选择KLF4-siRNA2干扰KLF4基因的表达,进行后续正式干扰实验。
 |
|
1:空白对照组;2:阴性对照组;3:KLF4-siRNA1组;4:KLF4-siRNA2组;5:KLF4-siRNA3组 A:Western blot检测;B:半定量分析 a:P<0.05,与阴性对照组比较 图 4 Western blot检测干扰KLF4对CDX2和MUC2 表达的影响 |
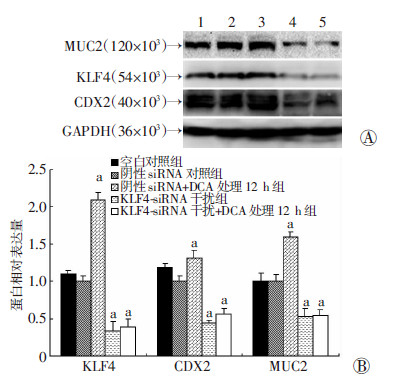
将干扰效果最明显的KLF4-siRNA2(后表述为KLF4-siRNA)转染Het-1A细胞,48 h后行Western blot 检测,结果显示:KLF4-siRNA干扰组及KLF4-siRNA干扰+DCA处理12 h组中,KLF4、CDX2、MUC2表达均下调,且不再随DCA处理的刺激而升高,较阴性siRNA对照组差异均具有统计学意义(P<0.05,图 5)。
 |
|
1:空白对照组;2:阴性siRNA对照组;3:阴性siRNA+DCA 处理12 h组;4:KLF4-siRNA干扰组;5:KLF4-siRNA干扰+ DCA处理12 h组 A:Western blot检测;B:半定量分析 a:P<0.05,与阴性siRNA对照组比较 图 5 Western blot检测干扰KLF4后KLF4、CDX2、MUC2 蛋白的表达 |
将KLF4过表达病毒转染Het-1A细胞,48 h后行 Western blot检测,结果显示:阴性病毒+DCA处理12 h 组及KLF4过表达病毒组中,KLF4、CDX2、MUC2表达均上调,且KLF4过表达病毒组3个基因蛋白质表达上调更为显著,较阴性病毒对照组差异均具有统计学意义(P<0.05,图 6)。
 |
|
1:空白对照组;2:阴性病毒对照组;3:阴性病毒+DCA处理12 h组;4:KLF4过表达病毒组 A:Western blot检测;B:半定量分析 a:P<0.05,与阴性病毒对照组比较 图 6 Western blot检测过表达KLF4后KLF4、CDX2、 MUC2蛋白的表达 |
生理状况下,人正常食管被覆复层鳞状上皮,但BE患者的食管下端则不同程度被柱状上皮取代,而BE又是食管腺癌公认的癌前病变,故近年来成为研究的热点。一般认为BE是正常食管鳞状上皮在含有胆酸的反流物持续作用下,为适应环境而化生为耐酸性较强的柱状上皮。在此过程中,胆酸既是BE形成的重要始动因素,也是BE进展的主要原因[6]。但胆酸导致这一病理改变的具体机制依然不明。KLF4是一种在人类多种组织(包括食管)中广泛表达的锌指转录因子,在早期胚胎发育、胃肠道形态发生以及功能的发挥和正常组织稳态的维持中都具有重要作用[7, 8, 9]。近年来,国外学者发现将KLF4等转录因子导入小鼠体细胞,能获得诱导性多能干细胞(induced pluripotent stem cells,iPSCs),这颠覆了人们既往对于干细胞的传统认识[10]。我们前期的研究也表明KLF4在BE的形成过程中起重要作用[11]。我们据此推测:人正常食管鳞状上皮到BE的转变过程中,也可能存在类似于KLF4等转录因子诱导iPSCs的作用。为此,我们用免疫组化技术检测对比了正常食管鳞状上皮组织与Barrett食管组织中KLF4表达差异。结果发现,与人正常食管鳞状上皮组织相比,Barrett食管组织中KLF4表达显著增高。这提示在BE形成过程中,可能的确存在KLF4的作用。
另一方面,CDX2参与肿瘤抑制、胚胎发育调控、肠柱状上皮表型表达及形态发生等重要生命活动[12]。既往研究发现CDX2可特异性结合于杯状细胞特异性蛋白MUC2基因的启动子MUC2-WT顺式作用元件,激活MUC2的转录[13],而MUC2正是食管鳞状上皮转变为BE的标志性分子之一[14, 15]。本研究免疫组化的结果也证实:Barrett食管组织中CDX2表达比人正常食管鳞状上皮组织显著增高。这提示在BE形成过程中,也存在CDX2的作用。于是,我们进一步推测:含有胆酸的反流物可能是通过提高KLF4的表达,进而提高CDX2表达,最终导致BE标志性分子MUC2的表达增加。
为此,我们在体外培养了永生化的人食管鳞状上皮Het-1A细胞,并用DCA处理不同时间。实验结果发现,随DCA处理时间的增加,Het-1A细胞KLF4、CDX2、MUC2的表达均显著升高,这与我们的推测相符。后续,我们又利用KLF4的干扰siRNA转染细胞,下调KLF4的表达。实验结果发现:随KLF4的下调,Het-1A细胞CDX2和MUC2的表达均显著下降,且不能被DCA刺激再次升高,这再次佐证了胆酸对食管的影响是通过KLF4实现的。最后,为了进一步明确KLF4与CDX2、MUC2的这种调控关系,我们用KLF4 过表达病毒上调KLF4的表达,结果发现:随KLF4的上调,Het-1A细胞CDX2和MUC2的表达均显著上调,这进一步证明含有胆酸的反流物的确是通过提高KLF4的表达,进而提高了CDX2表达,并最终通过引起BE标志性分子MUC2的表达增加来促进BE 形成的。
综上所述,我们受小鼠体细胞经细胞重编程得到iPSCs的过程启发,通过实验证明了胆酸通过KLF4上调CDX2表达,引起BE标志性分子MUC2的表达上调,最终促进BE形成。这为更深入认识BE的发病机制提供了新的线索和思路,也为其进一步临床治疗提供了实验依据。下一步可围绕动物模型的验证和转录调控机制进行更深入的研究。
| [1] | Thomas S J,Almers L,Schneider J,et al.Ghrelin and Leptin Have a Complex Relationship with Risk of Barrett’s Esophagus[J].Dig Dis Sci,2016,61(1): 70-79.DOI:10.1007/s10620-015-3867-6 |
| [2] | Burke Z D,Tosh D.Barrett’s metaplasia as a paradigm for understanding the development of cancer[J].Curr Opin Genet Dev,2012,22(5): 494-499.DOI:10.1016/j.gde.2012.08.001 |
| [3] | Yu T,Chen X,Zhang W,et al.Regulation of the potential marker for intestinal cells,Bmi1,by β-catenin and the zinc finger protein KLF4: implications for colon cancer[J].J Biol Chem,2012,287(6): 3760-3768.DOI:10.1074/jbc.m111.316349 |
| [4] | Lee H Y,Ahn J B,Rha S Y,et al.High KLF4 level in normal tissue predicts poor survival in colorectal cancer patients[J].World J Surg Oncol,2014,12: 232.DOI:10.1186/1477-7819-12-232 |
| [5] | Boudreau F,Rivard N,Gendron F P,et al.CDX2: a transcription factor with multiple tasks for epithelial cells of the digestive tract[J].Med Sci(Paris),2007,23(1): 7-8.DOI:10.1051/medsci/20072317 |
| [6] | Nehra D,Howell P,Williams C P,et al.Toxic bile acids in gastro-oesophageal reflux disease: influence of gastric acidity[J].Gut,1999,44(5): 598-602. |
| [7] | Shields J M,Christy R J,Yang V W.Identification and characterization of a gene encoding a gut-enriched Kruppel-like factor expressed during growth arrest[J].J Biol Chem,1996,271(33): 20009-20017. |
| [8] | Katz J P,Perreault N,Goldstein B G,et al.The zinc-finger transcription factor Klf4 is required for terminal differentiation of goblet cells in the colon[J].Development,2002,129(11): 2619-2628. |
| [9] | Ton-That H,Kaestner K H,Shields J M,et al.Expression of the gut-enriched Krüppel-like factor gene during development and intestinal tumorigenesis[J].FEBS Lett,1997,419(2/3): 239-243. |
| [10] | Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4): 663-676.DOI:10.1016/j.cell.2006.07.024 |
| [11] | 李婧文,徐胤,夏一菊,等.KLF4与Notch1在脱氧胆酸诱导Barrett食管形成过程的作用[J].第三军医大学学报,2014,36(9): 878-882. |
| [12] | Li C M,Gocheva V,Oudin M J,et al.Foxa2 and Cdx2 cooperate with Nkx2-1 to inhibit lung adenocarcinoma metastasis[J].Genes Dev,2015,29(17): 1850-1862.DOI:10.1101/gad.267393.115 |
| [13] | Yamamoto H,Bai Y Q,Yuasa Y.Homeodomain protein CDX2 regulates goblet-specific MUC2 gene expression[J].Biochem Biophys Res Commun,2003,300(4): 813-818.DOI:10.1016/s0006-291x(02)02935-2 |
| [14] | Gulmann C,Shaqaqi O A,Grace A,et al.Cytokeratin 7/20 and MUC1,2,5AC,and 6 expression patterns in Barrett’s esophagus and intestinal metaplasia of the stomach: intestinal metaplasia of the cardia is related to Barrett’s esophagus[J].Appl Immunohistochem Mol Morphol,2004,12(2): 142-147. |
| [15] | Glickman J N,Shahsafaei A,Odze R D.Mucin core peptide expression can help differentiate Barrett’s esophagus from intestinal metaplasia of the stomach[J].Am J Surg Pathol,2003,27(10): 1357-1365. |



