麻醉药物对婴幼儿认知、记忆的影响是人们关注与争议的热点。临床回顾性研究表明:2岁以下婴幼儿在接受全身麻醉后可导致较长时间的行为及人格改变,提示全麻药物可能损伤婴幼儿的中枢神经系统[1]。丙泊酚作为一种新型的快速、短效的全身麻醉药之一,起效迅速、苏醒快、作用时间短、术后恶心呕吐发生率低,被广泛运用于临床麻醉的诱导和维持及ICU镇静。然而,丙泊酚引发神经毒性的机制尚未可知。
梨状皮层(piriform cortex)起源于古皮质,同海马区一样属于边缘系统,它与神经发生和学习记忆密切相关。2001年,Thompson等[2]证实尿烷麻醉后可导致新生SD大鼠大脑梨状皮层选择性的神经元凋亡。Kajiwara等[3]最新的研究也同样证实梨状皮层是麻醉药物作用的关键位点。丙泊酚是否通过调节发育期大脑梨状皮层的细胞增殖,从而影响远期脑功能尚未明确。本研究采用免疫组织化学法检测不同剂量的丙泊酚对梨状皮层细胞增殖的影响,进一步探讨丙泊酚对发育大脑潜在的神经毒性作用可能的机制。
1 材料与方法 1.1 主要试剂丙泊酚购自AstraZenenca公司(批号:KV697);10%脂肪乳购自安徽丰原药业股份有限公司;5-溴脱氧尿嘧啶核苷(5-Bromo-2-deoxyUridine,BrdU)粉剂购自Sigma公司 ;BrdU抗体购自BD Pharmingen公司 ;Sox2[Sex-determining region Y (SRY)-box 2]抗体购自Chemicon公司;Nestin抗体购自BD Pharmingen公司。荧光二抗、生物素化二抗购自Invitrogen公司;SABC试剂盒购自Vector公司。DAB显色试剂盒购自北京中杉公司。仪器:冰冻切片机为Leica CM1950型;照相仪器为ZEISS AX10型。
1.2 方法 1.2.1 动物与分组
健康C57BL/6J临产孕鼠由第三军医大学实验动物中心提供,4月龄,体质量26~32 g,18~22 ℃饲养,自然昼夜交替采光,自由充足摄取食物和水,小鼠出生后第1个24 h记为P0。将日龄7 d(P7)同窝小鼠15只按照随机数字表法分为3组(n=5):对照组、丙泊酚低剂量组及高剂量组。
1.2.2 药物处理于P7时,对照组小鼠腹腔注射10%脂肪乳剂(10%脂肪乳为丙泊酚溶剂),低剂量组小鼠腹腔注射丙泊酚30 mg/kg,高剂量组小鼠腹腔注射丙泊酚60 mg/kg。药物注射后继续饲养至P8,注射BrdU后2 h,断头处死各组小鼠并取脑组织。
1.2.3 免疫组织化学和免疫荧光法取材后,将小鼠脑标本置于新鲜配制的4%多聚甲醛溶液中固定48 h,随后将脑标本转移至30%的蔗糖溶液中,待其充分脱水沉底后,使用Leica冰冻切片机以40 μm切片并转移至防冻液-20 ℃保存备用。选取合适的切片于0.01 mol/L PBS漂洗后,2 mol/L HCl 37 ℃反应30 min 后PBS漂洗(仅BrdU有此步骤),3%H2O2溶液37 ℃孵育30 min,PBS漂洗后0.3%triton X-100 37 ℃ 反应30 min,3%胎牛血清(BSA)封闭反应1 h。分别加入小鼠来源的一抗工作液BrdU(1 :500),兔来源的Sox2(1 :800),BrdU与Sox2一抗混合液,以及小鼠来源的Nestin(1 :500),4 ℃孵育过夜。PBS漂洗后分别加入生物素化的抗小鼠、抗兔IgG,抗小鼠Cy3与抗兔488荧光二抗混合液及抗小鼠488标记的荧光二抗,并置于37 ℃孵育2 h; PBS漂洗后加入链霉亲和素-生物素复合物(SABC)37 ℃反应1 h;PBS漂洗后 DAB显色,自然风干,中性树胶封片。BrdU-Sox2、Nestin 免疫荧光二抗孵育后,PBS漂洗3次,DAPI染色,PBS清洗3次后漂片,风干,荧光封片剂封片。
1.3 统计学分析采用SPSS 13.0统计学软件,计量资料以x±s表示,采用单因素方差分析及组间LSD多重比较。
2 结果 2.1 丙泊酚抑制发育期小鼠梨状皮层BrdU标记的细胞增殖BrdU注射后2 h,在P8小鼠大脑梨状皮层区域可观察到BrdU免疫阳性细胞增殖现象。选取梨状皮层区域大小相似切片各3张,每张切片选取3个相同面积的区域,在显微镜下统计该区域105 μm2中BrdU+细胞数量(图 1)。丙泊酚低剂量组(33.84±1.33)与对照组(42.67±2.41)比较,BrdU+细胞数量明显减少(P<0.05);与对照组和低剂量组比较,丙泊酚高剂量组(25.17±1.73)BrdU+细胞数量均减少(P<0.01,P<0.05)。
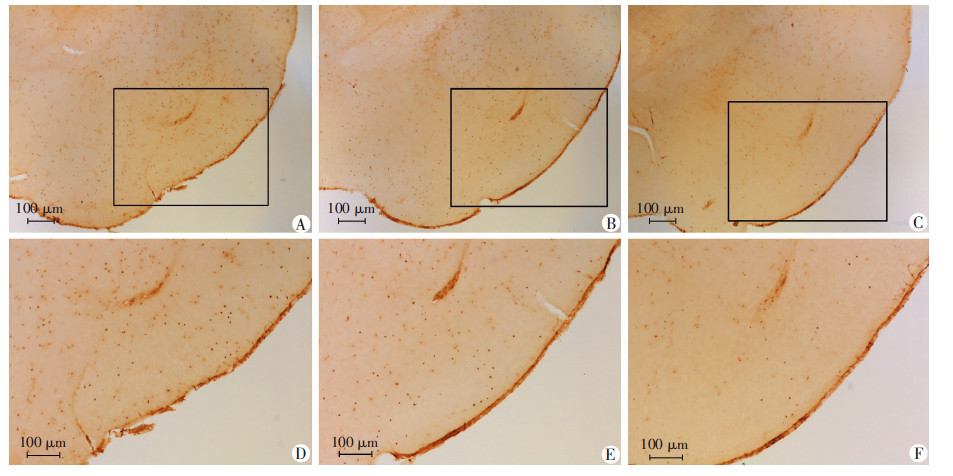 |
| A、D:对照组;B、E:丙泊酚低剂量组;C、F:丙泊酚高剂量组;D~F:A~C中的局部放大 图 1 丙泊酚对发育小鼠梨状皮层BrdU标记的细胞增殖的影响 (SABC) |
选取梨状皮层区域大小相似切片各3张,每张切片选取3个相同面积的区域,在显微镜下统计该区域105 μm2中Sox2+细胞数量(图 2)。 与对照组(618.67±24.01)比较,丙泊酚低剂量组(558.94±29.85)Sox2+细胞 数量差异无统计学意义(P>0.05),丙泊酚高剂量组(430.83±29.23)则减少(P<0.01)。与低剂量组比较,丙泊酚高剂量组Sox2+细胞数量明显减少(P<0.05)。
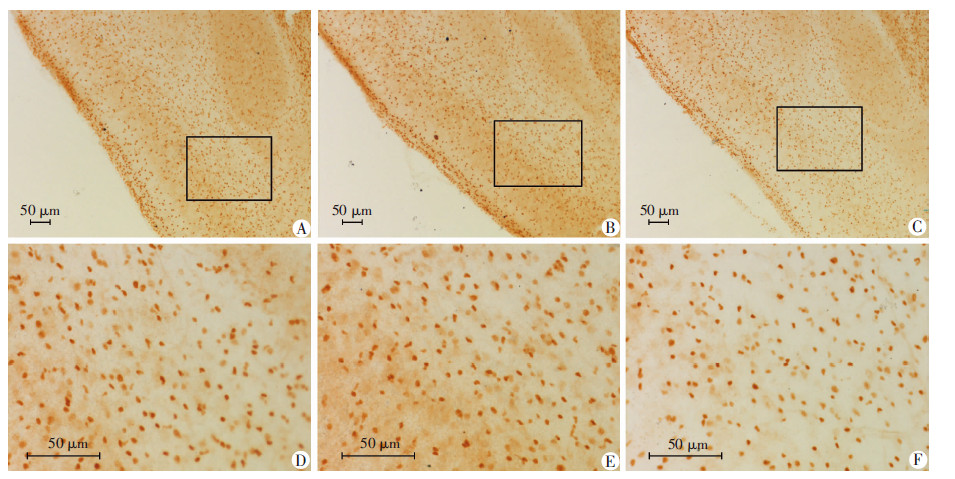 |
| A、D:对照组;B、E:丙泊酚低剂量组;C、F:丙泊酚高剂量组;D~F:A~C中的局部放大 图 2 丙泊酚减少发育小鼠梨状皮层Sox2的表达 (SABC) |
BrdU-Sox2双重标记荧光染色以标记增殖的神经祖细胞,显微镜下统计该区域105 μm2中的BrdU-Sox2双标阳性细胞数量(图 3)。结果显示:与对照组(34.81±2.56)比较,丙泊酚低剂量组(24.73±0.69)BrdU-Sox2双标阳性细胞数量无明显差异(P>0.05),丙泊酚高剂量组(12.48±0.80)则明显减少(P<0.01)。与低剂量组比较,丙泊酚高剂量组BrdU-Sox2双标阳性细胞数量明显减少(P<0.05)。
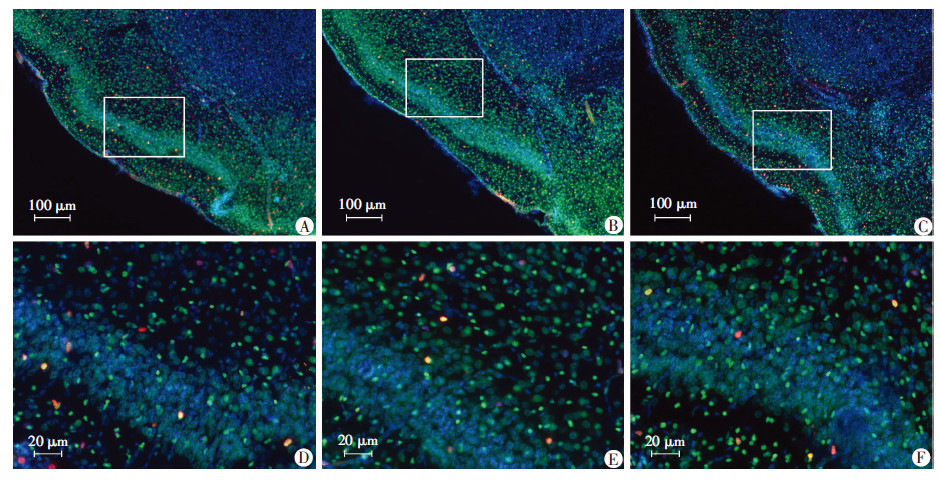 |
| A、D:对照组;B、E:丙泊酚低剂量组;C、F:丙泊酚高剂量组; D~F:A~C中的局部放大 图 3 免疫荧光染色观察丙泊酚对梨状皮层BrdU-Sox2双标阳性细胞的影响 |
巢蛋白Nestin可以标记神经干细胞的长纤维。选取梨状皮层区域大小相似切片各3张,在显微镜下通过光密度分析Nestin标记的神经干细胞纤维突起(图 4)。结果显示:丙泊酚低剂量组(0.65±0.07)及高剂量组(0.60±0.08)与对照组(1.00±0.00)比较,Nestin标记的神经干细胞纤维突起灰度值降低,纤维分布稀疏且排列紊乱(P<0.01)。
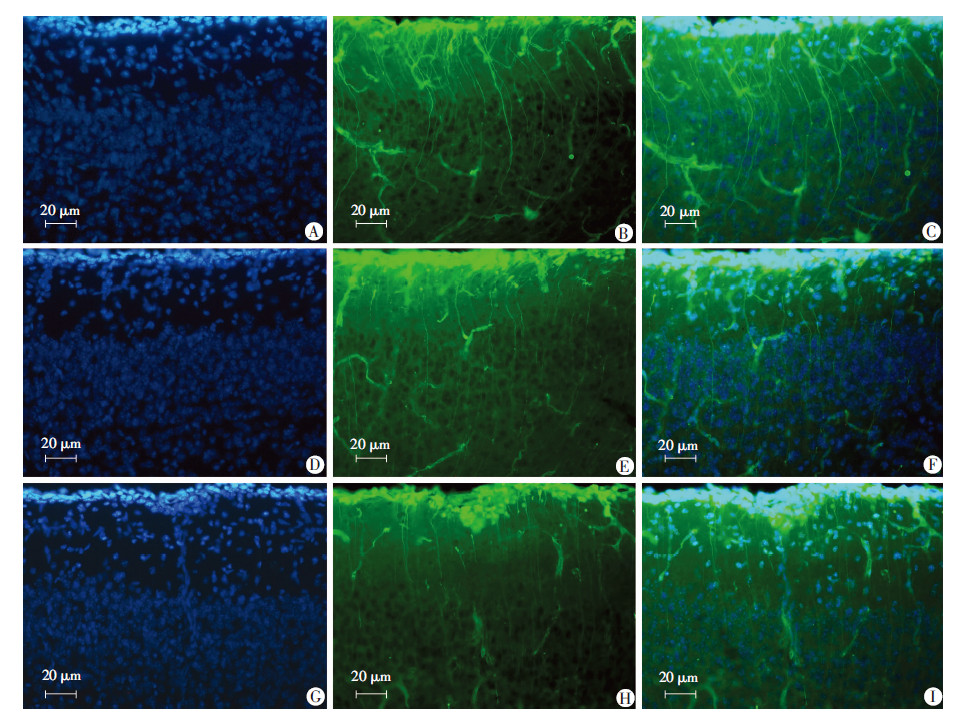 |
| A、B、C:对照组;D、E、F:丙泊酚低剂量组;G、H、I: 丙泊酚高剂量组;A、D、G:DAPI染色;D、E、F:Nestin染色;C、F、I:合成图 图 4 免疫荧光染色观察丙泊酚对梨状皮层Nestin标记的神经干细胞纤维的影响 |
大脑发育是一个漫长且错综复杂的过程,快速发育期的大脑对外界的刺激尤为敏感[4]。近年来,全麻药物对发育机体中枢神经系统的毒性作用越来越引人注目。临床研究表明4岁前多次麻醉暴露可增加认知功能障碍的发生率[5];啮齿类动物实验研究表明单次剂量或重复剂量的丙泊酚麻醉可导致发育期大脑的神经元凋亡[6, 7]。然而,丙泊酚所致的神经毒性作用除了涉及神经元凋亡外,有无通过调控细胞增殖影响大脑发育的可能性呢?
梨状皮层和海马区一样属于边缘系统,是哺乳动物最大的嗅皮层,由嗅球通过外侧嗅束直接传入,并与相邻皮层及海马之间形成复杂的纤维连接[8]。梨状皮层大部分的神经元于胚胎14~18 d产生[9],更有研究发现成年后梨状皮层仍然存在新生神经元的产生[10]。某些慢性刺激可以减少梨状皮层的神经发生[11],这似乎可以解释抑郁症患者并发嗅觉功能障碍[12]。梨状皮层不仅参与嗅觉信息的传递,与记忆的形成及某些疾病的发生密切相关,如在阿尔茨海默症及帕金森病等神经退行性疾病的病理发生过程中均发现梨状皮层功能异常[13]。由此可见,梨状皮层的发育与学习、认知及记忆的形成密切相关。
BrdU是一种胸腺嘧啶核苷的类似物,DNA合成期(S期)可代替胸腺嘧啶。BrdU活体注射是标记以及定量分析活体、培养细胞等细胞增殖的常规技术。本研究发现:不同剂量的丙泊酚对梨状皮层细胞增殖影响不同。与对照组相比,低剂量丙泊酚即可减少梨状皮层BrdU标记的增殖细胞数量(P<0.05),高剂量丙泊酚组对梨状皮层细胞增殖的抑制效应则更为显著(P<0.01),同时高剂量丙泊酚较低剂量丙泊酚对梨状皮层细胞增殖具有显著抑制作用(P<0.05)。提示丙泊酚可抑制梨状皮层细胞增殖,并呈一定的剂量相关性。转录因子Sox2作为神经干细胞关键的调节因子,在神经祖细胞上高表达[14]。Sox2可激活如巢蛋白(nestin)及音猬因子(sonic hedgehog)等靶基因以维持神经祖细胞的特性,包括增殖及自我更新的能力[15]。为了评估丙泊酚对新生小鼠梨状皮层的神经祖细胞的影响,我们对比3组间Sox2+细胞数量。研究发现高剂量丙泊酚暴露可显著减少梨状皮层Sox2+细胞数量(P<0.01),而低剂量丙泊酚对Sox2+细胞数量无明显抑制作用(P>0.05)。因此,高剂量丙泊酚暴露可减少梨状皮层Sox2+细胞数量。BrdU-Sox2双标阳性细胞反应增殖的神经前体细胞,本研究发现高剂量丙泊酚暴露可显著减少梨状皮层BrdU-Sox2双标阳性细胞数量(P<0.01),而低剂量丙泊酚组则无明显改变。
Nestin是一种中间丝类型的蛋白,是神经干细胞的特征性标记物。出生后第7天是大脑发育的关键期,Nestin标记的神经干细胞纤维突起广泛表达于大脑皮层。为了评估丙泊酚对梨状皮层神经干细胞纤维突起的影响,我们通过光密度分析Nestin免疫荧光染色指标。结果显示:与对照组比较,低剂量丙泊酚即可减少梨状皮层Nestin标记的神经干细胞纤维(P<0.01),低剂量丙泊酚组与高剂量丙泊酚组则无明显差异。提示低剂量丙泊酚可抑制梨状皮层神经干细胞纤维突起的发育。
综上所述,高剂量丙泊酚可明显抑制发育期小鼠大脑梨状皮层的神经前体细胞增殖以及梨状皮层神经干细胞纤维突起的发育。因此,我们推测发育期丙泊酚麻醉存在潜在的副作用,这可能与丙泊酚的神经毒性作用相关。
| [1] | DiMaggio C, Sun L S, Li G. Early childhood exposure to anesthesia and risk of developmental and behavioral disorders in a sibling birth cohort[J]. Anesth Analg, 2011, 113(5): 1143-1151. DOI:10.1213/ANE.0b013e3182147f42 |
| [2] | Thompson K W, Wasterlain C G. Urethane anesthesia produces selective damage in the piriform cortex of the developing brain[J]. Brain Res Dev Brain Res, 2001, 130(2): 167-171. |
| [3] | Kajiwara R, Takashima I. Early exposure to urethane anesthesia: Effects on neuronal activity in the piriform cortex of the developing brain[J]. Neurosci Lett, 2015, 600: 121-126. DOI:10.1016/j.neulet.2015.06.012 |
| [4] | Jevtovic-Todorovic V, Hartman R E, Izumi Y, et al. Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing rat brain and persistent learning deficits[J]. J Neurosci, 2003, 23(3): 876-882. |
| [5] | Wilder R T, Flick R P, Sprung J, et al. Early exposure to anesthesia and learning disabilities in a population-based birth cohort[J]. Anesthesiology, 2009, 110(4): 796-804. DOI:10.1097/01.anes.0000344728.34332.5d |
| [6] | Yu D, Jiang Y, Gao J, et al. Repeated exposure to propofol potentiates neuroapoptosis and long-term behavioral deficits in neonatal rats[J]. Neurosci Lett, 2013, 534: 41-46. DOI:10.1016/j.neulet.2012.12.033 |
| [7] | Cattano D, Young C, Straiko M M, et al. Subanesthetic doses of propofol induce neuroapoptosis in the infant mouse brain[J]. Anesth Analg, 2008, 106(6): 1712-1714. DOI:10.1213/ane.0b013e318172ba0a |
| [8] | Pekcec A, Loscher W, Potschka H. Neurogenesis in the adult rat piriform cortex[J]. Neuroreport, 2006, 17(6): 571-574. |
| [9] | Bayer S A. Neurogenesis in the rat primary olfactory cortex[J]. Int J Dev Neurosci, 1986, 4(3): 251-271. |
| [10] | Yuan T F, Liang Y X, So K F. Occurrence of new neurons in the piriform cortex[J]. Front Neuroanat, 2015, 8: 167. DOI:10.3389/fnana.2014.00167 |
| [11] | Nacher J, Pham K, Gil-Fernandez V, et al. Chronic restraint stress and chronic corticosterone treatment modulate differentially the expression of molecules related to structural plasticity in the adult rat piriform cortex[J]. Neuroscience, 2004, 126(2): 503-509. DOI:10.1016/j.neuroscience.2004.03.038 |
| [12] | Yuan T F, Slotnick B M. Roles of olfactory system dysfunction in depression[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2014, 54: 26-30. DOI:10.1016/j.pnpbp.2014.05.013 |
| [13] | Li J, Cui Y, Yuan T F, et al. Commentary: olfactory dysfunction in Parkinson’s disease[J]. CNS Neurol Disord Drug Targets, 2013, 12(8): 1079-1080. |
| [14] | Pevny L H, Nicolis S K. Sox2 roles in neural stem cells[J]. Int J Biochem Cell Biol, 2010, 42(3): 421-424. DOI:10.1016/j.biocel.2009.08.018 |
| [15] | Bonaguidi M A, Wheeler M A, Shapiro J S, et al. In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics[J]. Cell, 2011, 145(7): 1142-1155. DOI:10.1016/j.cell.2011.05.024 |



