2. 400016 重庆,重庆医科大学附属第一医院:心血管内科
2. Department of Cardiovascular Diseases, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
脂代谢紊乱与炎症是加速动脉粥样硬化性疾病进展的重要危险因素[1]。胆固醇调节元件结合蛋白裂解激活蛋白(sterol regulatory element binding proteins cleavage-activating protein,SCAP)是调节真核细胞脂质代谢稳态的关键分子。本课题组前期研究证实,在炎症、糖尿病等病理状态下,SCAP表达增高或异常糖基化修饰,使低密度脂蛋白受体(low density lipoprotein receptor,LDLr)和3-羟基-3-甲基-戊二酰辅酶A还原酶(3-hydroxy-3-methyl-glutaryl coenzyme A reductase,HMGCoAR)表达增加,细胞内源性胆固醇合成增加,破坏细胞内胆固醇稳态,最终引起巨噬细胞[2]、血管平滑肌细胞[3]、肾小球系膜细胞[4]和肝细胞脂质异常大量蓄积,介导组织器官的脂质毒性损伤。近年研究报道,在小鼠脂肪肝模型中,胆固醇调节元件结合蛋白2(sterol regulatory element binding protein2,SREBP2)表达上调,其炎症反应增加[5],提示SCAP/SREBP2信号通路可能与激活炎症反应有关。炎症与 SCAP介导的胆固醇稳态调节之间存在交互作用[6]。本研究通过在THP-1源性巨噬细胞中过表达SCAP及沉默SCAP,探讨SCAP功能失调在炎症反应中的作用。
1 材料与方法 1.1 THP-1源性巨噬细胞的培养THP-1细胞(ATCC,USA)培养于RPMI1640(10%胎牛血清)培养基,经160 nmol/L佛波酯(PMA)诱导分化48 h,成为形态与功能典型的M1型巨噬细胞。PBS洗涤细胞2次后,用于后续实验。实验培养基为含0.2%牛血清白蛋白(BSA,Sigma)的RPMI1640,即无血清培养基(Serum free medium,SF培养基)。
1.2 过表达SCAP质粒的转染将THP-1源性巨噬细胞分为对照组与过表达SCAP组,采用Effectene Transfection Reagent转染试剂盒(Qiagen,German),按照说明书步骤分别转染空白对照质粒(pcDNA3.1,由重庆医科大学感染性疾病分子生物学实验室提供)及过表达SCAP质粒(ATCC,USA)。16 h后予细胞换液,SF培养基中孵育8 h。Betulin(Sigma,USA)是SCAP从内质网向高尔基体转 位的特异性抑制剂[7]。按照不同组别分别加入新鲜SF培养基或含Betulin(3 μmol/L)的SF培养基处理24 h。
1.3 SCAP-siRNA的转染THP-1源性巨噬细胞分为对照组、LPS组、沉默SCAP组、沉默SCAP+LPS组4组。采用siRNAHiperfect Transfection Reagent转染试剂盒(Qiagen,German),按照说明书步骤,对照组及LPS组予以转染对照-siRNA(Santa Cruz,USA),沉默SCAP组及沉默SCAP+LPS组予以转染SCAP-siRNA(Santa Cruz,USA)。16 h后予细胞换液,SF培养基中孵育8 h。LPS是刺激THP-1源性巨噬细胞炎症因子表达的强刺激剂[8],按照不同组别分别加入新鲜SF培养基或含LPS(1 μg/mL)的SF培养基处理24 h。
1.4 油红O染色培养于8孔chamber slide中的THP-1源性巨噬细胞,经4%多聚甲醛固定,0.2%油红O染色15~30 min,苏木精复染,光镜下观察组织、细胞内中性脂质蓄积情况。
1.5 酶法定量测定细胞内胆固醇含量6孔板内各组细胞处理24 h后收集细胞,重悬细胞沉淀于氯仿/甲醇液1 mL中。超声波破碎细胞,置样品于摇床室温震荡,离心,上清液转移至玻璃管,真空干燥仪干燥后,130 μL 95%乙醇溶解样品。离心所得沉淀用500 μL 1 mol/L NaOH溶解,Lowry法蛋白定量。酶法定量测定细胞内游离胆固醇(free cholesterol,FC)和总胆固醇(total cholesterol,TC)含量[3]。Lowry法检测细胞碎片蛋白含量,以标准化各样本的胆固醇值。总胆固醇含量减去游离胆固醇含量即得胆固醇酯(cholesterol ester,CE)含量。
1.6 总RNA提取及Real time PCR经转染及不同处理后的THP-1源性巨噬细胞,采用Trizol法分别提取各组细胞总RNA。采用Nino1000核酸蛋白定量仪测定RNA浓度后,对RNA样本浓度进行标准化。逆转录来自不同实验组细胞的等量RNA为cDNA(TaKaRa逆转录试剂盒,大连)。采用不同管CT值比较的相对定量法,严格按照TaKaRa生物试剂公司操作说明书进行,以β-actin为内参照,反应体系25 μL,在Opticon 2 Real time PCR Detector中进行Real time PCR,检测pro-IL-1β,MCP-1,SCAP,HMGCoAR,β-actin mRNA表达水平。pro-IL-1β基因上游引物序列:5′-TCC AGG GAC AGG ATA TGG AG-3′,下游引物序列:5′-TCT TTC AAC ACG CAG GAC AG-3′,片段大小133 bp;MCP-1基因上游引物序列:5′-AGCATGAAAGTCTCTGCCGCCCTTCTG-3′,下游引物序列:5′- ATTACTTAAGGCATAATGTTTCACA-3′,片段大小128 bp;SCAP基因上游引物序列:5′-GGGAACTTCTGGCAGAATGAC-3′,下游引物序列:5′-CTGGTGGATGGTCCCAATG-3′,片段大小169 bp;HMGCoAR基因上游引物序列:5′-GGCCCAGTTGTGCGTCTT-3′,下游引物序列:5′-TTTCGAGCCAGGCTTTCACT-3′,片段大小161 bp;β-actin基因上游引物序列:5′-CCTGGCACCCAGCACAAT-3′,下游引物序列:5′-GCCGATCCACACGGAGTACT-3′,片段大小170 bp。反应条件:50 ℃ 120 s,95 ℃ 300 s,然后95 ℃ 20 s,55 ℃ 20 s,共40个循环,最后95 ℃ 60 s,55 ℃ 60 s。PCR结果以Ct值反应初始模板量,采用比较Ct值法(2-△△Ct)计算目的基因表达水平。
1.7 超滤离心法收集上清用2 mL Amicon Ultra离心过滤管(Merck Millipore公司)收集细胞培养上清液,按照说明书差速离心,将每管上清液浓缩至体积100 μL,-20 ℃保存,待测蛋白浓度。
1.8 Western blot检测蛋白表达经转染及不同处理后的THP-1源性巨噬细胞,采用Lysis Buffer (Sigma,USA) 分别提取各组细胞总蛋白。取浓缩后的细胞培养上清液及细胞总蛋白裂解液 5 μL,Lowry法分别测定蛋白浓度,根据蛋白浓度将各组蛋白样品进行标准化。取等量各组蛋白样品(60~ 100 μg)行SDS-PAGE(10%~12%)电泳,蛋白Ladder购于Fermentas公司。待溴酚蓝完全泳出后终止电泳。5%脱脂牛奶室温封闭1 h,一抗4 ℃孵育过夜,PBST洗膜3次,二抗室温孵育1 h,PBST再次洗膜3次,采用ECL化学发光试剂及凝胶成像系统检测图像并拍照。以β-actin蛋白为内参照。IL-1β以浓缩细胞培养上清 液总蛋白量为内参照。抗SCAP单克隆抗体IgG-9D5及其他一抗均购于Santa Cruz (USA)或Abcam(UK)公司。
1.9 统计学分析采用SPSS 13.0统计软件,计量资料用x±s表示,多个不同处理组各项定量指标的比较采用单因素方差分析,两个不同处理组间比较采用两样本均数t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 过表达SCAP对THP-1源性巨噬细胞内脂质沉积及炎症因子表达的影响过表达SCAP组SCAP mRNA表达量是对照组的(55.84±8.18)倍,其HMGCoAR mRNA表达量是对照组的(4.89±0.60)倍,差异有统计学意义(P < 0.01)。过表达SCAP组细胞内中性脂质的聚集显著增加(图 1),TC及CE含量较对照组均显著增多(P < 0.01),而FC含量差异无统计学意义(P>0.05,图 2)。过表达SCAP组pro-IL-1β及MCP-1mRNA表达水平显著增加(P < 0.01),且其pro-IL-1β及上清中IL-1β蛋白含量亦显著高于空质粒对照组(P < 0.05,图 3)
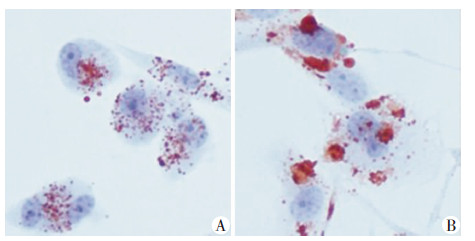 |
| A:对照组;B:过表达SCAP组 图 1 油红O染色法观察过表达SCAP对THP-1源性巨噬 细胞内脂质沉积的影响 (LM×200) |
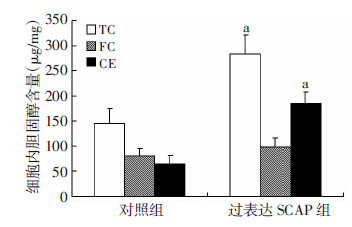 |
| a:P < 0.01,与对照组比较 图 2 酶法定量检测过表达SCAP对THP-1源性巨噬 细胞内TC、FC、CE含量的影响 |
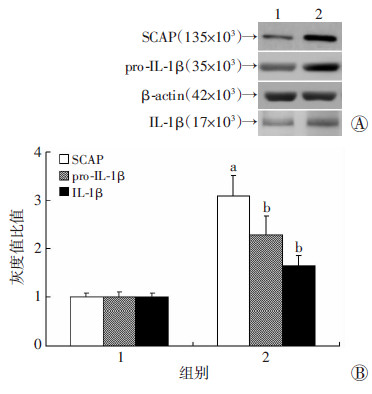 |
| 1:对照组;2:过表达SCAP组 A:Western blot检测;B:半定量分析 a:P < 0.01,与对照组比较;b: P < 0.05,与对照组比较 图 3 Western blot法检测过表达SCAP对THP-1源性巨噬 细胞pro-IL-1β、IL-1β表达量的影响 |
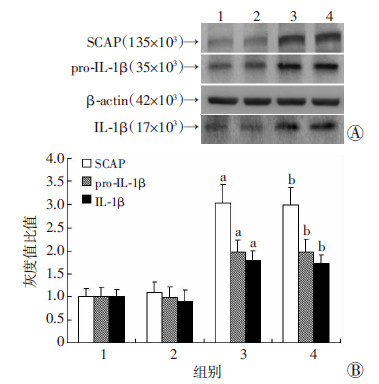
沉默SCAP组HMGCoAR mRNA水平均显著低于对照组(P < 0.05),沉默SCAP+LPS组SCAP、HMGCoAR的mRNA表达水平显著高于沉默SCAP组(P < 0.05),但仍低于LPS组(P < 0.05,图 4)。油红O染色提示LPS组细胞内中性脂质沉积显著增加,沉默SCAP组脂质沉积减少,沉默SCAP+LPS组细胞内中性脂质沉积仍少于LPS组(图 5)。与油红O染色结果相一致,沉默SCAP组TC、CE含量较对照组均显著下降(P < 0.05),沉默SCAP+LPS组TC、CE含量低于 LPS组(P < 0.05),各组间FC含量均无显著差别(P>0.05,图 6)。沉默SCAP组pro-IL-1β及MCP-1 mRNA 表达较对照组明显下调(P < 0.05,图 7)。沉默SCAP+ LPS处理组pro-IL-1β及MCP-1 mRNA表达较沉默SCAP组显著增加(P < 0.05),但显著低于LPS组(P < 0.05,图 8)。沉默SCAP组pro-IL-1β及IL-1β蛋白含量显著减少(P < 0.05),沉默SCAP+LPS组pro-IL-1β及成熟IL-1β蛋白含量亦显著低于LPS组(P < 0.05,图 8、9)。
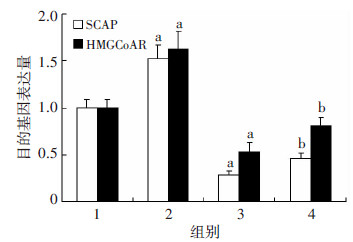 |
| 1:对照组;2:LPS组;3:沉默SCAP组;4:沉默SCAP+LPS组 a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组及沉默SCAP组比较 图 4 Real time PCR检测沉默SCAP对THP-1源性巨噬 细胞SCAP、HMGCoAR mRNA表达水平的影响 |
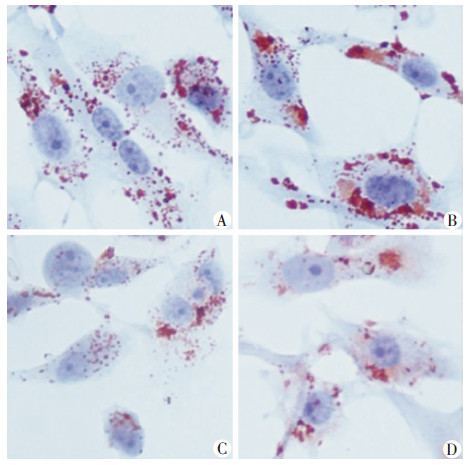 |
| A:对照组;B:LPS组;C:沉默SCAP组;D:沉默SCAP+LPS组 图 5 油红O染色观察过表达SCAP对THP-1源性巨噬 细胞内脂质沉积的影响 (LM ×200) |
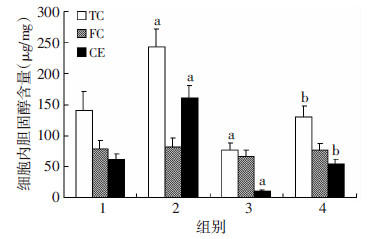 |
| 1:对照组;2:LPS组;3:沉默SCAP组;4:沉默SCAP+LPS组 a:P < 0.05,与对照组比较;b: P < 0.05,与LPS组及沉默SCAP组比较 图 6 酶法定量检测沉默SCAP对THP-1源性巨噬细胞内 TC、FC、CE含量的影响 |
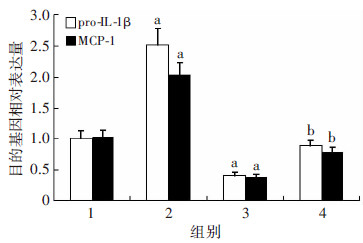 |
| 1:对照组;2:LPS组;3:沉默SCAP组;4:沉默SCAP+LPS组a:P < 0.05,与对照组比较;b: P < 0.05,与LPS组及沉默SCAP组比较 图 7 Real time PCR检测沉默SCAP对THP-1源性巨噬 细胞中pro-IL-1β、MCP-1 mRNA 表达的影响 |
 |
| 1:对照组;2:LPS组;3:沉默SCAP组;4:沉默SCAP+LPS组 图 8 Western blot检测沉默SCAP对THP-1源性巨噬 细胞SCAP、pro-IL-1β及上清中IL-1β含量的影响 |
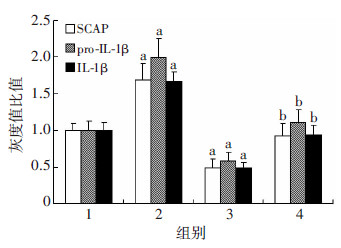 |
| 1:对照组,2:LPS组,3:沉默SCAP组,4:沉默SCAP+LPS组 a:P < 0.05,与对照组比较;b: P < 0.05,与LPS组及沉默SCAP组比较 图 9 定量分析沉默SCAP对THP-1源性巨噬细胞 pro-IL-1β、IL-1β表达的影响 |
Betulin处理对SCAP mRNA及其蛋白表达无显著影响(P>0.05),过表达SCAP+Betulin组HMGCoAR mRNA表达较过表达SCAP组显著下降(P < 0.01,图 10)。油红O染色显示:过表达SCAP组细胞内中性脂质沉积显著增加,加入Betulin则显著减少中性脂质含量(图 11)。与对照组相比,过表达SCAP组细胞内TC、CE水平显著增加(P < 0.01)。与过表达SCAP组相比,过表达SCAP+Betulin组TC、CE含量显著下降(P < 0.05,图 12)。过表达SCAP组较对照组pro-IL-1β及MCP-1 mRNA表达上调(P < 0.01),而Betulin处理并不影响上述两种炎症因子mRNA的表达(P> 0.05,图 13)。蛋白检测结果也提示Betulin不影响SCAP 及pro Il-1β、上清中成熟IL-1β的含量(图 14)。
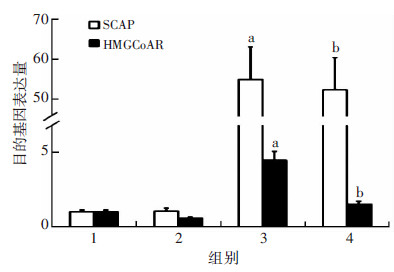 |
| 1:对照组;2:Betulin组;3:过表达SCAP组;4:过表达SCAP+ Betulin组 a:P < 0.01,与对照组比较;b:P < 0.05,与Betulin组及过表达SCAP组比较 图 10 Real time PCR检测抑制SCAP转位对THP-1源性 巨噬细胞SCAP, HMGCoAR mRNA表达量的影响 |
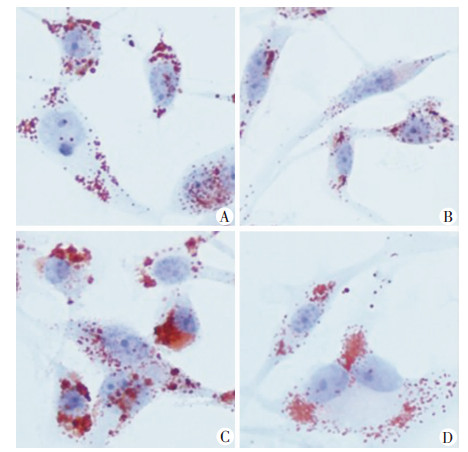 |
| A:对照组;B: Betulin组;C:过表达SCAP组;D:过表达SCAP+Betulin组 图 11 油红O染色观察抑制SCAP转位对THP-1源性巨噬 细胞内脂质沉积的影响 (LM×200) |
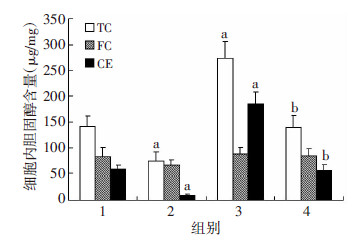 |
| 1:对照组;2:Betulin组;3:过表达SCAP组;4:过表达SCAP+ Betulin组a:P < 0.01,与对照组比较;b:P < 0.05,与Betulin组及过表达SCAP组比较 图 12 酶法定量检测抑制SCAP转位对THP-1源性巨噬 细胞内TC、FC、CE含量的影响 |
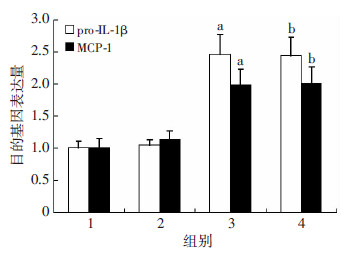 |
| 1:对照组;2:Betulin组;3:过表达SCAP组;4:过表达SCAP+ Betulin组a:P < 0.01,与对照组比较;b:P < 0.05,与Betulin组比较 图 13 Real time PCR检测抑制SCAP转位对THP-1源性巨 噬细胞pro-IL-1β、MCP-1 mRNA 表达水平的影响 |
 |
| 1:对照组;2:Betulin组;3:过表达SCAP组;4:过表达SCAP+ Betulin组 A:Western blot检测;B:半定量分析 a:P < 0.05,与对照组比较;b:P < 0.05,与Betulin组比较 图 14 Western blot检测抑制SCAP转位对THP-1源性巨噬 细胞SCAP、pro-IL-1β及上清中IL-1β含量的影响 |
SCAP 是一个内质网膜蛋白,其NH2-末端区含有固醇敏感区,能感受细胞内胆固醇水平的变化,因此SCAP被认为是一个细胞内的胆固醇敏感器。生理状态下,SCAP与胰岛素诱导基因产物(insulin-induced gene,Insig)和SREBP两种蛋白质相互作用,构成一个依赖于细胞内胆固醇水平的负反馈调控系统,共同维持细胞内胆固醇稳态[9]。当细胞内胆固醇浓度高达一定水平时,内质网内的胆固醇含量随之增高,并诱导SCAP分子构象发生改变,从而促使Insig与SCAP的固醇敏感区结合[10],以Insig-SCAP-SREBP2复合物的形式将SREBP2锚定于内质网上,SREBP2 将不会被激活,LDLr和内源性胆固醇合成的限速酶HMGCoAR转录降低,胆固醇摄取与内源性合成减少。当细胞内缺乏胆固醇时,SCAP的固醇敏感区感受到此变化,其分子构象随即发生改变,使Insig与SCAP脱离,从而SCAP运载SREBP2从内质网转位至高尔基体,然后SREBP2在高尔基体经蛋白酶SIP(site 1 protease)和S2P (site 2 protease)的两步顺序性水解作用下,其活性氨基端片段从膜上游离下来,入核与LDLr基因和HMGCoAR基因增强子上的胆固醇调节元件特异性结合,从而增强LDLr及HMGCoAR基因转录,使LDLr和HMGCoAR表达增加,导致胆固醇摄取与合成增多。研究证实,糖尿病、炎症等多种病理状态下,外周组织细胞内SCAP发生功能失调,成为加速疾病发生发展的重要机制[2, 3, 4]。本研究证实,过表达SCAP,导致HMGCoAR表达增加,从而使细胞内胆固醇内源性合成增多,细胞内脂质沉积显著增加。相反,沉默SCAP,胆固醇内源性合成的限速酶HMGCoAR表达减少,从而使内源性胆固醇合成减少,细胞内脂质沉积减少。
单核巨噬细胞的活化伴随IL-1β、MCP-1、TNF-α等多种炎症因子的成熟与分泌。上述各种炎症因子构成了动脉粥样硬化、慢性肾脏病等慢性炎症性疾病的致病微环境。其中,IL-1β的成熟与分泌需要两个步骤[11]。首先,NF-κB信号通路活化后,生成pro-IL-1β。其次,钾离子外流,或者活性氧、溶酶体破裂等因素活化Nod样受体蛋白3(Nod-like receptor protein3,NLRP3)炎性体,形成具有酶活性的异二聚体caspase-1,将无活性的pro-IL-1β剪切为成熟的IL-1β,诱导机体炎症反应[12]。本研究发现,SCAP不仅是THP-1源性巨噬细胞胆固醇稳态的关键调控分子,同时还参与调节THP-1源性巨噬细胞IL-1β、MCP-1等炎症因子的表达与分泌,介导炎症反应。在THP-1源性巨噬细胞中过表达SCAP能够上调pro-IL-1β及MCP-1的表达,并促进pro-IL-1β成为成熟的IL-1β从而向胞外分泌。而沉默SCAP则显著抑制了炎症因子IL-1β、MCP-1生成,减少IL-1β向胞外分泌。SCAP除参与胆固醇稳态调节外,可能还参与炎症反应的调控。
SCAP从内质网向高尔基体转位,是其激活下游HMGCoAR靶基因转录的关键步骤。本研究应用Betulin抑制THP-1源性巨噬细胞SCAP转位能够使细胞内HMGCoAR表达及中性脂质蓄积显著减少,但并不影响SCAP的表达,也不能抑制pro-IL-1β、MCP-1的表达,以及成熟IL-1β向细胞外的分泌。 这一重要发现表明:SCAP转位及其介导的胆固醇代谢过程与其介导的炎症反应可能无关,SCAP功能失调刺激细胞炎症反应的作用并不依赖于其介导的胆固醇稳态调节功能。
脂质代谢紊乱与炎症是动脉粥样硬化、慢性肾脏病等临床疾病的重要危险因素。SCAP作为胆固醇敏感器,对维持细胞内胆固醇稳态起到重要作用,其功能失调将导致细胞内脂质沉积,引起血管、肾脏等组织器官损伤。本研究发现SCAP功能失调能够促进THP-1源性巨噬细胞IL-1β等炎症因子表达,促进炎症反应,并且这一作用不依赖于其介导的胆固醇稳态调节功能。这可能是SCAP独立于其传统胆固醇稳态调节作用之外的潜在新功能。
| [1] | Usman A, Ribatti D, Sadat U, et al. From Lipid Retention to Immune-Mediate Inflammation and Associated Angiogenesis in the Pathogenesis of Atherosclerosis[J]. J Atheroscler Thromb, 2015, 22(8):739-749. DOI:10.5551/jat.30460 |
| [2] | Ye Q, Chen Y, Lei H, et al. Inflammatory stress increases unmodified LDL uptake via LDL receptor: an alternative pathway for macrophage foam-cell formation[J]. Inflamm Res, 2009, 58(11):809-818. DOI:10.1007/s00011-009-0052-4 |
| [3] | Chen Y, Ku H, Zhao L, et al. Inflammatory stress induces statin resistance by disrupting 3-hydroxy-3-methylglutaryl-CoA reductase feedback regulation[J]. Arterioscler Thromb Vasc Biol, 2014, 34(2): 365-376. DOI:10.1161/ATVBAHA.113.301301 |
| [4] | Zhong S, Zhao L, Li Q, et al. Inflammatory Stress Exacerbated Mesangial Foam Cell Formation and Renal Injury via Disrupting Cellular Cholesterol Homeostasis[J]. Inflammation, 2015, 38(3):959-971. DOI:10.1007/s10753-014-0058-0 |
| [5] | Van-Rooyen D M, Farrell G C. SREBP-2: a link between insulin resistance, hepatic cholesterol, and inflammation in NASH[J]. J Gastroenterol Hepatol, 2011, 26(5):789-792. DOI:10.1111/j.1440-1746.2011.06704 .x |
| [6] | Chen Y, Zhao L, Li Q, et al. Inflammatory stress reduces the effectiveness of statins in the kidney by disrupting HMGCoA reductase feedback regulation[J]. Nephrol Dial Transplant, 2014, 29(10):1864-1878. DOI:10.1093/ndt/gfu203 |
| [7] | Tang J J, Li J G, Qi W, et al. Inhibition of SREBP by a small molecule, betulin, improves hyperlipidemia and insulin resistance and reduces atherosclerotic plaques[J]. Cell Metab, 2011, 13(1):44-56. DOI:10.1016/j.cmet.2010.12.004 |
| [8] | Li L C, Varghese Z, Moorhead J F, et al. Cross-talk between TLR4-MyD88-NF-κB and SCAP-SREBP2 pathways mediates macrophage foam cell formation[J]. Am J Physiol Heart Circ Physiol, 2013, 304(6):H874-H884. DOI:10.1152/ajpheart.00096.2012 |
| [9] | Dong X Y, Tang S Q, Chen J D. Dual functions of Insig proteins in cholesterol homeostasis[J].Lipids Health Dis, 2012, 11:173. DOI:10.1186/1476-511X-11-173 |
| [10] | Huber M D, Vesely P W, Datta K, et al. Erlins restrict SREBP activation in the ER and regulate cellular cholesterol homeostasis[J]. J Cell Biol, 2013, 203(3):427-436. DOI:10.1083/jcb.201305076 |
| [11] | Lorenz G, Darisipudi M N, Anders H J. Canonical and non-canonical effects of the NLRP3 inflammasome in kidney inflammation and fibrosis[J]. Nephrol Dial Transplant, 2014, 29(1):41-48. DOI:10.1093/ndt/gft332 |
| [12] | Shaw P J, McDermott M F, Kanneganti T D. Inflammasomes and autoimmunity[J].Trends Mol Med, 2011, 17(2):57-64. DOI:10.1016/j.molmed.2010.11.001 |



