非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种无过量饮酒史,由各种原因引起的肝细胞内脂肪堆积,以肝细胞脂肪变性和脂质蓄积为主要特征的临床病理综合征[1, 2],已成为全球重要的健康问题之一,与肝硬化和肝癌的发生、发展密切相关[3]。在疾病早期,积极探索安全有效的干预措施十分必要,可显著提高患者的生活质量并减轻国家的医疗负担。运动是世界公认的最方便、安全、经济、有效的防治NAFLD的措施,是早、中期NAFLD转归的理想方案[4, 5, 6, 7]。尽管已有多个人群研究[8, 9, 10]表明适度的耐力运动可以有效管理NAFLD,动物实验[11]也揭示运动可通过抑制巨噬细胞浸润而减少肝脏炎症、损伤和纤维化,但具体机制仍未明确。运动对NAFLD的影响,部分可能是直接作用,更多的可能是通过体内不同组织之间的相互作用而实现。近年肠黏膜屏障功能与NAFLD的关系研究受到关注,肠黏膜屏障在营养素吸收和防止有害大分子进入人体的过程中发挥重要的生理、物理、化学及免疫学作用[12]。在急、慢性肝病患者中常出现肠黏膜屏障功能的减退。研究表明NAFLD患者肠道菌群失调、小肠黏膜通透性增加进而影响肝脏脂肪分布[13]。本研究利用高脂饲料诱导C57BL/6小鼠建立NAFLD动物模型,同时以小鼠跑步机运动训练作为干预方式,观察小鼠肠黏膜屏障功能和肝脏脂质蓄积及炎症状态改变之间的联系,从肠黏膜屏障功 能的角度探讨运动减轻肝脏脂质蓄积和炎症的可能机制,为运动防治NAFLD的机制研究提供一个新的思路。
1 材料与方法 1.1 小鼠NAFLD模型构建和分组8周龄雄性C57BL/6小鼠27只,体质量(24.3±0.5)g(第三军医大学大坪医院野战外科研究所实验动物中心提供)。小鼠在SPF级动物中心饲养,室温(23±1)℃,相对湿度50%~60%,明暗周期12 h,自由饮水和进食。适应1周后按随机数字表法分为3组(n=9):普通饲料组(ND)、高脂饲料组(HFD)、高脂运动组(HFD+EX)。普通饲料(江苏美迪森生物医药有限公司,MD12031)的能量比例:碳水化合物70%、蛋白质20%、脂肪10%;高脂饲料(江苏美迪森生物医药有限公司,MD12032)的能量比例:碳水化合物35%、蛋白质20%、脂肪45%。
1.2 运动方案与高脂造模同时开始为期8周的运动训练(小鼠自动跑步机,YSL-10B),前2周为运动时间递增的适应性运动,强度为12~20 m/min,运动时间每日递增10 min,达到并维持60 min/d,5 d/周。为避免应激压力,对小鼠自动跑步机的电刺激装置进行了绝缘处理。8周后,所有小鼠经5%水合氯醛麻醉后眼眶取血,然后处死取材。剥离附睾脂肪组织、皮下脂肪组织和肝组织后称量。
1.3 检测指标 1.3.1 一般情况观察实验期间,每日观察小鼠健康状态,每周记录饲料消耗量和小鼠体质量。
1.3.2 血浆生化指标检测分别采用相关试剂盒(南京建成科技有限公司)检测小鼠血浆甘油三酯(TG)、总胆固醇(T-CHO)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C);用稳豪倍易型血糖仪(强生)测空腹血糖(FBG);用小鼠胰岛素酶联免疫分析试剂盒(上海酶联生物科技有限公司)测空腹胰岛素(FINS)并计算胰岛素指数(HOMA-IR);用鲎试剂盒(厦门鲎试剂有限公司)检测小鼠血浆内毒素(LPS),具体操作按产品说明书进行。
1.3.3 肝组织炎症指标测定及病理切片观察分别采用相关试剂盒(南京建成科技有限公司)检测小鼠肝组织TG、T-CHO的浓度;采用相关酶联免疫分析试剂盒(上海酶联生物科技有限公司)检测小鼠肝组织Toll样受体4(TLR4)、肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)的含量,具体操作按产品说明书进行。取部分小鼠肝脏进行HE和油红O染色。
1.4 透射电镜观察各组小鼠结肠组织结构取小鼠的结肠组织于2.5%的戊二醛溶液中固定,高压80 kV的透射电镜(TECNAI10)下观察并拍照。
1.5 统计学分析采用SPSS 19.0统计软件,计量资料以x±s表示,进行单因素方差分析。
2 结果 2.1 运动对小鼠一般生化指标的影响与ND组相比,HFD组小鼠的体质量、血浆T-CHO及TG、LDL-C、肝组织TG及T-CHO、FBG、FINS和HOMA-IR指数均显著增加,血浆HDL-C显著降低(P < 0.05,表 1);与HFD组小鼠相比,HFD-EX组小鼠血浆TG与LDL-C、肝组织TG与T-CHO、FBG、HOMA-IR指数均显著降低(P < 0.05,表 1)。
| (n=9,x±s) | ||||||||||
| 组别 | 血浆(mmol/L) | 肝组织(mmol/g) | 体质量(g) | FBG(mmol/L) | FINS(mIU/L) | HOMA-IR指数 | ||||
| T-CHO | TG | LDL-C | HDL-C | TG | T-CHO | |||||
| ND组 | 2.21±0.22 | 0.99±0.11 | 0.23±0.01 | 1.41±0.09 | 0.25±0.01 | 0.08±0.01 | 32.90±1.56 | 4.68±0.35 | 9.59±1.38 | 1.97±0.22 |
| HFD组 | 3.76±0.85 a | 1.47±0.10 a | 0.33±0.04 a | 1.23±0.08 a | 0.28±0.01 a | 0.11±0.02 a | 40.60±2.84 a | 5.52±0.33 a | 17.99±1.72 a | 4.13±0.27 a |
| HFD-EX组 | 3.37±0.67 a | 1.34±0.06 ab | 0.32±0.02 a | 1.37±0.09 b | 0.27±0.01 ab | 0.09±0.02 b | 38.21±2.77 a | 5.13±0.42 ab | 17.00±1.61 a | 3.85±0.16 ab |
| a: P < 0.05,与ND组比较;b: P < 0.05,与HFD组比较 | ||||||||||
ND组小鼠肝脏外观呈红褐色,质地软而富有弹性。经HE染色可见肝小叶结构清晰,细胞排列整齐,大小均匀,未见脂肪空泡;HFD组小鼠肝细胞内存在大量脂肪空泡;HFD-EX组小鼠肝细胞排列轻度紊乱,脂肪空泡减少(图 1A~C)。肝组织油红O染色可见HFD组小鼠胞内脂滴大且数量多,HFD-EX组小鼠胞内脂滴变小,数量减少(图 1D~F)。
 |
| A、D:ND组;B、E:HFD组;C、F:HFD-EX组;A~C:HE染色;D~F:油红O染色 图 1 运动对各组小鼠肝组织的影响 (×200) |
与ND组相比,HFD组小鼠肝脏中TLR4、TNF-α和IL-6的表达水平均显著增加(P < 0.05,表 2);与HFD组相比,HFD-EX组小鼠肝脏中TLR4、TNF-α和IL-6的表达水平均显著降低(P < 0.05,表 2)。
| (n=9,x±s) | |||
| 组别 | TLR4(μg/g) | TNF-α(μg/g) | IL-6(ng/g) |
| ND组 | 0.37±0.05 | 29.89±3.75 | 3.44±0.27 |
| HFD组 | 0.48±0.05 a | 37.00±1.49 a | 3.77±0.13 a |
| HFD-EX组 | 0.42±0.06 b | 32.32±2.42 b | 3.54±0.24 b |
| a: P < 0.05,与ND组比较;b: P < 0.05,与HFD组比较 | |||
透射电镜结果显示,ND组小鼠结肠绒毛分布均匀、规则;HFD组小鼠结肠绒毛稀疏、变短且紧密连接结构变宽;HFD-EX组小鼠结肠绒毛较HFD组小鼠增多且分布稍规则,紧密连接结构宽度降低(图 2)。
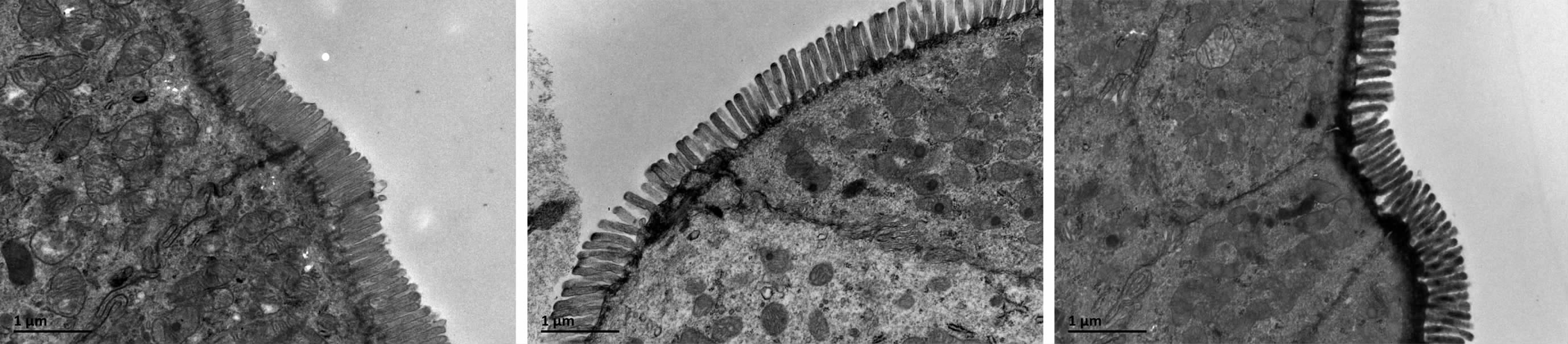 |
| A:ND组;B:HFD组;C:HFD-EX组 红色箭头示紧密连接结构 图 2 透射电镜观察小鼠结肠黏膜微绒毛排列及紧密连接结构 |
与ND组比较,HFD、HFD-EX组小鼠血浆中LPS的浓度显著增加(P < 0.05);与HFD组相比,HFD-EX组小鼠血浆中LPS浓度显著降低(P < 0.05,图 3)。
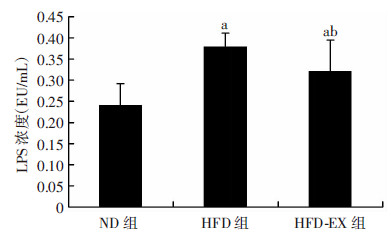 |
| a: P < 0.05,与ND组比较;b:P < 0.05,与HFD组比较 图 3 各组小鼠血浆LPS浓度 |
NAFLD是一种与胰岛素抵抗和遗传易感性密切相关的代谢应激性肝损伤,以肝内脂肪变性和脂质蓄积为主要特征,发病机制十分复杂,其中持续存在的慢性低度炎症反应起重要作用[14]。在众多NAFLD防治措施中,运动是一种有效、廉价的管理手段。动物实验[11]已证实运动可减少NAFLD导致的肝脏炎症及纤维化,在本实验中也得到验证。从小鼠血生化指标、肝组织生化指标、肝脏炎症指标的测定结果以及肝脏病理切片可以看出,运动有效减轻了高脂诱导小鼠肝脏脂质蓄积及炎症。目前运动干预肝脏脂质蓄积和炎症的机制有不同学说。最新研究表明,运动通过PANDER-AKT转运信号通路和刺激脂肪酸氧化,下调脂肪合成,抑制肝脏脂肪堆积[15]。运动能诱发肝脏中AMPK磷酸化,pAMPK通过抑制固醇调节元件结合蛋白1c(SREBP1c)表达抑制生脂酶,从而减少脂肪酸的合成[5]。pAMPK也能通过丙二酰辅酶A脱羧酶(MCD)和磷酸化乙酰辅酶A羧化酶(pACC)增强肉碱棕榈酰转移酶(CPT-I)的活性,从而增加β-氧化,抑制甘油三酯的合成,降低甘油-3-磷酸转酰酶(GPAT)的活性[5]。动物实验显示,长期有氧运动可下调高脂饮食大鼠骨骼肌和小鼠脂肪组织中大麻素受体1(CB1)的蛋白表达[15, 16],而CB1激动剂加剧了油酸引起的人体肝细胞脂肪变性程度[17]。因此,运动对NAFLD的影响,很可能是通过体内不同组织之间的相互作用实现。本研究寻找肠屏障功能和肝脏脂质蓄积及炎症的潜在联系,探讨运动对肝脏脂质蓄积及炎症可能的作用机制。
肠道在系统炎症和代谢综合征的发生、发展中处于中枢环节,肠道黏膜屏障功能与NAFLD关系密切,肠道屏障功能的损伤伴随肠源性抗原(如LPS)泄漏的增加可能导致内脏脂质沉积[18]。已证实,NAFLD患者同时伴随肠道菌群失调、小肠通透性增加以及肠道细菌位移,肠源性内毒素血症加重肝脏炎症[19]。本研究显示,高脂诱导小鼠发生肝脏脂质蓄积和炎症的同时,结肠组织微绒毛整齐的排列结构被破坏、紧密连接结构的宽度增加,血浆中LPS浓度显著升高,表明高脂诱导小鼠NAFLD的建模过程中肠黏膜屏障功能被破坏,进而导致循环入血的LPS浓度升高,与以往的研究结果一致,提示在NAFLD的病程中肠黏膜屏障功能受到影响。
正常情况下,肠道的生物屏障黏膜可防止有害物质吸收入血,但当肠黏膜屏障功能被破坏时,肝脏的肠道微生物及其产物(如LPS)暴露机会增加,LPS(最有效的炎症触发体和革兰阴性菌细胞壁的主要组分之一)通过与免疫细胞表面的复合受体CD14/TLR4结合[20],激活免疫系统,触发促炎症细胞因子的释放,引起炎症反应,从而诱发代谢性疾病[21]。本研究发现,HFD组小鼠肠黏膜屏障功能损伤和血浆LPS浓度升高的同时,肝脏中LPS的受体TLR4及其下游的炎症因子TNF-α和IL-6的表达水平均显著增加;而与之相对应的HFD-EX组小鼠,肠黏膜屏障功能被修复和血 浆LPS浓度降低的同时,肝脏中TLR4及其下游TNF-α 和IL-6的表达水平也显著降低,说明运动通过保护肠黏膜屏障功能进而减轻高脂诱导小鼠肝脏脂质蓄积以及炎症状态。
本研究根据已有研究[11, 22, 23]采用有效的运动强度作为干预措施,观察肝脏脂质蓄积和炎症以及肠黏膜屏障功能的变化,探究运动通过保护肠黏膜屏障功能防治NAFLD发生、发展的可能机制,为运动防治NAFLD的作用机制提供新的依据,认为重视保护肠道屏障功能的措施有助于临床上早期NAFLD的防治和转归。本研究的局限在于高脂饲料诱导C57BL/6小鼠建立的NAFLD模型与人体非酒精性脂肪性肝病的发生过程存在很大差异,并且对小鼠有效的跑步机运动对人体的强度效应还需进一步通过人群实验验证。肠道菌群在肠黏膜屏障功能的改变中发挥重要作用,肠道菌群的改变及其代谢产物会直接或间接地影响宿主的炎症状态进而改变机体的代谢平衡[24]。由于运动和饮食对肠道菌群及其代谢产物的影响很大[25],本课题组后续还将检测各组小鼠粪便中肠黏膜屏障有益菌和有害菌的丰度及其代谢产物短链脂肪酸的含量,为运动通过保护肠屏障功能改善NAFLD的机制寻找更全面的证据。
| [1] | Byrne C D, Targher G. NAFLD: a multisystem disease[J]. J Hepatol, 2015, 62(1 Suppl): S47-S64. DOI: 10.1016/j.jhep.2014.12.012 |
| [2] | Rinella M E, Sanyal A J. NAFLD in 2014: Genetics, diagnostics and therapeutic advances in NAFLD[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(2): 65-66. DOI: 10.1038/nrgastro.2014.232 |
| [3] | Ekstedt M, Hagstrm H, Nasr P, et al. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up[J]. Hepatology, 2015, 61(5): 1547-1554. DOI: 10.1002/hep.27368 |
| [4] | Rodriguez B, Torres D M, Harrison S A. Physical activity: an essential component of lifestyle modification in NAFLD[J]. Nat Rev Gastroenterol Hepatol, 2012, 9(12): 726-731. DOI: 10.1038/nrgastro.2012.200 |
| [5] | Gerber L H, Weinstein A, Pawloski L. Role of exercise in optimizing the functional status of patients with nonalcoholic fatty liver disease[J]. Clin Liver Dis, 2014, 18(1): 113-127. DOI : 10.1016/j.cld.2013.09.016 |
| [6] | Loomba R, Cortez-Pinto H. Exercise and improvement of NAFLD: Practical recommendations[J]. J Hepatol, 2015, 63(1): 10-12. DOI: 10.1016/j.jhep.2015.03.009 |
| [7] | Traussnigg S, Kienbacher C, Halilbasic E, et al. Challenges and Management of Liver Cirrhosis: Practical Issues in the Therapy of Patients with Cirrhosis due to NAFLD and NASH[J]. Dig Dis, 2015, 33(4): 598-607. DOI: 10.1159/000375353 |
| [8] | Oh S, Shida T, Yamagishi K, et al. Moderate to vigorous physical activity volume is an important factor for managing nonalcoholic fatty liver disease: a retrospective study[J]. Hepatology, 2015, 61(4): 1205-1215. DOI: 10.1002/hep.27544 |
| [9] | Kantartzis K, Thamer C, Peter A, et al. High cardiorespiratory fitness is an independent predictor of the reduction in liver fat during a lifestyle intervention in non-alcoholic fatty liver disease[J]. Gut, 2009, 58(9): 1281-1288. DOI: 10.1136/gut.2008.151977 |
| [10] | Aron-Wisnewsky J, Gaborit B, Dutour A, et al. Gut microbiota and non-alcoholic fatty liver disease: new insights[J]. Clin Microbiol Infect, 2013, 19(4): 338-348. DOI : 10.1111/1469-0691.12140 |
| [11] | Kawanishi N, Yano H, Mizokami T, et al. Exercise training attenuates hepatic inflammation, fibrosis and macrophage infiltration during diet induced-obesity in mice[J]. Brain Behav Immun, 2012, 26(6): 931-941. DOI: 10.1016/j.bbi.2012.04.006 |
| [12] | Dai X, Wang B. Role of gut barrier function in the pathogenesis of nonalcoholic fatty liver disease[J]. Gastroenterol Res Pract, 2015, 2015: 287348. DOI: 10.1155/2015/287348 |
| [13] | Miele L, Valenza V, La-Torre G, Montalto M, et al. Increased intestinal permeability and tight junction alterations in nonalcoholic fatty liver disease[J]. Hepatology, 2009, 49(6): 1877-1887. DOI: 10.1002/hep.22848 |
| [14] | Berardo C, Palladini G, Di-Pasqua L G, et al. Oxidative stress, mitochondria damage and matrix metalloprotease activation in the pathogenesis of NAFLD[J]. Dig Liver Dis, 2015, 47(Suppl 1): E60-E61. DOI: 10.1016/j.dld.2015.01.132 |
| [15] | Wu H, Jin M, Han D, et al. Protective effects of aerobic swimming training on high-fat diet induced nonalcoholic fatty liver disease: regulation of lipid metabolism via PANDER-AKT pathway[J]. Biochem Biophys Res Commun, 2015, 458(4): 862-868. DOI: 10.1016/j.bbrc.2015.02.046 |
| [16] | Yan Z C, Liu D Y, Zhang L L, et al. Exercise reduces adipose tissue via cannabinoid receptor type 1 which is regulated by peroxisome proliferator-activated receptor-delta[J]. Biochem Biophys Res Commun, 2007, 354(2): 427-433. DOI: 10.1016/j.bbrc.2006.12.213 |
| [17] | Munukka E, Wiklund P, Pekkala S, et al. Women with and without metabolic disorder differ in their gut microbiota composition[J]. Obesity (Silver Spring), 2012, 20(5): 1082-1087. DOI: 10.1038/oby.2012.8 |
| [18] | Gummesson A, Carlsson L M, Storlien L H, et al. Intestinal permeability is associated with visceral adiposity in healthy women[J]. Obesity (Silver Spring), 2011, 19(11): 2280-2282. DOI: 10.1038/oby.2011.251 |
| [20] | Volynets V, Küper M A, Strahl S, et al. Nutrition, intestinal permeability, and blood ethanol levels are altered in patients with nonalcoholic fatty liver disease (NAFLD)[J]. Dig Dis Sci, 2012, 57(7): 1932-1941. DOI: 10.1007/s10620-012-2112-9 |
| [21] | Kim K A, Gu W, Lee I A, et al. High fat diet-induced gut microbiota exacerbates inflammation and obesity in mice via the TLR4 signaling pathway[J]. PLoS One, 2012, 7(10): e47713. DOI: 10.1371/journal.pone.0047713 |
| [22] | Moschen A R, Kaser S, Tilg H. Non-alcoholic steatohepatitis: a microbiota-driven disease[J]. Trends Endocrinol Metab, 2013, 24(11): 537-545. DOI: 10.1016/j.tem.2013.05.009 |
| [23] | Kawanishi N, Niihara H, Mizokami T, et al. Exercise training attenuates adipose tissue fibrosis in diet-induced obese mice[J]. Biochem Biophys Res Commun, 2013, 440(4): 774-779. DOI: 10.1016/j.bbrc.2013.10.004 |
| [24] | Kawanishi N, Mizokami T, Yano H, et al. Exercise attenuates M1 macrophages and CD8+ T cells in the adipose tissue of obese mice[J]. Med Sci Sports Exerc, 2013, 45(9): 1684-1693. DOI: 10.1249/MSS.0b013e31828ff9c6 |
| [25] | den-Besten G, van-Eunen K, Groen A K, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. J Lipid Res, 2013, 54(9): 2325-2340. DOI: 10.1194/jlr.R036012 |
| [26] | Marlicz W, Loniewski I. The effect of exercise and diet on gut microbial diversity[J]. Gut, 2015, 64(3): 519-520. DOI: 10.1136/gutjnl-2014-307909 |



