非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是代谢综合征的一种表现形式,也是慢性肝病的发病主因,有进一步发展为肝硬化和肝癌的风险[1],且其治疗方式的选择有限[2]。近年研究发现天然黄酮类植物化合物二氢杨梅素(dihydromyricetin,DHM)具有良好的调节脂代谢的作用[3]。研究[4, 5, 6]显示DHM可能具有改善胰岛素抵抗、糖代谢等作用;DHM含量占45.01%的藤茶提取物可以明显改善NAFLD小鼠肝脏脂肪变性,还可以降低肝脏及血清甘油三酯(triglyceride,TG)水平,具有潜在的治疗NAFLD的作用[7]。但针对DHM的体外研究比较少见,其作用机制还不是很清楚[8]。本研究通过建立体外肝细胞脂肪变性模型,使用不同浓度的DHM进行干预,分析DHM对脂肪变性肝细胞脂质合成及代谢的影响,并深入探讨DHM对脂肪变性肝细胞沉默信息调节因子1(silent information regulator 1,SIRT1)信号通路的作用,进一步明确其中可能的分子机制。
1 材料与方法 1.1 主要试剂和细胞人肝癌细胞株(HepG2)购于中科院上海细胞所,DMEM高糖培养基、胎牛血清和胰蛋白酶购于美国HyClone公司,二氢杨梅素购自成都曼斯特公司,油红O、棕榈酸(palmitic acid,PA)、EX527为美国Sigma公司产品,CCK-8试剂盒购于日本Dojindo公司,腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)、磷酸化的AMPK(p-AMPK)购于美国Abcam公司,SIRT1抗体购于美国Affinity公司,乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、固醇调节元件结合蛋白1c(sterol regulatory element binding protein-1,SREBP-1c)、脂肪酸合成酶(fatty acid synthetase,FAS)、磷酸化的ACC(p-ACC),购于美国Santa Cruz公司,β-actin抗体购于北京中杉金桥公司,PVDF膜为美国Merck Millipore公司产品,甘油三酯测定试剂盒购于北京普利莱公司。
1.2 细胞培养与实验分组HepG2细胞用含10%胎牛血清及1%青链霉素混合液的DMEM高糖培养基培养,密度达到约80%时进行消化传代。HepG2细胞用0.2 mmol/L棕榈酸处理 24 h 后再用不同浓度的DHM干预24 h。实验分为6组:对照组、PA组、PA+5 μmol/L DHM组、PA+10 μmol/L DHM组、PA+20 μmol/L DHM组、20 μmol/L DHM组。
1.3 细胞增殖活力测定将HepG2细胞以5×103/孔按照分组接种于96孔板中,每组设4个复孔,每孔100 μL体系,加入相应处理因素处理后,按CCK-8试剂盒说明书检测HepG2细胞增殖活力。
1.4 油红O染色按照文献[9]的方法进行油红O染色,显微镜下观察HepG2细胞内脂滴情况。
1.5 细胞TG含量测定根据分组情况将HepG2细胞按1×106/mL接种于6孔板内,干预结束即收集细胞沉淀,PBS清洗2次。按照TG试剂盒说明书测定细胞TG含量。
1.6 Western blot检测蛋白表达不同干预因素处理HepG2细胞后提取总蛋白,按每孔40 μg蛋白上样,10%聚丙烯酰胺凝胶进行电泳,湿式转膜法转移蛋白至PVDF膜。5% BSA室温封闭2 h后,用一抗稀释液稀释的SIRT1、AMPK、p-AMPK、SREBP-1c、FAS、p-ACC、ACC、β-actin 4 ℃ 孵育过夜,1×TBST洗膜3次,加入对应的辣根过氧化酶标记的二抗,室温孵育1 h,1×TBST洗膜3次后,加入化学发光液,VILBER FUSION FX7成像系统自动曝光,Image J进行灰度值分析。
1.7 抑制SIRT1对DHM的效应的影响HepG2细胞经PA处理24 h后,用20 μmol/L DHM、2 μmol/L EX527(SIRT1抑制剂)单独或联合干预24 h,检测各组细胞TG含量以及脂代谢有关基因的表达,操作方法同1.3、1.5、1.6。
1.8 统计学分析数据采用Excel进行采集录入,计量资料用x±s表示,应用GraphPad Prism 6.0软件对数据进行统计作图,多组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 DHM对脂肪变性肝细胞增殖活力的影响用0.2 mmol/L PA和不同浓度DHM单独或联合处理HepG2细胞,各组细胞增殖活力差异没有统计学意义(P>0.05,图 1)。
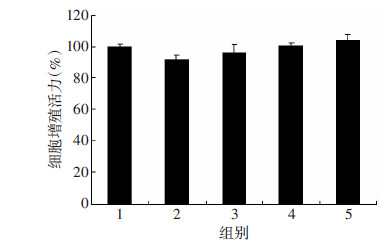 |
| 1:对照组;2:PA组;3:PA+5 μmol/L DHM组;4:PA+10 μmol/L DHM组;5:PA+20 μmol/L DHM组 图 1 CCK-8检测各组脂肪变性HepG2细胞增殖活力 |
PA处理HepG2细胞48 h能显著增加细胞内脂 质蓄积(图 2A、B); 不同浓度DHM处理后,细胞内脂质 蓄积程度随干预浓度升高而明显减少(图 2C~E);20 μmol/L DHM也能在一定程度上减少细胞内正常的脂质蓄积(图 2F)。
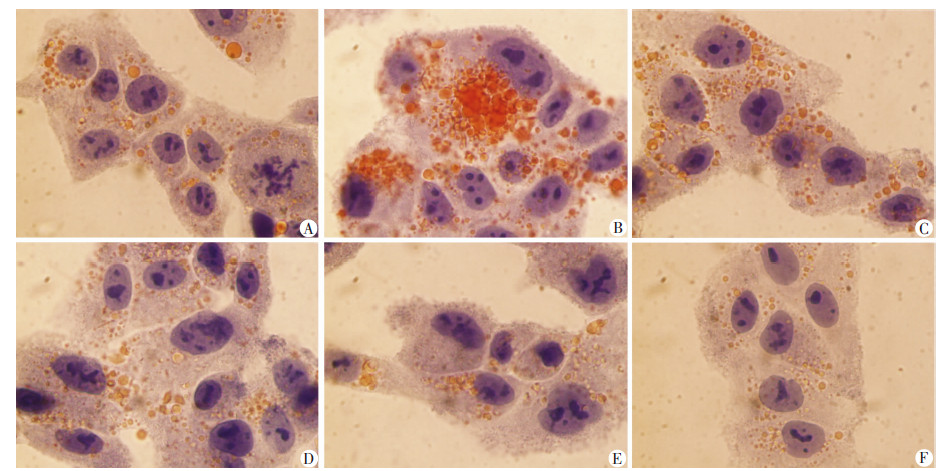 |
| A:对照组;B:PA组; C:PA+5 μmol/L DHM组;D:PA+10 μmol/L DHM组;E:PA+20 μmol/L DHM组;F:20 μmol/L DHM组 图 2 油红O染色观察各组脂肪变性HepG2细胞脂质蓄积的变化 (倒置显微镜 ×400) |
PA处理细胞48 h后能显著增加细胞内的TG含量(P < 0.05),不同浓度DHM干预后TG含量明显降低(P < 0.05)。EX527处理后DHM(20 μmol/L)对细胞内TG含量的减少作用被显著抑制(P < 0.01);与PA组相比,EX527处理后TG含量进一步升高(P < 0.05,图 3)。
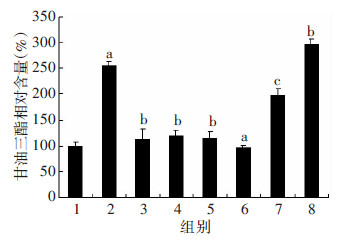 |
| 1:对照组;2:PA组;3:PA+5 μmol/L DHM组;4:PA+ 10 μmol/L DHM组;5:PA+20 μmol/L DHM组;6:20 μmol/L DHM组;7:PA+20 μmol/L DHM+EX527组;8:PA+EX527组 a:P < 0.05,与对照组比较;b:P < 0.05,与PA组比较;c:P < 0.01,与PA+20 μmol/L DHM组比较 图 3 各组脂肪变性HepG2细胞甘油三酯含量的变化 |
PA处理HepG2细胞后,p-AMPK和SIRT1的蛋白表达明显降低(P < 0.05),使用不同浓度DHM干预24 h后,二者蛋白表达却随DHM浓度的升高而增加(P < 0.05、P < 0.01,图 4)。
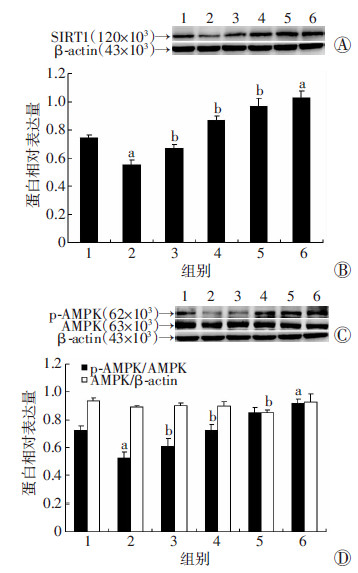 |
| 1:对照组;2:PA组;3:PA+5 μmol/L DHM组;4:PA+ 10 μmol/L DHM组;5:PA+20 μmol/L DHM组;6:20 μmol/L DHM组;A:Western blot检测SIRT1表达;B:SIRT1蛋白半定量分析;C:Western blot检测p-AMPK、AMPK表达;D: p-AMPK、AMPK蛋白半定量分析;a:P < 0.05,与对照组比较;b:P < 0.05,与PA组比较 图 4 Western blot检测各组脂肪变性HepG2细胞SIRT1和 p-AMPK蛋白的表达 |
PA处理HepG2细胞24 h后,SREBP-1c、FAS、p-ACC蛋白表达明显增加(P < 0.05),使用不同浓度DHM处理后降低了SREBP-1c、FAS、p-ACC蛋白表达(P < 0.05,图 5)。
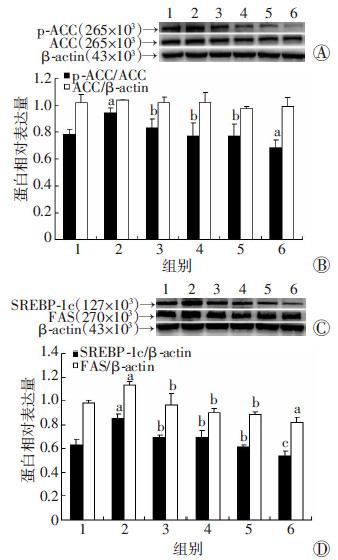 |
| 1:对照组;2:PA组;3:PA+5 μmol/L DHM组;4:PA+ 10 μmol/L DHM组;5:PA+20 μmol/L DHM组;6:20 μmol/L DHM组;A:Western blot检测p-ACC、ACC表达;B: p-ACC、ACC蛋白半定量分析 a:P < 0.05,与对照组较;b:P < 0.05,与PA组比较;C:Western blot检测SREBP-1c、FAS表达;D:SREBP-1c、FAS蛋白半定量分析 a:P < 0.01,c:P < 0.05,与对照组比较;b:P < 0.05,与PA组比较 图 5 Western blot检测各组脂肪变性HepG2细胞脂质 合成蛋白的表达变化 |
与PA组比较,PA+20 μmol/L DHM组SREBP-1c、FAS、p-ACC表达被显著抑制(P < 0.01),EX527处理后明显减弱了20 μmol/L DHM对脂质合成基因SREBP-1c、FAS、p-ACC表达的抑制作用(P < 0.05,图 6)。
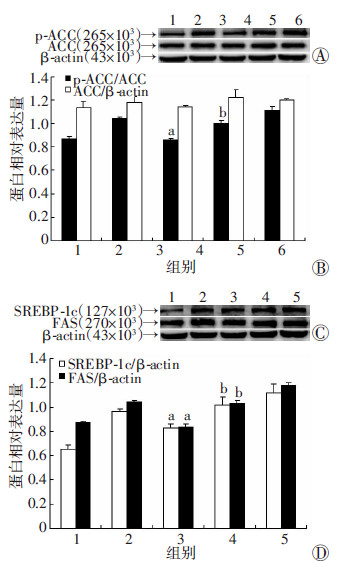 |
| 1:对照组;2:PA组;3:PA+20 μmol/L DHM组;4:PA+20 μmol/L DHM+EX527组;5:PA+EX527组;A:Western blot检测p-ACC、ACC表达;B: p-ACC、ACC蛋白半定量分析;C:Western blot检测SREBP-1c、FAS表达;D:SREBP-1c、FAS蛋白半定量分析;a:P < 0.01,与PA组比较;b:P < 0.05,与PA+20 μmol/L DHM组及PA+EX527组比较 图 6 抑制SIRT1后DHM对脂肪变性HepG2 细胞脂质 合成蛋白的影响 |
近年来,在包括我国在内的许多国家,NAFLD已经成为慢性肝损伤的重要病因。有学者预测,到2020年,NAFLD导致的肝脏功能衰竭将成为肝移植的主要原因,造成极大的社会和经济负担,严重威胁人类健康[10]。因此,积极探索防治NAFLD的安全有效措施是一项十分迫切的任务。
NAFLD发病机制十分复杂,目前尚未完全解释清楚。医学界普遍认可的是Day和James提出的“二次打击”学说[11],并在此基础上发展为“多重打击”学说。肝脏脂质代谢紊乱与脂质蓄积是NAFLD关键的发病诱因[12],在NAFLD病程中起着重要作用。文献[13]报道,NAFLD患者脂代谢紊乱较常见,而富余脂质沉积是NAFLD发生发展的先决条件。近年研究表明,藤茶中的主要活性成分DHM具有减轻高脂对肝细胞的损伤、改善NAFLD的作用[4, 5, 14]。而我国藤茶资源丰富,来源广泛,取材方便,利于探究DHM对NAFLD的改善作用。
本研究通过构建肝细胞脂肪变性模型,模拟NAFLD发生时脂质蓄积对肝细胞的损伤作用,探究DHM对非酒精性脂肪肝体外模型的改善作用。首先,经油红O染色实验观察到DHM能使细胞内脂质蓄积明显减少,定量实验也证明DHM干预后细胞内TG含量显著降低。Western blot检测显示:DHM能增加P-AMPK及SIRT1蛋白表达水平,并且降低脂质合成相关基因SREBP-1c、FAS、P-ACC蛋白表达。越来越多的研究表明SIRT1在NAFLD的病程中起到了关键作用[15],SIRT1的激活能够抑制脂质合成,调节脂代谢平衡[16]。而SIRT1上游靶点AMPK的激活能够抑制脂质积累和脂肪酸的增加[17],其磷酸化后通过下调SREBP-1c抑制P-ACC和FAS的表达[13, 18],因此SIRT1信号通路在调节NAFLD脂质代谢平衡中发挥了重要作用,可能成为NAFLD治疗的新靶点及寻找防治新药的重要途径[19]。为进一步确定SIRT1信号通路在DHM改善肝细胞脂质蓄积中的作用,本研究使用SIRT1抑制剂EX527处理脂肪变性HepG2细胞,发现抑制SIRT1后DHM减少HepG2细胞TG含量和抑制脂质合成相关基因SREBP-1c、FAS、P-ACC表达的作用均被减弱,提示DHM通过上调SIRT1信号通路、抑制脂质合成、改善肝细胞脂肪蓄积。本研究还发现正常HepG2细胞在使用20 μmol/L DHM干预后,SIRT1及P-AMPK蛋白表达水平较对照组有显著增加,脂质蓄积和TG含量也有明显减少,且SREBP-1c、FAS、P-ACC表达水平显著降低。提示DHM在激活SIRT1和P-AMPK表达、减少肝细胞脂质蓄积方面具有积极的作用。
综上所述,本研究发现DHM能够激活脂肪变性HepG2细胞中的SIRT1信号,降低相关脂质合成基因的蛋白表达,减少细胞内TG水平,改善肝细胞脂肪蓄积,为开发更加安全有效的NAFLD治疗药物提供理论支持,为NAFLD的临床防治提供新的思路。
| [1] | McPherson S, Hardy T, Henderson E, et al. Evidence of NAFLD progression from steatosis to fibrosing-steatohepatitis using paired biopsies: implications for prognosis and clinical management[J]. J Hepatol, 2015, 62(5): 1148-1155. DOI: 10.1016/j.jhep.2014.11.034 |
| [2] | Cohen J C, Horton J D, Hobbs H H. Human fatty liver disease: old questions and new insights[J]. Science, 2011, 332(6037): 1519-1523. DOI: 10.1126/science.1204265 |
| [3] | 唐瑛, 罗祖友, 严奉伟, 等. 藤茶总黄酮对小鼠的体内外抗氧化作用研究[J]. 中国医院药学杂志, 2006, 26(12): 1449-1452. DOI: 10.3321/j.issn: 1001-5213.2006.12.001 |
| [4] | Chen S, Zhao X, Wan J, et al. Dihydromyricetin improves glucose and lipid metabolism and exerts anti-inflammatory effects in nonalcoholic fatty liver disease: A randomized controlled trial[J]. Pharmacol Res, 2015, 99: 74-81. DOI: 10.1016/j.phrs.2015.05.009 |
| [5] | Shi L, Zhang T, Liang X, et al. Dihydromyricetin improves skeletal muscle insulin resistance by inducing autophagy via the AMPK signaling pathway[J]. Mol Cell Endocrinol, 2015, 409: 92-102. DOI: 10.1016/j.mce.2015.03.009 |
| [6] | 梁馨予, 张婷, 周永, 等. 杨梅素减轻高糖诱导的血管内皮细胞氧化应激损伤. 第三军医大学学报, 2013, 35(21): 2301-2305. DOI: 10.16016/j.1000-5404.2013.21.006 |
| [7] | 王俊杰, 舒洋, 曹欣, 等. 藤茶对非酒精性脂肪性肝病的治疗作用研究[J]. 中国全科医学, 2011, 14(20): 2248-2250. DOI: 10.3969/j.issn.1007-9572.2011.20.006 |
| [8] | Zhou Q, Chen K, Liu P, et al. Dihydromyricetin stimulates irisin secretion partially via the PGC-1alpha pathway[J]. Mol Cell Endocrinol, 2015, 412: 349-357. DOI: 10.1016/j.mce.2015.05.036 |
| [9] | Zhang Y, Chen M L, Zhou Y, et al. Resveratrol improves hepatic steatosis by inducing autophagy through the cAMP signaling pathway[J]. Mol Nutr Food Res, 2015, 59(8): 1443-1457. DOI: 10.1002/mnfr.201500016 |
| [10] | Musso G, Gambino R, Cassader M, et al. A meta-analysis of randomized trials for the treatment of nonalcoholic fatty liver disease[J]. Hepatology, 2010, 52(1): 79-104. DOI: 10.1002/hep.23623 |
| [11] | Periasamy S, Chien S P, Chang P C, et al. Sesame oil mitigates nutritional steatohepatitis via attenuation of oxidative stress and inflammation: a tale of two-hit hypothesis[J]. J Nutr Biochem, 2014, 25(2): 232-240. DOI: 10.1016/j.jnutbio.2013.10.013 |
| [12] | Delarue J, Lalles J P. Nonalcoholic fatty liver disease: roles of the gut and the liver and metabolic modulation by some dietary factors and especially long chain n-3 PUFA[J]. Mol Nutr Food Res, 2015, . DOI: 10.1002/mnfr.201500346 |
| [13] | Zeng L, Tang W J, Yin J J, et al. Signal transductions and nonalcoholic fatty liver: a mini-review[J]. Int J Clin Exp Med, 2014, 7(7): 1624-1631. |
| [14] | Xie J, Liu J, Chen T M, et al. Dihydromyricetin alleviates carbon tetrachloride-induced acute liver injury via JNK-dependent mechanism in mice[J]. World J Gastroenterol, 2015, 21(18): 5473-5481. DOI: 10.3748/wjg.v21.i18.5473 |
| [15] | Xu F, Li Z, Zheng X, et al. SIRT1 mediates the effect of GLP-1 receptor agonist exenatide on ameliorating hepatic steatosis[J]. Diabetes, 2014, 63(11): 3637-3646. DOI: 10.2337/db14-0263 |
| [16] | Colak Y, Ozturk O, Senates E, et al. SIRT1 as a potential therapeutic target for treatment of nonalcoholic fatty liver disease[J]. Med Sci Monit, 2011, 17(5): HY5-HY9. DOI: 10.12659/MSM.881749 |
| [17] | Nerstedt A, Johansson A, Andersson C X, et al. AMP-activated protein kinase inhibits IL-6-stimulated inflammatory response in human liver cells by suppressing phosphorylation of signal transducer and activator of transcription 3 (STAT3)[J]. Diabetologia, 2010, 53(11): 2406-2416. DOI: 10.1007/s00125-010-1856-z |
| [18] | Jeon T I, Osborne T F. SREBPs: metabolic integrators in physiology and metabolism[J]. Trends Endocrinol Metab, 2012, 23(2): 65-72. DOI: 10.1016/j.tem.2011.10.004 |
| [19] | Hou X, Xu S, Maitland-Toolan K A, et al. SIRT1 regulates hepatocyte lipid metabolism through activating AMP-activated protein kinase[J]. J Biol Chem, 2008, 283(29): 20015-20026. DOI: 10.1074/jbc.M802187200 |



