2. 100000 北京,北京军区总医院263临床部 ;
3. 400038 重庆,第三军医大学西南医院神经外科,全军神经外科研究所,全军神经创伤防治重点实验室
2. No. 263 Clinical Department, General Hospital of Beijing Military Command, Beijing, 100000 ;
3. Department of Neurosurgery, Institute of Neurosurgery, Key Laboratory of Neurotrauma Prevention and Treatment, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
脑出血(intracerebral hemorrhage,ICH)病死率极高[1],而且幸存者会存在严重的神经功能障碍[2]。实验性脑出血动物模型则加深了我们对脑出血病理生理过程的理解,尤其在研究损伤本身及其内在机制方面,现常规大鼠脑出血模型主要有两种应用广泛的方法[3]。一种方法为脑纹状体区注入自体动脉血[4],另外一种方法为相同位置注入细菌源胶原酶[5]。尽管两种造模法在功能预后[6-8]和组织死亡程度方面研究[9]各有特点,但大部分研究多采用单一动物模型,且选用标准不规范严格,因此难以如实模拟和反映脑出血疾病的复杂性和多样性,从而严重影响相关实验结果的可靠性[10]。
本研究应用SD大鼠颅内分别注入自体血或胶原酶方法建立两类脑出血模型,选取Bederson量表评分、伊文思蓝渗透性、脑含水量、HE染色和免疫组化染色5种评测指标,详细比较两种常用的脑出血模型脑损伤程度及功能预后情况,从而探讨两者间的关键性差异。
1 材料与方法 1.1 实验动物和实验分组本实验使用雄性SPF级成年SD大鼠144只,体质量275~300 g,购自第三军医大学大坪医院野战外科研究所实验动物中心,饲养温度控制在20~25 ℃,光照充裕,自由饮食饮水。所有实验动物操作程序符合《实验动物管理和使用指南》规定,并经第三军医大学医学伦理委员会批准。用随机数字表法分为自体血脑出血组和胶原酶脑出血组。
1.2 主要试剂和仪器脑立体定位仪(深圳市瑞沃德生命科技有限公司),Ⅶ型胶原酶(美国Sigma公司),伊文思蓝溶液(美国Sigma公司),Synergy HT 多功能酶标仪(美国BioTek公司),HE染色试剂盒(碧云天生物技术有限公司),胶质细胞原纤维酸性蛋白GFAP(英国Abcam公司),DAPI(英国Abcam公司),荧光标记二抗(Jackson Immunoresearch,West Grove,PA),激光共聚焦显微镜(Olympus BX51,Olympus Optical Co.Ltd,Japan)。
1.3 胶原酶和自体血脑出血模型的建立动物使用水合氯醛腹腔注射麻醉(100 mg/kg)并固定在脑立体定位仪上,消毒后按中线位置切开头皮,去骨膜,显露前囟,充分止血,用高速牙科颅钻在颅骨上钻孔(直径约2 mm)至硬脑膜可见,坐标为:前囟前0.2 mm,旁开3.5 mm,深5.5 mm,此部位为大鼠纹状体区域。自体血注射法使用胰岛素针取股动脉血100 μL后,立即缓慢匀速(20 μL/min)注射入该部位,停留20 min后缓慢拔出,将骨孔用骨蜡封闭,仔细消毒并缝合切口;胶原酶模型利用微量进位器缓慢垂直穿刺注射0.2 U Ⅶ型胶原酶于此脑区,注射完毕后停针5 min后缓慢拔出,余步骤同前。两种模型脑出血后6 h取鼠脑,在针孔处截面可观察血肿面积大致相等。为预防脓毒血症,整个实验过程均在恒温及光照充足的无菌环境下进行,密切观察动物至完全清醒。
1.4 血脑屏障通透性检测制作脑出血模型后第3、7、14天和第21天评测其血脑屏障通透性,麻醉后迅速分离股静脉,按0.5 mL/100 g注射2%伊文思蓝溶液。体循环3 h 后,迅速打开胸腔经左心室插管至升主动脉,用预冷生理盐水冲洗直到流出清亮液体,灌注压90 mmHg。立即取出脑组织,分为同侧和对侧半球后储存于-80 ℃备用。称重后取同侧半球在预冷PBS缓冲液(1 mL)中匀浆后加入等体积的TCA 50 ℃水浴48 h,然后离心(3 000×g,4 ℃,30 min),上清液用Synergy HT 多功能酶标仪(激发波长620 nm)测光表达强度,按标准曲线法,计算伊文思蓝渗透量(μg/g)。
1.5 脑含水量制作脑出血模型后第3、7、14天和第21天时,断头处死大鼠,剥离颅骨后,冠状切开纹状体区观察脑内血肿形成情况后,迅速将整个出血区游离称量(湿质量),经过110 ℃烘烤24 h后测定干质量。脑组织含水量=(脑组织湿质量-脑组织干质量)/脑组织湿质量×100%。
1.6 行为学评定采用Bederson评分法并改良[11],在脑出血后第3、7、14天和第21天分别观察6只大鼠神经功能情况,并给出评分。0分指神经功能基本正常;0.5分指前后肢均出现屈曲情况,提尾悬空试验阳性;1分指前肢存在任何屈曲情况;1.5分指仅一侧前肢屈曲;2分为抵抗侧推能力降低(侧向推力实验阳性),前肢可出现屈曲现象;2.5分指不仅抵抗侧推能力下降,而且出现前后肢体屈曲,但转圈行为不出现;3分指除可观察到2分的行为以外,还出现自发性旋转现象。评分越低说明神经损伤越轻,评分越高说明神经损伤越严重。
1.7 HE染色和免疫组化(S-P)染色大鼠行为学评价结束后,将大鼠立刻麻醉,4%多聚甲醛灌注固定,分离整个大脑,20%蔗糖脱水至脑组织块落底,作10 μm厚冰冻切片,取脑血肿中央及周围部位做HE染色(普通光学显微镜观察)及S-P法,免疫组化条件:2%山羊血清封闭1 h,一抗GFAP(1 ∶50 稀释,Abcam)孵育4 ℃过夜,结合荧光标记二抗,DAPI复染后封片,荧光染色切片用激光共聚焦显微镜观察,图片用Magna Fire SP 2.1B和Image Pro Plus 6图像分析软件后期处理。
1.8 统计学处理采用SPSS 16.0统计软件,以 x±s的方式表示数据计量结果,应用双因素方差分析,采用Bonferroni t检验对样本均数间进行比较。
2 结果 2.1 Bederson评分胶原酶组在脑出血后第3天神经功能损伤最严重,评分最高,第7、14、21天评分逐步下降,神经功能逐步恢复;而自体血组的评分情况类似于胶原酶组,评分随时间逐步下降,且在第3、7、14天评分明显低于胶原酶组(P <0.05) 但第21天二者评分接近,差异有统计学意义(图 1)。
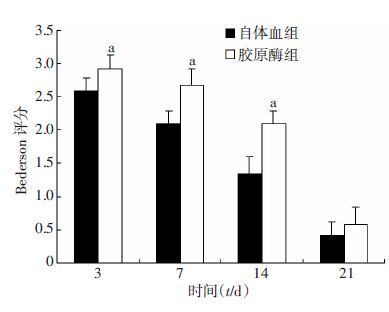
|
| a:P<0.05,与自体血组比较 图 1 两种脑出血模型血脑屏障运动功能比较 (n=6, x±s) |
2.2 血脑屏障通透性变化
两组伊文思蓝渗透量在造模后第3天时为最大值,然后随时间逐步下降,且第3、7、14天自体血组渗透量明显低于胶原酶组(P<0.05) 但第21天差距不明显(图 2A)。

|
| 图 2 a:P<0.05,与自体血组比较 Fig.2 两种脑出血模型伊文思蓝渗透性(A)及脑水肿情况(B)比较 (n=6, x±s) |
2.3 脑组织含水量比较
脑出血后第3、7、14、21天胶原酶组纹状体区的脑组织水含量随时间逐步下降,而自体血组的脑含水量第3天为4个时间节点中最高值,其余3个节点脑含水量变化不明显。而两组之间相比,第3、7、14天自体血组的脑含水量均明显低于胶原酶组(P<0.05) 但第21天两组差距不明显(图 2B)。
2.4 纹状体区病理形态结构的影响两组的脑部纹状体区血肿随时间逐步被吸收,而自体血组的血肿吸收速度明显快于胶原酶组,在第14天和第21天时,血肿基本吸收完毕;两组均存在炎症细胞渗出,但胶原酶组渗出密度在各时间点均明显多于自体血组;两组均存在胶质瘢痕形成,但胶原酶组在第7、14天较自体血组相比更明显(图 3)。
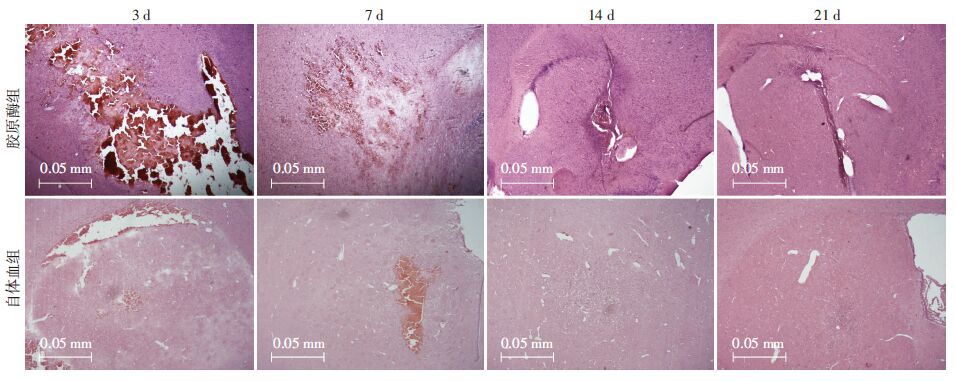
|
| 图 3 两种脑出血模型脑组织血肿部位切片的纹状体区域HE染色病理学观察 |
2.5 血肿周围胶质瘢痕的形成情况比较
两组的血肿周边区域第3天基本无GFAP蛋白阳性表达,第7天时出现大量GFAP阳性细胞,在第14天时两组GFAP阳性细胞数量明显增加,胞体增大,突起增多,荧光密度较前明显增强(图 4)。而且在第7天和第14天,胶原酶组GFAP表达量即平均荧光密度均高于自体血组(P<0.05,图 5)。
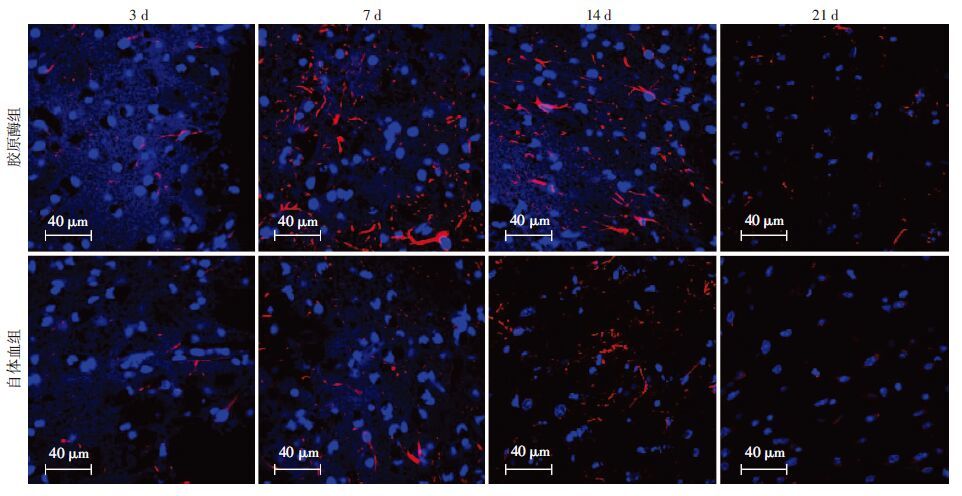
|
| 图 4 激光共聚焦显微镜观察两种脑出血模型脑组织切片的血肿周围区域GFAP表达情况(蓝色为DAPI复染细胞核,红色为GFAP) |
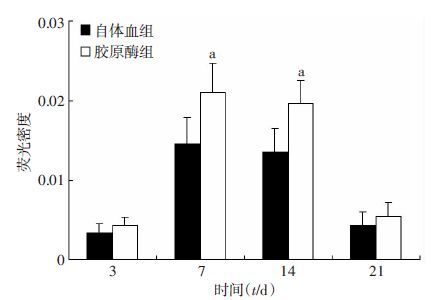
|
| a:P<0.05,与自体血组比较 图 5 两组脑出血模型血肿切片的GFAP平均荧光密度比较 (n=6, x±s) |
3 讨论
自体血或胶原酶注入法是目前应用最为广泛的两种大鼠ICH模型制备方法。一般来说,理想的ICH动物模型应该是能完整模拟和反映人类ICH中的病理生理过程及功能预后的,但考虑到一些实际问题(如造模难度、评估方式等),这显然不太现实。本研究中,我们直接对两种常用ICH模型(初始血肿体积大致相等)进行比较评估,我们初步发现:①自体血组的神经功能缺损程度往往较轻,且较胶原酶组更快恢复;②胶原酶组的血脑屏障损害程度常较重,恢复较慢;③胶原酶模型炎症细胞渗出数量明显多于自体血模型;④自体血模型血肿吸收速度快于胶原酶模型;⑤胶质瘢痕形成情况胶原酶模型多于自体血模型。这些重要结果也阐明了在出血性脑卒中研究中谨慎选用模型制作方法和多种评价指标的必要性。
3.1 两类脑出血模型作为本研究所采用的两种脑出血模型之一,胶原酶是一种能降解基膜及间质中胶原蛋白的蛋白水解酶[12]。在1990年,Rosenberg[5]将细菌源胶原酶(Ⅺ型或Ⅶ型)直接注射入SD大鼠脑尾状核中,构建脑出血动物模型。此模型后续改进包括注射部位,胶原酶浓度,注射速率/量等。理论上来说,胶原酶会促使微小血管降解,血液外渗形成大小可变的血肿[13]。而此模型的优点为它能较好地模拟人类自发性颅内出血[3]及其血肿持续扩大情况[14-15],但缺点为胶原酶会有较明显的炎症反应[3]。
而自体血注射模型已成为实验性动物模型脑出血研究的标志性模型。在1982年,Ropper等[16]首次采用心室内血液注入鼠脑右尾状核区,成功制备脑出血模型。而在1984年,Bullock等[4]使用套管将股动脉同右脑尾状核区桥接,以此来注入血液,但此法缺点为波动性的动脉血压致使实验难以重复。有研究者[17]应用微量注射泵注入自体血液,形成大小稳定的血肿。另有研究者[18]在相关研究中采用两次注血/退针方法造模,但这两种方法缺点都是注入血液时间过长,凝集血块易堵塞针头。
3.2 两类造模法的神经功能损伤比较本研究采用Bederson评分,能较为客观地评测两类脑出血模型的神经功能预后情况[11],并设置了4个时间点,试图探讨两种造模法对大鼠脑神经行为学的影响。图 1表明,经过两种造模方法处理后,行为学评分均逐渐下降,提示神经功能随时间逐渐恢复。Bederson评分与大鼠脑纹状体区功能密切相关[11],以往研究证实部分或完全损伤纹状体区后可以引起大鼠偏瘫,而纹状体区也被认为是脑出血常发生部位之一[8],这些都提示脑出血后大鼠神经功能缺损与纹状体区损伤有密切关系。而在第3、7、14天,自体血组评分明显低于胶原酶组(P<0.05) 说明在相似情况下胶原酶组的脑损伤情况一般重于自体血组。这同既往研究基本一致,即较自体血模型而言,胶原酶模型的神经功能损伤恢复过程往往渐进且不完全[7-8, 17],而且与临床上的脑出血患者持续且较差的神经功能预后情况也是大体相符[18-19]。
3.3 两类造模法的血脑屏障破坏情况比较伊文思蓝渗透性测定与大鼠血脑屏障通透性有着极其紧密的联系[20],当血脑屏障损伤后,其通透性会明显增加,伊文思蓝作为血管渗透性指示剂,可部分代表血脑屏障破坏程度[20]。图 2A表明,自体血组较胶原酶组相比,伊文思蓝渗透量随时间逐渐下降,且在第3、7、14天胶原酶组明显大于自体血组(P<0.05) 这说明胶原酶法较自体血法相比,血脑屏障破坏更严重,而且血脑屏障功能随时间有不同程度的恢复。而脑含水量也同血脑屏障紧密相关[21]。 图 2B表明,每组脑含水量最高值均在脑出血后第3天出现,后随时间逐渐下降,且同时点胶原酶组的脑含水量明显大于自体血组(P<0.05) 伊文思蓝渗透量和脑含水量结果说明,相似条件下与自体血模型相比,胶原酶模型脑出血后期常引起脑组织更严重的损害,而两类模型脑损伤程度不等的主要原因就是两者血脑屏障通透性的差异。首先是胶原酶有易扩散的性质,而且注射剂量越多则血管损害的程度越重,这两点都导致其血脑屏障破坏更为严重,外渗血液更容易扩散至脑实质中(尤其是血肿内及周围组织),而其中大量变性红细胞和炎症细胞则会导致更严重的脑水肿发生,以及产生更广泛的神经毒性作用[22-23]。另有证据表明,血脑屏障崩解的时间节点基本同其他脑组织损伤事件保持一致,比如红细胞变性和脑水肿形成[24],这也从侧面证明以上结论。然而自体血模型仅是在纹状体区及胼胝体区等位置注射自体血液形成大小和形态较为固定的血肿,它更适合脑出血早期形成过程和其病理形态学特点等方面的研究。
图 3可见两组在各时间点均存在不同程度炎症细胞渗出,但各时间点胶原酶组渗出密度程度均明显高于自体血组。我们考虑,较自体血组相比,胶原酶组更易出现血脑屏障结构性损伤,其通透性增加更明显,炎症细胞更容易进入脑实质,进而发挥神经细胞毒性作用和可能存在的协同损伤作用,最终形成恶性循环,即神经细胞变性坏死导致血管通透性增加和血脑屏障损害,这些恶性结果又反馈促进炎症因子释放和脑水肿情况恶化[25-26]。
3.4 两类模型胶质瘢痕形成情况比较星形胶质细胞属于脑细胞中分布及数量较广的神经细胞,它涉及脑部多方面功能,其中它作为血脑屏障重要组成部分并维持其完整性这方面尤为重要。GFAP则视为星形胶质细胞的特异性标志,它可间接表明脑损伤程度[27]。脑损伤激活胶质细胞,进而导致GFAP基因转录,蛋白翻译和表达等一系列变化,最终造成大量GFAP堆积合成,我们称为反应性胶质化。图 4表明,两实验组的脑出血周边区域GFAP表达呈逐渐增高趋势,且在第7天时两组GFAP阳性细胞的胞体显著增大,突触明显增粗,荧光密度较前明显增加。且在第7天和第14天,胶原酶组GFAP表达量即平均荧光密度明显高于自体血组(P<0.05,图 5),这些结果说明胶原酶模型较自体血模型而言,胶质细胞增生严重,结合之前的实验结果我们可以推断胶原酶模型的神经损伤程度更严重,原因可能为两点,一是星形胶质细胞增生致胶质瘢痕增殖,会影响神经轴突重建再生,进而阻碍神经组织的功能恢复[28];二是星形胶质细胞增生可能促进脑损伤后脑内炎症,水肿的发展,进而产生明显的颅内高压[29],最终妨碍病灶区神经损伤后恢复[30]。
综上所述,在损伤程度和恢复等方面,胶原酶注入法和自体血注入法存在显著差异。因此,研究者应该根据具体实验内容选择不同的造模方式,比如当评估长时程的功能预后情况时,通常应选用胶原酶模型,但分析脑出血的具体病理生理过程时,则选择自体血模型更为合适。本实验重点比较了两种常见大鼠脑出血模型在相关损伤和修复等方面的重要差异,以及脑出血过程中的病理变化。但在具体脑出血研究中,如何选择更适合的脑出血模型类型,以及如何利用测量指标有效评估其生理病理过程,这些都有待进一步的实验证实及深入探讨。
| [1] | Mayo N E, Neville D, Kirkland S, et al. Hospitalization and case-fatality rates for stroke in Canada from 1982 through 1991. The Canadian Collaborative Study Group of Stroke Hospitalizations[J]. Stroke,1996, 27 (7) : 1215 –1220. |
| [2] | Broderick J P, Adams H P Jr, Barsan W, et al. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association[J]. Stroke,1999, 30 (4) : 905 –915. |
| [3] | Andaluz N, Zuccarello M, Wagner K R. Experimental animal models of intracerebral hemorrhage[J]. Neurosurg Clin N Am,2002, 13 (3) : 385 –393. |
| [4] | Bullock R, Mendelow A D, Teasdale G M, et al. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings[J]. Neurol Res,1984, 6 (4) : 184 –188. |
| [5] | Rosenberg G A, Mun-Bryce S, Wesley M, et al. Collagenase-induced intracerebral hemorrhage in rats[J]. Stroke,1990, 21 (5) : 801 –807. |
| [6] | Hua Y, Schallert T, Keep R F, et al. Behavioral tests after intracerebral hemorrhage in the rat[J]. Stroke,2002, 33 (10) : 2478 –2484. |
| [7] | MacLellan C L, Davies L M, Fingas M S, et al. The influence of hypothermia on outcome after intracerebral hemorrhage in rats[J]. Stroke,2006, 37 (5) : 1266 –1270. |
| [8] | MacLellan C L, Gyawali S, Colbourne F. Skilled reaching impairments follow intrastriatal hemorrhagic stroke in rats[J]. Behav Brain Res,2006, 175 (1) : 82 –89. |
| [9] | Del-Bigio M R, Yan H J, Buist R, et al. Experimental intracerebral hemorrhage in rats. Magnetic resonance imaging and histopathological correlates[J]. Stroke,1996, 27 (12) : 2312 –2320. |
| [10] | NINDS ICH Workshop Participants. Priorities for clinical research in intracerebral hemorrhage: report from a National Institute of Neurological Disorders and Stroke workshop[J]. Stroke,2005, 36 (3) . |
| [11] | Machado L S, Sazonova I Y, Kozak A, et al. Minocycline and tissue-type plasminogen activator for stroke: assessment of interaction potential[J]. Stroke,2009, 40 (9) : 3028 –3033. DOI:10.1161/STROKEAHA.109.556852 |
| [12] | Harris E D Jr, Krane S M. Collagenases (third of three parts)[J]. N Engl J Med,1974, 291 (13) : 652 –661. |
| [13] | James M L, Warner D S, Laskowitz D T. Preclinical models of intracerebral hemorrhage: a translational perspective[J]. Neurocrit Care,2008, 9 (1) : 139 –152. |
| [14] | Fujii Y. Studies on induced hypothermia for open heart surgery. II. Adequate flow of hypothermic perfusion in the dog[J]. Nihon Geka Hokan,1972, 4 (2) : 149 –159. |
| [15] | Kazui S, Naritomi H, Yamamoto H, et al. Enlargement of spontaneous intracerebral hemorrhage. Incidence and time course[J]. Stroke,1996, 27 (10) : 1783 –1787. |
| [16] | Ropper A H, Zervas N T. Cerebral blood flow after experimental basal ganglia hemorrhage[J]. Ann Neurol,1982, 11 (3) : 266 –271. |
| [17] | MacLellan C L, Auriat A M, McGie S C, et al. Gauging recovery after hemorrhagic stroke in rats: implications for cytoprotection studies[J]. J Cereb Blood Flow Metab,2006, 26 (8) : 1031 –1042. |
| [18] | Fieschi C, Carolei A, Fiorelli M, et al. Changing prognosis of primary intracerebral hemorrhage: results of a clinical and computed tomographic follow-up study of 104 patients[J]. Stroke,1988, 19 (2) : 192 –195. |
| [19] | Fogelholm R, Nuutila M, Vuorela A L. Primary intracerebral haemorrhage in the Jyvaskyla region, central Finland, 1985-89: incidence, case fatality rate, and functional outcome[J]. J Neurol Neurosurg Psychiatry,1992, 55 (7) : 546 –552. |
| [20] | Ma Q, Huang B, Khatibi N, et al. PDGFR-alpha inhibition preserves blood-brain barrier after intracerebral hemorrhage[J]. Ann Neurol,2011, 70 (6) : 920 –931. DOI:10.1002/ana.22549 |
| [21] | Chang C F, Chen S F, Lee T S, et al. Caveolin-1 deletion reduces early brain injury after experimental intracerebral hemorrhage[J]. Am J Pathol,2011, 178 (4) : 1749 –1761. DOI:10.1016/j.ajpath.2010.12.023 |
| [22] | Atlas S W, Thulborn K R. MR detection of hyperacute parenchymal hemorrhage of the brain[J]. AJNR Am J Neuroradiol,1998, 19 (8) : 1471 –1477. |
| [23] | Felberg R A, Grotta J C, Shirzadi A L, et al. Cell death in experimental intracerebral hemorrhage: the “black hole” model of hemorrhagic damage[J]. Ann Neurol,2002, 51 (4) : 517 –524. |
| [24] | Xi G, Keep R F, Hoff J T. Mechanisms of brain injury after intracerebral haemorrhage[J]. Lancet Neurol,2006, 5 (1) : 53 –63. |
| [25] | Woodcock T, Morganti-Kossmann M C. The role of markers of inflammation in traumatic brain injury[J]. Front Neurol,2013, 4 : 18 . DOI:10.3389/fneur.2013.00018 |
| [26] | Clausen F, Hanell A, Israelsson C, et al. Neutralization of interleukin-1beta reduces cerebral edema and tissue loss and improves late cognitive outcome following traumatic brain injury in mice[J]. Eur J Neurosci,2011, 34 (1) : 110 –123. DOI:10.1111/j.1460-9568.2011.07723.x |
| [27] | Saenger A K, Christenson R H. Stroke biomarkers: progress and challenges for diagnosis, prognosis, differentiation, and treatment[J]. Clin Chem,2010, 56 (1) : 21 –33. DOI:10.1373/clinchem.2009.133801 |
| [28] | Wanner I B, Anderson M A, Song B, et al. Glial scar borders are formed by newly proliferated, elongated astrocytes that interact to corral inflammatory and fibrotic cells via STAT3-dependent mechanisms after spinal cord injury[J]. J Neurosci,2013, 33 (31) : 12870 –12886. DOI:10.1523/JNEUROSCI.2121-13.2013 |
| [29] | Laird M D, Vender J R, Dhandapani K M. Opposing roles for reactive astrocytes following traumatic brain injury[J]. Neurosignals,2008, 16 (2/3) : 154 –164. DOI:10.1159/000111560 |
| [30] | Sofroniew M V, Vinters H V. Astrocytes: biology and pathology[J]. Acta Neuropathol,2010, 119 (1) : 7 –35. DOI:10.1007/s00401-009-0619-8 |



