近年研究证实动脉粥样硬化(atherosclerosis,AS)的形成不仅与过量的脂质在动脉壁沉积相关,还与多种免疫细胞参与的慢性免疫炎症反应密切相关[1]。在尿毒症状态下,其AS的形成往往更快,程度更重,这一现象被称为尿毒症加速性动脉粥样硬化[2]。其可能与营养不良、同型半胱氨酸增多、氧化应激、尿毒症毒素等相关[3],但最终引起尿毒症加速性动脉粥样硬化的病因并不完全清楚。树突状细胞(dendritic cells,DCs)作为体内功能最强的抗原提呈细胞,其主要功能是启动和调节淋巴细胞介导的免疫反应,成熟DCs可迁移入淋巴结,激活幼稚和记忆的T细胞[4],释放相关炎性因子,使得循环中的未成熟DCs逐渐成熟,并迁移入炎性组织促发免疫炎症反应,在免疫炎症反应的发生、发展中扮演着重要角色[5]。研究显示:DCs与普通AS的发病密切相关,在动脉硬化斑块中有大量成熟DCs聚集[6],通过抑制DCs功能成熟能明显改善普通AS发生、发展及预后[7]。但在尿毒症背景下,DCs是否参与加速性动脉粥样硬化及其在加速性演变过程中的作用及分子机制尚不清楚。
过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)是一种核转录因子。近年研究发现PPARγ激动剂可通过阻断DCs内丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和NF-κB信号通路抑制DCs的成熟和迁移[8],从而降低DCs刺激的T淋巴细胞反应[9]。PPARγ激动剂通过抑制DCs的功能成熟及活化可有效防治普通AS的进展[10, 11]。因此,我们设立PPARγ激动剂治疗组,观察动脉内膜变化与DCs的关系。
在小鼠中,CD11c及CD83是DCs的特异性表面标志,在抗原提呈方面起着重要作用,也与动脉硬化斑块中DCs的激活及成熟相关[12]。而成熟DCs分泌的促炎因子白介素-12(interleukin-12,IL-12)是细胞免疫中的关键因子,其生物学功能包括刺激T细胞、NK细胞分泌干扰素-γ,促进CD4+T细胞向Th1细胞分化等进行机体免疫调节[13]。基于以上理论依据,我们通过检测动脉内膜及脾脏中CD11c、CD83的表达及外周血中IL-12的分泌,了解疾病中树突状细胞的状态。
1 材料与方法 1.1 主要试剂与仪器油红O染剂(Sigma公司),全自动生化分析仪(Beckman美国),TRIzol(Invitrogen公司),CD11c Antibody、CD83 Antibody(NOVUS公司),流式细胞仪、仓鼠抗小鼠CD11c-FITC单克隆抗体、兔抗小鼠CD83-PE单克隆抗体(BD公司),BCA试剂盒(Thermo Scientific公司),IL-12p70 ELISA kit(武汉优尔生生物公司),罗格列酮(Solarbio LIFE SCIENCES)。
1.2 实验动物与动物模型构建ApoE-/-C57小鼠30只,野生型C57小鼠10只,均为6周龄,雄性,体质量18~20 g,购自北京维通利华公司,饲养于本院中心实验室。30只ApoE-/-C57小鼠采用随机数字表法分为治疗组、尿毒症组、动脉硬化组,每组10只小鼠;10只野生型C57小鼠为对照组。所有小鼠饲养普通饲料1周后开始建模,ApoE-/-小鼠每天饲以高脂饮食(配方:普通饲料79.8%,猪油20%,胆固醇0.2%),促进动脉斑块形成;C57小鼠饲以普通饮食。治疗组及尿毒症组行肾脏大部分损毁术;术后6周,治疗组予以罗格列酮20 mg/(kg·d)灌胃治疗,其余2组予以等量生理盐水灌胃,5周后干预治疗结束。
1.3 血清生化检测实验12周后,自小鼠眼静脉丛取血。TBA-40FR全自动生化分析仪检测血清中的各项生化指标:总胆固醇(TC)、甘油三酯(TG)、尿素氮(BUN)。
1.4 胸主动脉整体油红O染色分离胸主动脉,去除外膜和结缔组织,纵向剖开后内膜面向上固定于操作台,进行整体主动脉油红O染色,以数码相机拍摄内膜照片。Image Pro Plus 6.0图像分析软件(Cyber Media,美国)测量模块,分析得到胸主动脉斑块面积分数。
1.5 Western blot检测Western blot检测胸主动脉中CD11c、CD83蛋白浓度,运用BCA蛋白浓度测定试剂盒测定动脉匀浆 中的总蛋白浓度,等量的蛋白提取物分别添加在7.5%、 10%、15%的SDS-PAGE加样孔中进行电泳实验,后用PVDF膜进行转膜。转膜完成后立即把蛋白膜放置到
预先准备好的Western洗涤液中,吸干洗涤液后,加入anti-CD11c、anti-CD83共同孵育,加入Western封闭液,4 ℃封闭过夜。孵育后洗膜,按照适当比例(1 ∶10 000)稀释辣根过氧化物酶(HRP)标记的二抗,并在37 ℃下进一步培养1 h,洗涤几次后,电化学发光法检测阳性条带,进行半定量分析。
无菌取脾,收集脾细胞悬液,调整细胞密度为1×106/mL。取100 μL悬液,加入10 μL CD11c-FITC及10 μL CD83-PE,另取100 μL悬液加入相应的免疫球蛋白抗体作为对照组。室温、暗室内孵育20 min后洗涤,混匀后用流式细胞仪(美国BD公司,FACS)检测分析。测试后用CellQustPlot软件分析数据,获得阳性细胞用百分数表示。
1.7 ELISA检测按试剂盒说明书,用酶标仪在450 nm波长测量各孔的光密度值[D(450)],检测血清中IL-12p70表达水平。
1.8 统计学分析采用SPSS 18.0统计软件,数据以x±s表示,组间各对应指标差异性检验采用独立样本t检验。
2 结果 2.1 各组小鼠外周血的生化指标治疗组与尿毒症组比较:TC升高,TG降低(P<0.05);治疗组分别与动脉硬化组、对照组比较:TC、TG、BUN均升高(P<0.05)。尿毒症组分别与动脉硬化组、对照组比较:TC、TG、BUN均升高(P<0.05);动脉硬化组与对照组比较:TC升高(P<0.05,表 1)。
| (mmol/L,n=5,x±s) | |||
| 组别 | TC | TG | BUN |
| 治疗组 | 37.83±0.58ac | 1.51±0.18ac | 30.72±1.41ac |
| 尿毒症组 | 34.49±0.89ab | 2.44±0.10ab | 29.84±0.53ab |
| 动脉硬化组 | 19.23±2.06a | 0.88±0.06a | 8.54±0.64a |
| 对照组 | 2.05±0.09 | 0.98±0.07 | 10.18±0.32 |
| a:P<0.05,与对照组比较;b:P<0.05,与动脉硬化组比较;c:P<0.05,与尿毒症组比较 | |||
治疗组与动脉硬化组比较,斑块面积分数降低[(17.12±5.90)% vs (38.07±3.81)%,P<0.05];动脉硬化组与尿毒症组比较,动脉斑块面积分数降低[(38.07±3.81)% vs (55.09±1.34)%,P<0.05];对照组未见斑块形成(图 1)。
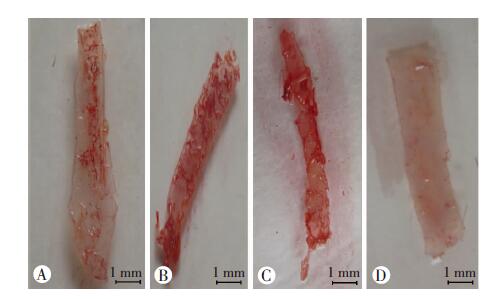 |
| A:治疗组;B:尿毒症组;C:动脉硬化组;D:对照组 红色为粥样斑块图 1 油红O染色观察小鼠胸主动脉粥样斑块 |
与对照组比较,治疗组CD11c、CD83表达均升高(P<0.05);与动脉硬化组比较,治疗组CD11c、CD83表达均降低(P<0.05);与尿毒症组比较,动脉硬化组CD11c、CD83表达均降低(P<0.05,图 2、3)。
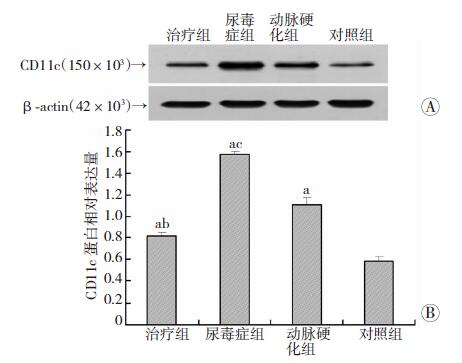 |
| A:Western blot检测;B:半定量分析 a: P<0.05,与对照组比较;b: P<0.05,与尿毒症组比较;c: P<0.05,与动脉硬化组比较图 2 Western blot检测各组小鼠动脉内膜中CD11c的表达 |
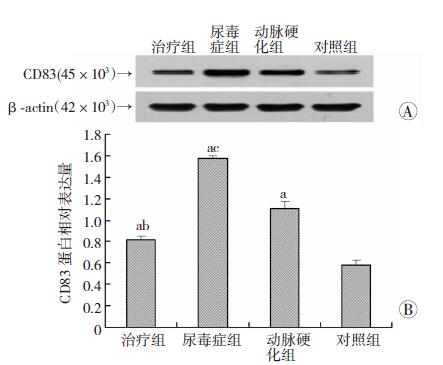 |
| A:Western blot检测;B:半定量分析 a: P<0.05, 与对照组比较;b: P<0.05,与尿毒症组比较;c: P<0.05,与动脉硬化组比较图 3 Western blot检测各组小鼠动脉内膜中CD83的表达 |
治疗组与尿毒症组比较,CD11c、CD83表达降低 [(1.22±0.02)% vs (3.06±0.07)%,(3.12±0.10)% vs (6.96±0.06)%,P<0.05];与对照组比较[(4.02±0.12)%、 (8.03±0.04)%],尿毒症组CD11c、CD83表达降低(P<0.05),动脉硬化组CD11c、CD83表达[(5.04±0.13)%、(11.48±0.14)%]升高(P<0.05,图 4、5)。
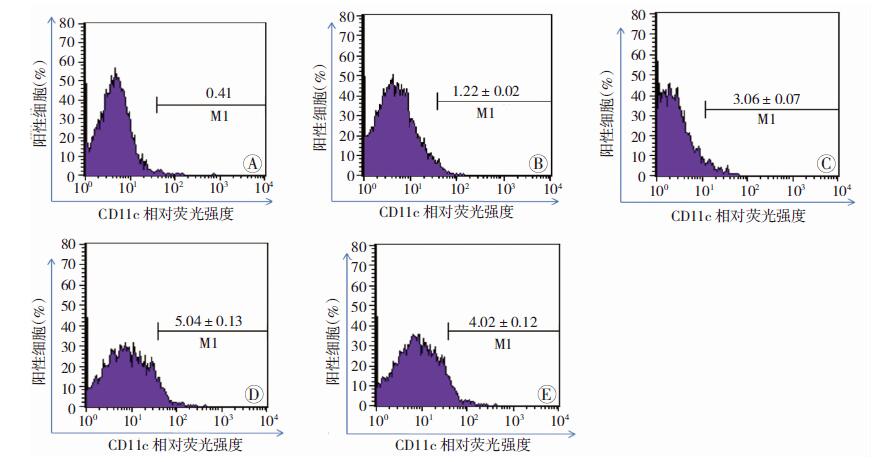 |
| A: CD11c同型对照:B:治疗组;C:尿毒症组;D:动脉硬化组;E:对照组图 4 流式细胞仪检测CD11c在各组小鼠脾脏中的表达 |
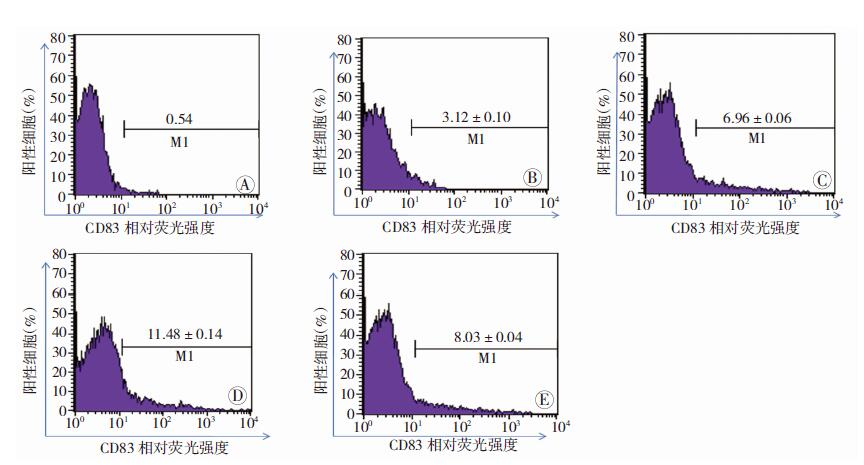 |
| A: CD83同型对照:B:治疗组;C:尿毒症组;D:动脉硬化组;E:对照组图 5 流式细胞仪检测CD83在各组小鼠脾脏中的表达 |
治疗组较尿毒症组IL-12p70分泌降低[(34.25±11.27)ng/L vs (57.11±3.11)ng/L,P<0.05],尿毒症组较对照组IL-12p70分泌[(74.00±2.47)ng/L]降低(P<0.05),对照组较动脉硬化组IL-12p70分泌[(116.00±8.72)ng/L]降低(P<0.05)。
3 讨论动脉粥样硬化是导致多种心血管疾病的病理基础,而尿毒症状态下其动脉病变更重,即尿毒症加速性动脉粥样硬化[14],这使得心血管疾病成为导致尿毒症患者死亡的重要原因。目前,慢性动脉炎症和免疫细胞及其产物在动脉粥样硬化发生、发展中的作用已被广泛接受,而在某些感染及免疫调节异常的情况下,往往存在加速性动脉粥样硬化形成,通常与激活固有及获得性免疫细胞,促发全身炎症反应的发生相关[15, 16]。尿毒症状态下同样存在免疫系统紊乱、系统性炎症反应,以及加速性动脉粥样硬化的发生。我们设想其加速性动脉粥样硬化的病因与免疫紊乱相关。DCs作为免疫反应的“始动者”,在免疫反应发生、发展中具有重要地位[4, 5, 6],因此,本实验以其为研究对象。本研究展示了在尿毒症加速性动脉粥样硬化小鼠中DCs的状态,证实通过抑制DCs成熟可以明显减轻其动脉粥样硬化病变。构建尿毒症加速性动脉粥样硬化动物模型,造模完成并检测尿毒症及治疗组血清生化指标均达到肾衰标准,且与动脉硬化组比较,其血脂增高,动脉斑块面积增大(P<0.05),显示造模成功。本研究发现在动脉内膜中,尿毒症组较动脉硬化组中成熟DCs增多,同时伴随有更为严重的粥样硬化斑块形成(P<0.05)。目前大量研究已证实DCs在普通动脉粥样硬化中的重要作用,在疾病进展过程中,其从外周淋巴组织迁移至动脉管壁,加重动脉病变,考虑在合并有尿毒症导致的免疫紊乱中,更多的DCs迁移入动脉内膜中,增生活化,加重动脉病变。为了证实这一猜想,我们设立PPARγ激动剂治疗组。治疗一定时期后,发现治疗组的动脉斑块面积明显减少,且内膜中成熟DCs减少(P<0.05),说明在尿毒症加速性动脉粥样硬化小鼠中,动脉内膜增生程度与内膜中成熟DCs数量成正相关。研究显示脾脏中尿毒症组较动脉硬化组成熟DCs减少(P<0.05),考虑有以下原因:尿毒症状态下存在免疫功能紊乱,大量免疫细胞耗竭,外周DCs减少[17];脾脏等次级淋巴器官中的成熟DCs向内膜斑块处迁移。治疗组较尿毒症组在动脉斑块及脾脏内成熟DCs均减少(P<0.05),说明治疗组通过抑制动脉斑块及脾脏内成熟DCs,而减轻尿毒症加速性动脉粥样硬化。
IL-12是成熟DCs分泌的促炎因子,是DCs功能活化的标志,可代表外周免疫炎症状态。研究证实,在普通动脉粥样硬化中,IL-12呈现与动脉斑块中成熟DCs相同的变化趋势[18, 19]。本研究中尿毒症组与动脉硬化组比较,动脉斑块中成熟DCs增多,但外周IL-12分泌减低(P<0.05),考虑可能与尿毒症状态下的免疫系统紊乱相关,即在动脉局部有免疫激活,但外周呈现免疫抑制。
综上所述,本研究成功构建ApoE-/-小鼠尿毒症加速性动脉粥样硬化模型,证实与普通动脉硬化比较,尿毒症加速性动脉粥样硬化小鼠的动脉内膜中成熟DCs增多,通过抑制动脉内膜及脾脏内DCs成熟,可以减轻动脉内膜粥样硬化病变,提示在防治尿毒症患者的慢性心血管疾病时,干预DCs将成为一个重要的靶点。
| [1] | 冯向阳, 马建亮. CD4+CD25+Treg调节性T细胞及其细胞因子在大鼠动脉粥样硬化中改变的研究. 临床合理用药, 2014, 7(4): 3-5. |
| [2] | Pedersen T X, Bro S, Andersen M H, et al. Effect of treatment with human apolipoprotein A-I on atherosclerosis in uremic apolipoprotein-E deficient mice. Atherosclerosis, 2009, 202(2): 372-381. |
| [3] | Panichi V, Migliori M, De-Pietro S, et al. C-reactive protein as a marker of chronic inflammation in uremic patients. Blood Purif, 2000, 18(3): 183-190. |
| [4] | Banchereau J, Briere F, Caux C, et al. Immunobiology of dendritic cells. Annu Rev Immunol, 2000, 18: 767-811. |
| [5] | Sallusto F, Mackay C R, Lanzavecchia A. The role of chemokine receptors in primary, effector, and memory immune responses. Annu Rev Immunol, 2000, 18: 593-620. |
| [6] | Hjerpe C, Johansson D, Hermansson A, et al. Dendritic cells pulsed with malondialdehyde modified low density lipoprotein aggravate atherosclerosis in Apoe(-/-) mice. Atherosclerosis, 2010, 209(2): 436-441. |
| [7] | Dietel B, Muench R, Kuehn C, et al. MCS-18, a natural product isolated from Helleborus purpurascens, inhibits maturation of dendritic cells in ApoE-deficient mice and prevents early atherosclerosis progression. Atherosclerosis, 2014, 235(2): 263-272. |
| [8] | Draper E, Reynolds C M, Canavan M, et al. Omega-3 fatty acids attenuate dendritic cell function via NF-kappaB independent of PPARgamma. J Nutr Biochem, 2011, 22(8): 784-790. |
| [9] | Klotz L, Dani I, Edenhofer F, et al. Peroxisome proliferator-activated receptor gamma control of dendritic cell function contributes to development of CD4+ T cell anergy. J Immunol, 2007, 178(4): 2122-2131. |
| [10] | Jung K, Tanaka A, Fujita H, et al. Peroxisome proliferator-activated receptor gamma-mediated suppression of dendritic cell function prevents the onset of atopic dermatitis in NC/Tnd mice. J Allergy Clin Immunol, 2011, 127(2): 420-429. e1-429. e6. |
| [11] | 金雪婷. 普罗布考通过树突状细胞抗动脉粥样硬化的机制的研究. 上海: 复旦大学, 2012. |
| [12] | Koltsova E K, Ley K. How dendritic cells shape atherosclerosis. Trends Immunol, 2011, 32(11): 540-547. |
| [13] | Schaper K, Kietzmann M, Baumer W. Sphingosine- 1-phosphate differently regulates the cytokine production of IL-12, IL-23 and IL-27 in activated murine bone marrow derived dendritic cells . Mol Immunol, 2014, 59(1): 10-18. |
| [14] | Yu J, Deng M, Zhao J, et al. Decreased expression of klotho gene in uremic atherosclerosis in apolipoprotein E-deficient mice. Biochem Biophys Res Commun, 2010, 391(1): 261-266. |
| [15] | Sorrentino R, Yilmaz A, Schubert K, et al. A single infection with Chlamydia pneumoniae is sufficient to exacerbate atherosclerosis in ApoE deficient mice . Cell Immunol, 2015, 294(1): 25-32. |
| [16] | Clement M, Charles N, Escoubet B, et al. CD4+CXCR3+ T cells and plasmacytoid dendritic cells drive accelerated atherosclerosis associated with systemic lupus erythematosus. J Autoimmun, 2015, 63: 59-67. |
| [17] | 孙文学, 戴勇, 齐晖, 等. 终末期肾脏病患者外周血树突状细胞的数量及活性. 上海医学, 2007, 30(2): 86-90. |
| [18] | Yilmaz A, Lochno M, Traeg F, et al. Emergence of dendritic cells in rupture-prone regions of vulnerable carotid plaques. Atherosclerosis, 2004, 176(1): 101-110. |
| [19] | Takeda M, Yamashita T, Sasaki N, et al. Oral administration of an active form of vitamin D3 (calcitriol) decreases atherosclerosis in mice by inducing regulatory T cells and immature dendritic cells with tolerogenic functions. Arterioscler Thromb Vasc Biol, 2010, 30(12): 2495-2503. |



