2. 400038 重庆,第三军医大学西南医院超声科
2. Department of ultrasonography, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
肾细胞癌(renal cell carcinoma,RCC)的诊断和治疗仍存在亟待解决的难题。诊断方面,尽管传统的影像学检查,如超声、CT可发现0.5 cm甚至更小的肾脏占位,但在鉴别良恶性方面仍存在严重不足,约20%影像学高度怀疑恶性肿瘤的患者术后病理证实为良性病变[1]。因误诊而行肾切除不仅导致重要器官的损失,也引发了一些医疗纠纷。超声微泡可使组织增强显影,为解决RCC诊断面临的困难提供了可能。目前临床使用的超声微泡为微米级,不能穿过血管进入组织间隙,且不具备靶向性。我们前期已制备了能穿过肿瘤血管进入组织间隙的纳米微泡(nanoscale microbubbles,NBs),证实其可增强组织显影,通过在NBs表面携载针对细胞膜抗原的单克隆抗体,实现了纳米微泡的靶向性[2, 3]。因此,本研究拟制备靶向于肾细胞癌的NBs,通过在NBs表面上连接针对肾细胞癌相关抗原G250的单克隆抗体构建靶向超声分子探针,从而从超声分子影像学方面为肾细胞癌的诊断提供一种特异性和灵敏性高的新方法。
1 材料与方法 1.1 材料和仪器 1.1.1 细胞和裸鼠786-O和ACHN肾细胞癌细胞均购于中国上海细胞所,其中786-O为G250阳性表达细胞,而ACHN为G250阴性表达细胞;BLBA/c雄、雌性裸鼠(购自北京华阜康生物科技股份有限公司),共8只,4~5周龄,体质量(18.1±0.5) g,SPF条件下饲养(第三军医大学西南医院中心实验室)。
1.1.2 试剂和仪器小鼠抗人的G250单克隆抗体购自Abcam公司;细胞培养基RPMI1640和 MEM购自HyClone公司;胎牛血清购于Gibco公司;iU22超声系统荷兰系飞利浦公司产品。
1.2 方法 1.2.1 生物素化抗体的制备将80 μL G250单克隆抗体溶于标记缓冲液混匀,于12 000 r/min离心10 min,收集抗体;加入0.53 μL生物素溶液和一定量的标记缓冲液,混匀放置于37 ℃孵育30 min,再次离心;加适量的标记缓冲液混匀,使终体积为20 μL,进行分离;加入40 μL标记保存液,混匀,得到生物素化抗体。
1.2.2 空白纳米微泡的制备按一定比例称重二棕榈酰磷脂酰胆碱 (DPPC,瑞典Genzyme Pharmaceuticals公司),生物素化二硬脂酰磷脂酰乙醇胺(Bio-DSPE,美国Avanti公司)于试管中,加入PBS和甘油的混合液,置入一个小型旋涡混合器将其混匀;将混合物放置于45 ℃水浴30 min;其后转移至西林瓶,全氟丙烷置换瓶中的空气;将西林瓶置于往复式ST银汞胶囊振荡器,振荡60 s,于4 ℃的冰箱中静置过夜,收集得到空白纳米微泡。
1.2.3 靶向纳米微泡的制备空白纳米微泡的制备方法同1.2.2;超纯水稀释空白纳米微泡,按每107个微 泡加入3 μg亲和素进行混匀;4 ℃反应1 h,在300 r/min 条件下洗涤离心 2 min,重复3次。将1.2.1 制备的生物素标记的G250单克隆抗体按107个微泡 ︰0.56 μL 生物素华抗体的比例加入到悬液中,4 ℃ 反应1 h,离心并收集上层液体即为靶向纳米微泡。
1.2.4 评估靶向纳米微泡50 μL制备好的空白纳米微泡和靶向纳米微泡,分别加入10 μL FITC羊抗小鼠荧光二抗(武汉博士德生物公司)于两组微泡中,轻摇混匀,避光,置于37 ℃的孵箱完全反应1 h,在300 r/min条件下离心得到靶向纳米微泡,在荧光显微镜下观察两种纳米微泡表面荧光情况。
1.2.5 免疫荧光786-O和ACHN两种细胞均收集于对数期,胰酶消化、计数、离心、制作细胞爬片;4%的多聚甲醛固定30 min,PBS洗涤3次;1%的BSA封闭30 min,加入1 ∶400稀释的小鼠抗人的G250单克隆抗体30 μL于载玻片,4 ℃过夜;PBS洗涤3次,加入1 ∶400 稀释的FITC羊抗小鼠的荧光二抗30 μL,37 ℃避光反应1 h;PBS洗涤3次,DAPI(碧云天生物技术研究所)染色;PBS洗涤3次,甘油封片,倒置荧光显微镜下观察两种细胞荧光情况。
1.2.6 靶向纳米微泡对786-O和ACHN两种肾细胞癌细胞的体外结合实验786-O和ACHN细胞的爬片制作过程同1.2.5。每种肾细胞癌细胞的爬片分两组:一组加30 μL的空白纳米微泡;另一组加30 μL 的靶向纳米微泡;将细胞爬片置于37 ℃反应1 h,PBS漂洗3次;在光学显微镜下观察细胞和两组纳米微泡的结合情况。
1.2.7 两种肾细胞癌裸鼠模型的建立786-O和ACHN两种肾细胞癌细胞均在细胞生长的对数期收集、胰酶消化,计数、离心;加入无血清培养基悬浮细胞,使细胞浓度达到107/mL。每只裸鼠麻醉腹腔注射150 μL 5%的水合氯醛麻醉,俯卧位固定。共8只裸鼠,分为786-O组合ACHN组,每组4只。每只裸鼠背部皮下按照基质胶:细胞体积为1 ∶1注射浓度为2.5×107个786-O细胞共200 μL构建786-O 模型组,ACHN模型组采用同样的方法每只裸鼠注射2.5×106个细胞;当肿瘤长至约10 mm大小时,实施超声造影实验。所有动物实验获得第三军医大学实验动物伦理委员会同意。
1.2.8 超声增强显影实验裸鼠的麻醉过程同1.2.7。俯卧位固定裸鼠,充分暴露裸鼠背部肿块,用iu22超声诊断仪和50 mm超宽频线阵探头L12-5在B型模式下寻找肿瘤最大切面并固定探头;用超纯水将空白纳米微泡和靶向纳米微的浓度稀释为(0.5~1)×108/mL。每只裸鼠经尾静脉注射0.2 mL空白纳米微泡,随后使用超纯水冲洗血管残留微泡。待空白纳米微泡完全清除后,相同量的靶向靶向纳米微泡从相同部位注射入裸鼠体内,再次进行图像采集;超声均值(dB)和超声最大值(dB)均由飞利浦QLab 8.1软件分析处理得到。
1.3 统计学处理使用SPSS 20.0 处理所得数据,计量资料用 x±s表示。采用单因素方差分析分析两种微泡在体外的稳定性、 配对t检验对体内两种纳米微泡的造影数据进行比较。
2 结果 2.1 空白纳米微泡和靶向纳米微泡的制备生物素化的空白纳米微泡和靶向纳米微泡原液均为乳白色的液体。在倒置光学显微镜400倍下观察时,空白纳米微泡为圆形、形状大小均一、分布均匀、无聚集。镜下观察靶向纳米微泡,形状、大小与空白纳米微泡无明显差异(图 1A、B)。FITC羊抗小鼠荧光二抗加入空白纳米微泡和靶向纳米微泡后,37 ℃孵育1 h。在倒置荧光显微镜400倍下观察,可见靶向纳米微泡表面发出绿色的荧光(图 1D),此现象提示靶向微泡表面携带了G250单克隆抗体,从而能够与荧光二抗发生特异性结合,产生绿色荧光。然而空白纳米微泡表面无任何荧光发出(图 1C),即没有发生抗原-抗体间的特异性结合。
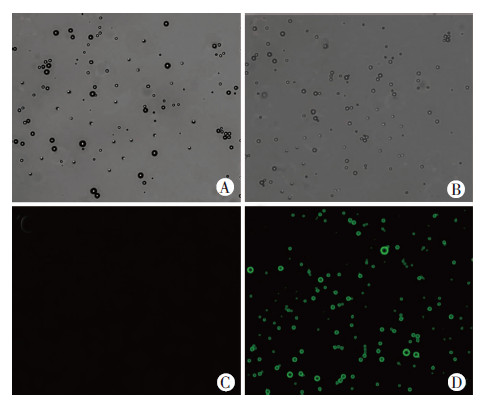 |
| A:光镜下观察空白纳米微泡;B:光镜下观察靶向纳米微泡;C:荧光显微镜下观察空白纳米微泡;D:荧光显微镜下观察靶向纳米微泡 图 1 镜下观察空白纳米微泡和靶向纳米微泡变化(×400) |
微泡保存在4 ℃的冰箱中,纳米微泡保存的第1、3、5天,两种纳米微泡的直径没有明显增大,空白纳米微泡的直径从404.9 nm上升到476 nm,靶向纳米微泡的直径从611.4 nm上升到652.2 nm。然而,微泡保存到第10天,两种微泡的直径较前5 d明显增大,空白纳米微泡的直径增大为768.0 nm,靶向纳米微泡的直径增大到885.6 nm。微泡保存的10 d中,前5 d的增大趋势明显小于 后5 d的增大趋势(图 2A)。保存到第5天时,两种微泡的浓度分别为(6.04±0.15)× 107/mL、(6.236±0.27) ×107 /mL。第1、3、5天 的两种微泡的浓度无明显变化(P>0.05)。保存到第10天,两种微泡的浓度分别为(4.59±0.40)×107/mL、 (4.63±0.16)×107/mL。第10天较第1、3、5天的浓度有明显的变化(P<0.01,图 2B、C)
 |
| A:空白微泡和靶向微泡直径随时间变化情况; B:空白微泡浓度随时间变化情况;C:靶向微泡浓度随时间变化情况 a:P<0.01,与第1、3、5天比较 图 2 空白微泡和靶向微泡直径与浓度随时间变化情况 |
786-O和ACHN两种肾细胞癌经过小鼠抗人的G250单克隆抗体、FITC羊抗小鼠荧光孵育,DAPI染色后于倒置荧光镜下观察。786-O细胞膜发出绿色的荧光,细胞核发出蓝色的荧光(图 3A~C);ACHN细胞细胞 核发出蓝色的荧光,而细胞膜上没有荧光发出(图 3D~F)。这一结果说明了786-O细胞膜高表达G250抗原,而ACHN细胞膜不表达G250抗原。
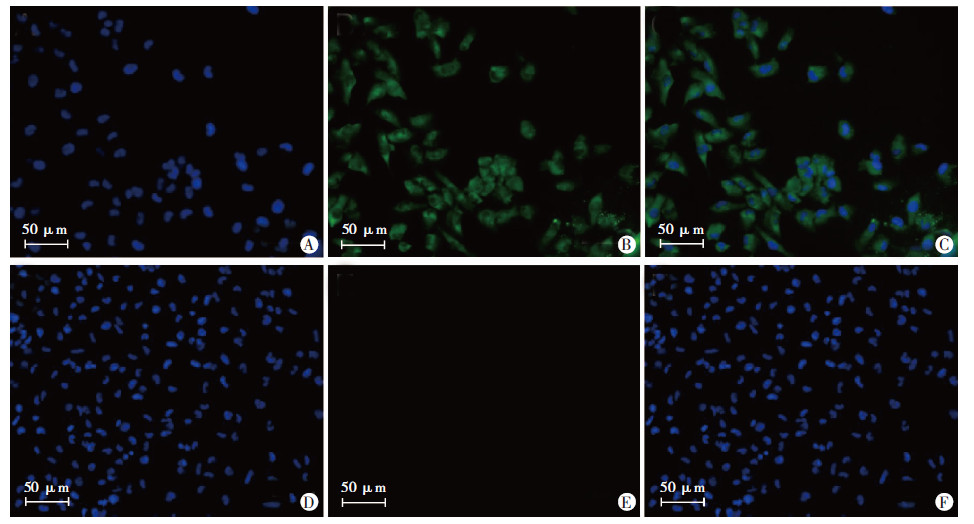 |
| A: 786-O细胞核,B:786-O细胞膜C: A与B的融合图像;D:ACHN细胞核,E:ACHN细胞膜,F:D与E的融合图像 图 3 两种肾细胞癌细胞膜G250抗原表达情况 |
在倒置光学显微镜下观察微泡和细胞结合情况。在786-O肾癌细胞,空白纳米微泡组的细胞周围未见到明显的纳米微泡(图 4A),靶纳米微泡组可见许多微泡粘附在细胞表面(图 4B);在ACHN肾癌中,空白纳米微泡组和靶向微泡组的细胞周围均未见明显的微泡(图 4C、D)。此结果表明靶向纳米微泡粘附786-O细胞表面是由于细胞膜发生了G250抗原抗体结合反应,从而靶向纳米微泡具有了寻靶能力。
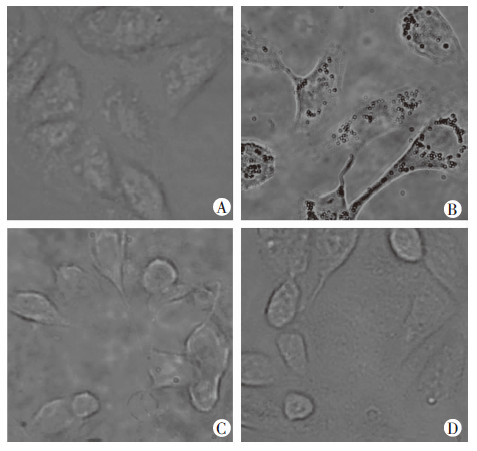 |
| 空白纳米微泡与786-O细胞(A)及ACHN细胞(C)结合情况,靶向纳米微泡与786-O细胞(B)及ACHN细胞(D)结合情况 图 4 两种微泡体外结合能力实验 (×400) |
在786-O肾癌裸鼠模型中,靶向纳米微泡的增强显影效果好于空白纳米微泡(图 5A、B);在ACHN肾癌裸鼠模型中,靶向纳米微泡的增强显影效果较空白纳米微泡无明显的提高(图 5C、D)。两种纳米微泡的超声平均值和超声最大值在两种裸鼠模型中进行比较(表 1)。结果发现,在786-O肾细胞癌模型中,靶向微泡和纳米微泡的超声均值(P=0.01)和超声最大值(P=0.03)差异有统计学意义;在ACHN肾癌模型中,靶向纳米微泡和空白纳米微泡的超声均值 (P=0.204)及超声最大值(P=0.866)差异无统计学意义。此结果说明了靶向纳米微泡能够穿过肿瘤微血管,进入肿瘤实质,进行特异性的结合,具有体内寻靶能力。
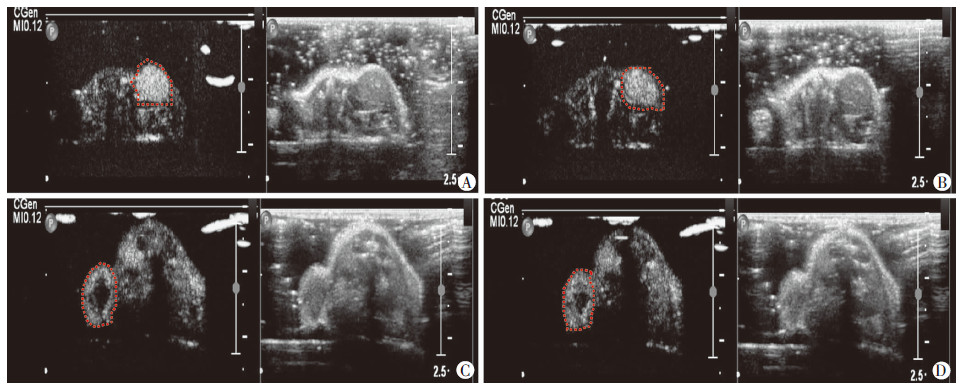 |
| A:靶向纳米微泡在786-O模型显影,B:空白纳米微泡在786-O模型显影,C:靶向纳米微泡在ACHN模型显影,D:空白纳米微泡在ACHN模型显影 红色虚线勾画的为B超固定下肿瘤最大切面 图 5 两种微泡在裸鼠模型显影效果 |
| (dB, x±s) | ||
| 裸鼠模型 | 超声均值 | 超声最大值 |
| 786-O移植瘤 | ||
| 空白微泡 | 11.74±0.52 | 13.07±0.94 |
| 靶向微泡 | 16.34±0.40 | 18.09±0.82 |
| ACHN 移植瘤 | ||
| 空白微泡 | 9.01±0.99 | 13.04±0.42 |
| 靶向微泡 | 9.82±0.67 | 13.05±0.30 |
RCC是泌尿系统疾病的常见的恶性肿瘤,其发病率占肿瘤疾病的2%~3%。2014年美国癌症协会估计有63 920人患肾癌,而且有5 580人因肾细胞癌而死亡[4]。最近几十年来,肾细胞癌的发病率呈上升趋势[5],同时局灶性的早期肾细胞癌的比例明显地高于晚期肾细胞癌和转移性的肾细胞癌[6]。在RCC的发病的早期,血尿、腹部肿块、腰痛等RCC的三大典型症状在患者身上并不明显。由于RCC对放疗化疗均不敏感,目前手术切除为治疗手术切除的治疗方法。常规的影像学检查方法可以发现更小的肾脏肿块,但是这些检查方法不能区分肿块的良恶性质,造成临床医师的误诊,进而造成重要器官的丢失,引发一系列的医疗纠纷,给患者及家属带来严重的不良后果。因此,我们亟须寻找一种新的检查方法或者技术来提高RCC的诊断准确率,减少误诊漏诊。
超声分子成像技术作为近年来迅速发展的一项新的技术,即通过静脉将靶向微泡注射入血液,微泡随血液循环达到全身各处,特异性识别相应的组织和器官及对其超声增强显影。超声分子成像技术已经用于血栓、炎症、动脉粥样硬化的诊断成像技术[7, 8]。超声造影剂是超声分子成像技术实施的一个关键部分,与微米微泡比较,纳米微泡有以下优点:①更强的穿透力;由于其粒径较小更容易穿过血管内皮细胞间隙,进入实质进行显影,肿瘤效果尤甚[10]。②聚集成像是纳米微泡的另一重要特征[11],因此能显著提高造影图像的信噪比。③更好的稳 定性,可以更长的时间保存以及在血液循环中不易破裂[12]。特异性的靶向分子是超声分子成像技术的另一个关键部分,它可以高效特异性的和相应的小的化学分子、大的细胞表面分子或者跨膜蛋白靶向分子(如受体、配体)相结合。特异性的靶向分子已经广泛的应用于临床疾病的诊断和治疗[13, 14, 15]。因此,可以将超声微泡和靶向分子结合起来形成靶向超声微泡,进一步对相关性疾病进行诊断和治疗。
近年研究发现纳米微泡在超声的作用下可以穿过血管壁。Zha等[16]研发了一种CuS-ST68 的新型纳米微泡,成功的实施了超声增强显影以及对肿瘤细胞靶向光热消融。Wu 等[17]制备了一种粒径大小约为200 nm大小的具有良好的稳定性的纳米微泡,同时他们发现这种纳米微泡的稳定性和声学特征比临床广泛应用的Definity微泡的效果更佳。Deng 等[18] 制备一种载阿霉素的高分子材料的载药纳米微泡,载药纳米微泡实验组在超声作用下较单用阿霉素对照组对HeLa肿瘤细胞有明显生长抑制作用。
G250抗原又称为碳酸酐酶IX,属于碳酸酐酶家族中的一员。它位于细胞膜的一种跨膜糖蛋白,具有调节细胞呼吸和催化CO2+H2O HCO-3+H+来控制细胞内外的H+的浓度从而达到调节细胞内外pH值等重要作用[19, 20]。G250抗原高度表达于透明细胞肾癌(clear cell renal cell carcinoma,ccRCC)和大部分其他类型肾细胞癌,但不表达于正常的肾脏组织[19, 21]。因此,很多研究人员将G250抗原视为的一个相对特异性的靶向分子,对ccRCC的诊断的进行了相关研究。Li 等[22]成功构建G250单克隆抗体的超顺磁珠探针,且MRI影像结果表明G250单克隆抗体标记的超顺磁珠可以特异性的识别ccRCC细胞;Zha等[16]将免疫PET成像技术和G250单克隆抗体结合起来,在裸鼠模型中能够特异性的识别ccRCC并成像,且可以对ccRCC进行病理分期。然而这些技术由于会对组织器官造成一定的损害等缺点限制了其进一步在临床的广泛使用。本课题组早期已经成功的制备出靶向纳米微泡,对前列腺癌进行了相关的研究[2, 3]。我们具有制备相关靶向纳米微泡的技术基础。
因此,本研究选择了携载G250单克隆抗体的纳米微泡对肾细胞癌的诊断进行相关的研究。利用生物素-亲和素技术将纳米微泡和G250单克隆抗体的连接,经FITC荧光二抗孵育后,靶向纳米微泡表面发出绿色的荧光,而空白纳米微泡表面无荧光发出。表明G250单克隆抗体和纳米微泡稳定结合形成了靶向靶向纳米微泡。且该靶向纳米微泡在制备后的5 d中,浓度和粒径没有发现明显的变化,说明靶向纳米微泡的稳定性具有一定的持续时间。在体外寻靶实验中,可见许多靶向纳米微泡粘附在G250抗原表达阳性的786-O细胞的表面和周围,而G250抗原表达阴性的ACHN细胞表面和周围未见靶向微泡;空白纳米微泡均未能粘附在两种肾细胞癌细胞表面和周围。该结果说明靶向纳米微泡和G250抗原可以特异性的识别以及发生抗原-抗体结合反应,在体外具有靶向识别能力。
根据体外实验结果,我们构建了786-O和ACHN细胞的裸鼠模型进行体内靶向纳米微泡超声增强显影实验。结果显示:在786-O裸鼠模型中,超声均值和超声最大值在靶向纳米微泡较空白纳米微泡均明显升高;在ACHN裸鼠模型中,超声均值和超声最大值在两组微泡中无明显差别。这项结果表明携载G250单克隆抗体的纳米微泡形成的靶向纳米微泡可以特异性的识别相对应的组织和细胞。这一现象合理的解释为靶向纳米微泡穿过肿瘤血管内皮间隙进入肿瘤实质,特异性地结合在细胞表面,发生抗原抗体结合反应。Fan等[23]已经通过病理切片HE染色证实纳米级微泡可以穿过胃癌肿瘤血管网进入肿瘤实质。因此,本研究为制备靶向纳米微泡对肿瘤的诊断和治疗奠定了一定的基础,利用超声分子影像学中的靶向微泡有望成为未来解决癌症诊断的有效手段之一。
| [1] | Nishikawa M, Miyake H, Kitajima K, et al. Preoperative differentiation between benign and malignant renal masses smaller than 4 cm treated with partial nephrectomy. Int J Clin Oncol, 2015, 20(1): 150-155. DOI:10.1007/s10147-014-0673-7 |
| [2] | Tong H P, Wang L F, Guo Y L, et al. Preparation of protamine cationic nanobubbles and experimental study of their physical properties and in vivo contrast enhancement. Ultrasound Med Biol, 2013, 39(11): 2147-2157. DOI:10.1016/j.ultrasmedbio.2013.05.016 |
| [3] | Wang L, Li L, Guo Y, et al. Construction and in vitro/in vivo targeting of PSMA-targeted nanoscale microbubbles in prostate cancer. Prostate, 2013, 73(11): 1147-1158. DOI:10.1002/pros.22663 |
| [4] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014. CA Cancer J Clin, 2014, 64(1): 9-29. DOI:10.3322/caac.21208 |
| [5] | Znaor A, Lortet-Tieulent J, Laversanne M, et al. International variations and trends in renal cell carcinoma incidence and mortality. Eur Urol, 2015, 67(3): 519-530. DOI:10.1016/j.eururo.2014.10.002 |
| [6] | Ridge C A, Pua B B, Madoff D C. Epidemiology and staging of renal cell carcinoma. Semin Intervent Radiol, 2014, 31(1): 3-8. DOI:10.1055/s-0033-1363837 |
| [7] | Hamilton A, Huang S L, Warnick D, et al. Left ventricular thrombus enhancement after intravenous injection of echogenic immunoliposomes: studies in a new experimental model. Circulation, 2002, 105(23): 2772-2778. |
| [8] | Liu Y, Davidson B P, Yue Q, et al. Molecular imaging of inflammation and platelet adhesion in advanced atherosclerosis effects of antioxidant therapy with NADPH oxidase inhibition. Circ Cardiovasc Imaging, 2013, 6(1): 74-82. DOI:10.1161/CIRCIMAGING.112.975193 |
| [9] | Frenkel V. Ultrasound mediated delivery of drugs and genes to solid tumors. Adv Drug Deliv Rev, 2008, 60(10): 1193-1208. |
| [10] | Danila M, Popescu A, Sirli R, et al. Contrast enhanced ultrasound (CEUS) in the evaluation of liver metastases. Med Ultrason, 2010, 12(3): 233-237. |
| [11] | Cavalieri F, Zhou M, Ashokkumar M. The design of multifunctional microbubbles for ultrasound image-guided cancer therapy. Curr Top Med Chem, 2010, 10(12): 1198-1210. |
| [12] | Xing Z, Wang J, Ke H, et al. The fabrication of novel nanobubble ultrasound contrast agent for potential tumor imaging. Nanotechnology, 2010, 21(14): 145607. DOI:10.1088/0957-4484/21/14/145607 |
| [13] | Burcu-Bahadir E, Kemal-Sezginturk M. Applications of electrochemical immunosensors for early clinical diagnostics. Talanta, 2015, 132: 162-174. DOI:10.1016/j.talanta.2014.08.063 |
| [14] | Soler M, Mesa-Antunez P, Estevez M C, et al. Highly sensitive dendrimer-based nanoplasmonic biosensor for drug allergy diagnosis. Biosens Bioelectron, 2015, 66: 115-123. DOI:10.1016/j.bios.2014.10.081 |
| [15] | Chang K, Deng S, Chen M. Novel biosensing methodologies for improving the detection of single nucleotide polymorphism. Biosens Bioelectron, 2015, 66: 297-307. DOI:10.1016/j.bios.2014.11.041 |
| [16] | Zha Z, Wang S, Zhang S, et al. Targeted delivery of CuS nanoparticles through ultrasound image-guided microbubble destruction for efficient photothermal therapy. Nanoscale, 2013, 5(8): 3216-3219. DOI:10.1039/c3nr00541k |
| [17] | Wu H, Rognin N G, Krupka T M, et al. Acoustic characterization and pharmacokinetic analyses of new nanobubble ultrasound contrast agents. Ultrasound Med Biol, 2013, 39(11): 2137-2146. DOI:10.1016/j.ultrasmedbio.2013.05.007 |
| [18] | Deng L, Li L, Yang H, et al. Development and optimization of doxorubicin loaded poly(lactic-co-glycolic acid) nanobubbles for drug delivery into HeLa cells. J Nanosci Nanotechnol, 2014, 14(4): 2947-2954. |
| [19] | Oosterwijk-Wakka J C, Boerman O C, Mulders P F, et al. Application of monoclonal antibody G250 recognizing carbonic anhydrase IX in renal cell carcinoma. Int J Mol Sci, 2013, 14(6): 11402-11423. |
| [20] | Grabmaier K, A-de-Weijert M C, Verhaegh G W, et al. Strict regulation of CAIX(G250/MN) by HIF-1alpha in clear cell renal cell carcinoma. Oncogene, 2004, 23(33): 5624-5631. |
| [21] | Oosterwijk E, Ruiter D J, Hoedemaeker P J, et al. Monoclonal antibody G250 recognizes a determinant present in renal-cell carcinoma and absent from normal kidney. Int J Cancer, 1986, 38(4): 489-494. |
| [22] | Li J W, Gong J Y, Li K, et al. Construction of a fusion expression plasmid containing the G250 gene and human granulocyte-macrophage colony stimulating factor and its significance in renal cell carcinoma. Oncol Lett, 2011, 2(2): 343-347. DOI:10.3892/ol.2010.230 |
| [23] | Fan X, Wang L, Guo Y, et al. Experimental investigation of the penetration of ultrasound nanobubbles in a gastric cancer xenograft. Nanotechnology, 2013, 24(32): 325102. DOI:10.1088/0957-4484/24/32/325102 |



