400038 重庆,第三军医大学西南医院:病理学研究所
2.Institute of Pathology, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
既往研究已证明胃癌中存在胃癌CSCs(gastric cancer stem cells,GCSCs),并证明其为胃癌恶性生物学行为的主要驱动者[1, 2, 3]。为探讨GCSCs“干性”维持的分子机制,我们作了GCSCs基因表达谱芯片分析,发现GCSCs中多种基因的表达发生了显著变化。 由于GCSCs呈现上皮-间质转化(epithelial-mesenchymal transition,EMT)表型,我们关注与细胞形态维持以及细胞运动功能密切相关的肌动蛋白结合蛋白的表达变化,发现其中的肌切蛋白(scinderin,SCIN)呈显著上调表达,故本研究以人胃癌细胞系和原代胃癌细胞为实验材料,探索沉默SCIN对GCSCs自我更新能力的影响。
1 材料与方法 1.1 实验材料人胃腺癌细胞系MGC803细胞购自中国科学院上海细胞库,原代胃癌细胞XN0422来自第三军医大学 西南医院病理学研究所。RPMI1640培养基购于Gibco 公司,胎牛血清(FBS)购于四季青公司。重组人表皮生长因子(EGF)购自Perprotech公司,神经细胞培养添加剂B27(50X)购自Gibco公司。Trizol、cDNA逆转录试剂盒及qRT-PCR试剂盒购自TaKaRa公司。SCIN干扰慢病毒由上海立菲生物科技有限公司提供。SCIN及β-actin引物由上海立菲生物科技有限公司合成。小鼠抗人SCIN单克隆抗体购自Santa Cruze公司,小鼠抗人β-actin单克隆抗体和HRP标记的山羊抗鼠IgG购自碧云天生物技术有限公司。
1.2 实验方法 1.2.1 细胞培养及成球培养人胃癌细胞系MGC803和原代胃癌细胞XN0422于含10 %胎牛血清的RPMI1640完全培养液中,放置37 ℃、5 %CO2、95%湿度的培养箱内静置培养,待细胞汇合度达90 %左右时,以1 ∶3传代。取对数生长期的贴壁细胞接种于10 cm超低黏附培养皿内,2×104个细胞/皿,添加无血清含EGF 5 ng/mL及B27(1×)的DMEM/F12培养基(干性培养基)10 mL,置培养箱中静置培养,每3天添加3 mL新鲜培养基。
1.2.2 SCIN慢病毒敲低细胞系的建立本实验中所用的SCIN基因的慢病毒干扰载体的构建、鉴定测序、质粒抽提以及慢病毒的包装均由上海立菲公司完成。稳定干扰SCIN的shRNA(shSCIN 1、shSCIN 2和shSCIN 3)和对照组(mock)的序列如下:shSCIN 1 5′-GGAGAAAGGAGCAGAGTATGTAGCA-3′;shSCIN 2 5′-CAGCCAAGAGGCTCCTACATGTGAA-3′;shSCIN 3 5′-GGAGGTTGATGTTGATGCAAATTCA-3′;mock 5′-TTA-CGCGTAGCGTAATACG-3′。按慢病毒感染细胞的常规操作,将干扰SCIN的慢病毒加入汇合度约为50%的 MGC803及XN0422细胞培养皿内,孵育8 h后,更换完全培养基,加入3 μg/mL浓度的嘌呤霉素筛选阳性感染细胞,qRT-PCR及Western blot检测SCIN干扰效率,干扰效率达90 %者用于后续实验。
1.2.3 RNA提取与qRT-PCR收集1×105个细胞,采用Trizol试剂,按说明书提取总RNA,分光光度计测定其浓度及纯度。按照TaKaRa逆转录反应说明书合成cDNA。再按定量PCR试剂盒说明书配制反应体系。扩增SCIN cDNA的上游引物为5′-ATGGCTTCGGGAAAGTTTATGT-3′,下游引物为5′-CATCCACCATATTGTGCTGGG-3′,以β-actin为内参照,其上游引物为5′-TTGCGTTACACCCTTTCTTG-3′,下游引物为 5′-CACCTTCACCGTT CCAGTTT-3′。 PCR 程序如下: 95 ℃ 30 s→(95 ℃ 5 s,60 ℃ 50 s)×40循环。用2 -ΔΔCt 法计算各基因相对表达量。
1.2.4 Western blotRIPA裂解细胞后提取细胞总蛋白,BCA法检测蛋白浓度,常规制样。配制10 % SDS-PAGE凝胶,以30 μg蛋白/孔上样,电泳分离后,半干转30 min转移蛋白至PVDF膜上,5 %脱脂奶粉封闭后,小鼠抗人SCIN一抗4 ℃孵育过夜,洗涤,HRP标记的山羊抗鼠二抗孵育2 h,PBS清洗后Thermo公司ECL显影液进行蛋白显影,并采图。
1.2.5 克隆形成实验细胞消化后,计数后接种至6孔板中,100个细胞/孔,每种细胞设置3个复孔,每孔加入含10 % FBS的RPMI1640完全培养基2 mL于培养箱中培养。每3~4天进行细胞换液,10 d后取出6孔板,去除培养基,PBS润洗细胞后,4 %多聚甲醛室温固定细胞20 min,然后用结晶紫溶液染色5 min,计数大于50个细胞的克隆数,进行统计分析。
1.2.6 成球实验细胞消化后,离心去上清,使用PBS洗涤细胞两次去除残留血清,用无血清干性培养基重悬细胞制成单细胞悬液,计数后接种于96孔板,10个细胞/孔,每种细胞种10孔,向每孔内加入100 μL 干性培养基后,置于培养箱静置培养,每隔3天向每孔补加50 μL干性培养基,1周后观察比较细胞球的大小,并计数直径>75 μm的细胞球数作统计分析。
1.2.7 皮下移植瘤模型胃癌细胞消化后离心收集细胞,以PBS重悬细胞制成单细胞悬液,计数细胞浓度并用PBS调整至1×106个细胞/mL,吸取20 μL细胞悬液与20 μL预冷的基质胶混合(细胞数为2×104个,总体积40 μL)后,用无菌注射器注射至4~6周龄雌性裸鼠腋下或腹股沟皮下,然后将裸鼠置于标准无菌环境下饲养,每3~5天观察移植瘤生长情况,4周后脱椎处死小鼠,取出移植瘤称重、根据体积公式V=a×b2/2(a为长径,b为短径)计算体积,并切片作HE染色观察肿瘤形态。
1.3 统计学处理应用SPSS 17.0统计分析软件,所有数据以x± s形式表示,两组数据采用两样本独立t检验。
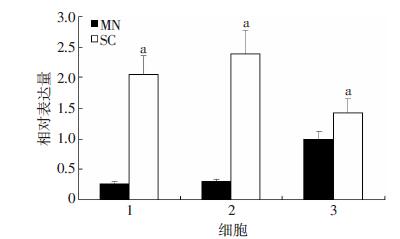
2 结果 2.1 肌切蛋白在胃癌细胞系MGC803及原代胃癌细胞XN0422胃癌干细胞中的表达显著高于普通细胞本实验首先采用Western blot检测了胃癌细胞系MGC803、SGC7901 以及原代胃癌细胞XN0422中SCIN 的表达情况,如图 1所示,3种胃癌细胞均有SCIN的 表达,但以MGC803和XN0422细胞表达较高。无血清成球培养法是本课题组分离富集胃癌干细胞的常用 方法[4],3种胃癌细胞均能培养出细胞球(图 2)。然后,我们利用qRT-PCR及Western blot的方法,从mRNA和蛋白水平比较肌切蛋白在胃癌干细胞(SC)与单层贴壁培养胃癌细胞(MN)中的表达差异。如图 3、4所示,胃癌干细胞中SCIN的表达显著高于普通贴壁细胞。
 |
| 1:MGC803;2:SGC7901;C:XN0422 图 1 Western blot检测SCIN在胃癌细胞系MGC803及原代胃癌细胞XN0422中的表达 |
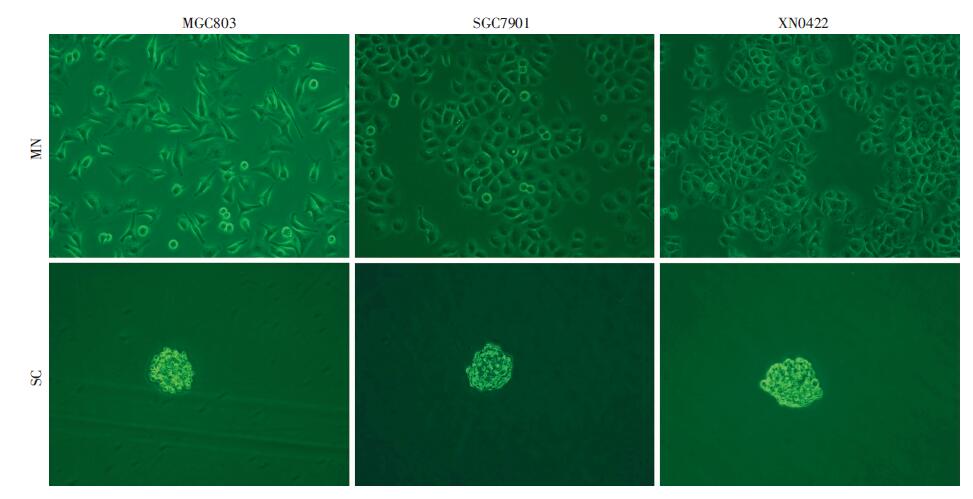 |
| 图 2 单层培养胃癌细胞及其成球培养形成的肿瘤球 (倒置相差显微镜 ×100) |
 |
|
1:MGC803;2:SGC7901;C:XN0422 a:P<0.05,与MN比较 图 3 qRT-PCR检测SCIN在胃癌单层培养细胞与成球细胞中的表达 (n=4,x± s) |
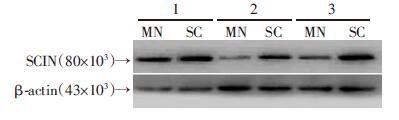 |
| 1:MGC803;2:SGC7901;C:XN0422 图 4 Western blot检测SCIN在胃癌单层培养细胞与成球细胞中的表达 |
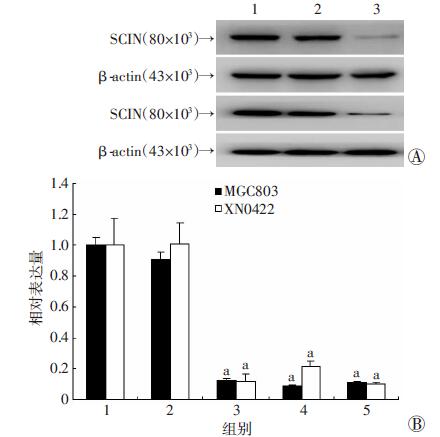
选择肌切蛋白表达相对较高的胃癌细胞系MGC803及原代胃癌细胞XN0422,感染SCIN干扰慢病毒后,经3 μg/mL嘌呤霉素筛选获得阳性细胞。qRT-PCR及Western blot检测结果表明,对照(mock)与野生型(WT)细胞中SCIN的表达量相似,而3种干扰序列在2种胃癌细胞中的干扰效率均较高(图 5)。我们选择干扰效率达90%以上且在2种细胞中干扰效率相似的shSCIN1慢病毒建立的SCIN稳定干扰细胞(命名为shSCIN细胞)及其对照细胞(命名为mock细胞)用于后续实验。
 |
|
1: WT; 2: mock; 3: shSCIN1; 4: shSCIN2; 5: shSCIN3 a: P<0.05,分别与WT、mock比较 A:Western blot检测结果;B:qRT-PCR检测结果(n=4,x± s) 图 5 qRT-PCR及Western blot筛选SCIN慢病毒稳定干扰的MGC803及XN0422细胞 |
实验结果表明,敲低SCIN显著降低胃癌细胞的克隆形成能力(图 6)。MGC803 shSCIN细胞形成的克隆数为26.33±4.37(n=3),显著低于mock细胞的克隆形成数62.33±3.18(P< 0.01)。在胃癌原代细胞XN0422中,SCIN敲低细胞克隆数为形成14.67±3.38,同样显著低于其mock细胞克隆形成数 49.67±2.19(P< 0.01)。
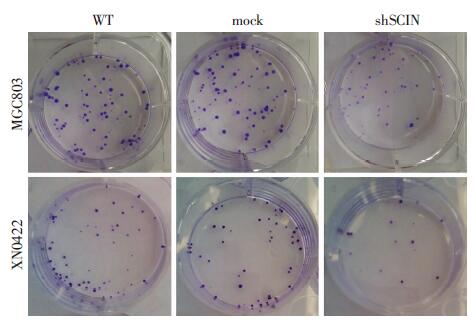 |
| 图 6 沉默SCIN对胃癌细胞平板克隆形成的影响 |
如图 7所示,沉默SCIN的MGC803和XN0422细胞所形成的细胞球均显著小于其对照细胞。计数结果显示,敲低SCIN的MGC803细胞的成球数为12.33±0.88(n=3),显著低于mock细胞的成球数39.00±2.69(P< 0.01)。在胃癌原代细胞XN0422中得到了相似的结果,敲低SCIN细胞和mock细胞成球数分别为15.67±1.76和33.33±1.65(P< 0.01)。实验结果表明,SCIN与胃癌细胞的成球能力显著相关。
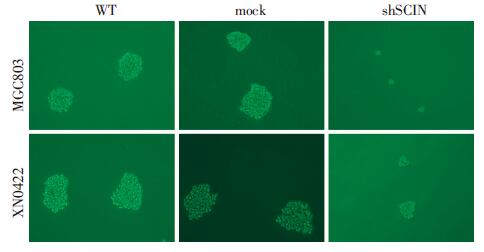 |
| 图 7 成球实验检测胃癌细胞SCIN敲低后成球数量及大小 (倒置相差显微镜 ×100) |
皮下移植瘤实验表明,SCIN敲低与否的MGC803和XN0422细胞,注射2×104个细胞/鼠,生长4周均能形成皮下移植瘤,并经HE染色得到证实(图 8)。但敲低SCIN后,移植瘤体积显著减小,质量显著减轻。MGC803细胞SCIN敲低组与对照组所形成皮下移植瘤体积分别为(85.01±32.77)mm3和(264.52±36.66)mm3 (P<0.05),质量分别为(0.233±0.054)g和(0.445±0.056)g(P<0.05)。胃癌原代细胞XN0422的实验结果与此相一致,移植瘤体积分别为(95.03±41.71)mm3和(283.95±81.50)mm3(P<0.05),质量分别为(0.156±0.055)g和(0.443±0.041)g(P< 0.05)。
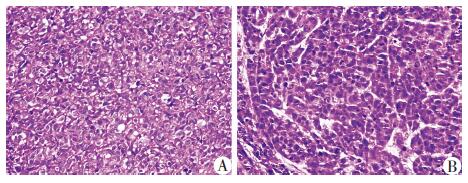 |
| A:MGC803,B:XN0422 图 8 SCIN敲低对胃癌细胞皮下移植瘤形成的影响 (HE ×200) |
本课题组从事胃癌干细胞方面的研究,利用无血清条件培养法成功地分离/富集了胃癌干细胞,并证实其具有EMT表型[2]。因此,我们推测与EMT相关的分子机制可能在GCSCs的干性维持中发挥重要作用。通过基因表达谱芯片分析,我们发现GCSCs中与细胞形态和运动功能密切相关的SCIN表达显著上调。SCIN是凝溶胶蛋白(gelsolin) 超家族的重要成员之一,能通过切断肌动蛋白丝,脱离肌丝终端促进肌动蛋白聚集成核等方式控制肌动蛋白的构建,使肌动蛋白在单体和聚合体两种形式间转换[4, 5],从而在维持细胞形态以及细胞运动中发挥重要作用。近年来,SCIN与肿瘤的关系受到重视。 Abouzahr等[6]在对非小细胞肺癌CTL抵抗突变株的研究中发现,SCIN的过表达使肿瘤细胞对CTL杀伤作用敏感性降低,而沉默SCIN基因后能使突变株对CTL杀伤作用的敏感性明显增强。SCIN在膀胱癌顺铂耐药细胞株中高表达,其能与线粒体电压依从性的阴离子通道相互作用而抑制细胞凋亡,可作为膀胱癌顺铂耐药的新的标志物[7]。还有研究发现,SCIN在结直肠癌组织中的上调表达与肝转移相关联[8],而在卵巢上皮性癌中,SCIN表达水平与淋巴结转移呈正相关[9],SCIN还具有促进胃癌细胞侵袭转移的作用[10]。
本研究旨在探索SCIN对胃癌干细胞干性维持的作用。平板克隆形成实验及成球实验是体外观察CSCs自我更新能力的重要实验,实验结果显示沉默SCIN后,无论是胃癌细胞系细胞还是原代胃癌细胞,其克隆形成数和成球数量均显著减少,且成球体积变小。成瘤实验是衡量CSCs自我更新能力的体内实验,裸鼠皮下移植瘤实验结果显示,敲低SCIN表达后,其所形成的移植瘤体积显著减小、重量显著减轻。体内外实验结果均充分证明SCIN胃癌细胞的自我更新能力的维持中发挥重要作用。
志谢 感谢第三军医大学西南医院病理学研究所提供实验研究场所;感谢普外科余佩武教授的指导以及病理学研究所颜泽萱、付文娟、刘庆、卞士霞等老师在实验中给予的支持和帮助
| [1] | Stojnev S, Krstic M, Ristic-Petrovic A, et al. Gastric cancer stem cells: therapeutic targets[J].Gastric Cancer, 2014, 17(1): 13-25. |
| [2] | Yang L, Ping Y F, Yu X, et al. Gastric cancer stem-like cells possess higher capability of invasion and metastasis in association with a mesenchymal transition phenotype[J]. Cancer Lett, 2011, 310(1): 46-52. |
| [3] | 汤钊猷. 癌转移研究的几个重要问题[J]. 中华消化外科杂志, 2014, 13(3): 161-164. |
| [4] | 赖章超, 宋鑫. 肌切蛋白的结构与功能多样性[J]. 中国生物化学与分子生物学报, 2012, 28(7): 617-623. |
| [5] | Silacci P, Mazzolai L, Gauci C, et al. Gelsolin superfamily proteins: key regulators of cellular functions[J]. Cell Mol Life Sci, 2004, 61(19/20): 2614-2623. |
| [6] | Abouzahr S, Bismuth G, Gaudin C, et al. Identification of target actin content and polymerization status as a mechanism of tumor resistance after cytolytic T lymphocyte pressure[J]. Proc Natl Acad Sci U S A, 2006,103(5): 1428-1433. |
| [7] | Miura N, Takemori N, Kikugawa T, et al. Adseverin: a novel cisplatin-resistant marker in the human bladder cancer cell line HT1376 identified by quantitative proteomic analysis[J]. Mol Oncol, 2012, 6(3): 311-322. |
| [8] | 吴海福. Scinderin基因在结直肠癌肝转移中的相关功能研究[D]. 上海: 复旦大学, 2010. |
| [9] | 吴姗, 马晶晶, 姜旖, 等. 卵巢上皮性癌中肌切蛋白的表达及其临床意义. 实用妇产科杂志, 2013, 29(7): 522-525. |
| [10] | Chen X M, Guo J M, Chen P, et al. Suppression of scinderin modulates epithelial-mesenchymal transition markers in highly metastatic gastric cancer cell line SGC-7901[J]. Mol Med Rep, 2014, 10(5): 2327-2333. |



