丙型肝炎病毒(hepatitis C virus,HCV)和人类免疫缺陷病毒(human immunodeficiency virus,HIV)的传播途径十分相似,约30%的HIV阳性患者合并HCV感染。在中国的静脉药瘾的HIV感染者中,HCV阳性率可高达90%[1]。HCV患者合并感染HIV将加速丙型肝炎病程进展,同时降低抗HCV疗效。近年较多研究表明,对合并感染患者针对HIV进行严格的高效抗逆转录病毒治疗(highly active antiretroviral therapy,HAART)不能有效地改善这些情况,同时HCV病程加速也与CD4+T淋巴细胞数量下降无明显关联。我们前期的研究也证实,HIV合并感染可能导致患者体内HCV准种分布特征改变,但HCV载量及准种复杂度与CD4+T淋巴细胞数量无关[2, 3]。以上证据提示HIV对HCV的影响可能存在其他途径。有研究证实HCV、HIV可以共感染同一肝细胞,进而可能导致两种病毒在同一细胞内发生相互作用[4]。HCV、HIV均为RNA病毒,而DDX3在人体细胞内与RNA的复制过程关系密切,已有研究证实DDX3可与HCV Core蛋白结合促进HCV的复制[5, 6]。同时发现HIV-1 Rev蛋白可与DDX3结合在核膜上形成复合体从而导致细胞质内DDX3的水平下降[7],也有研究表明,Rev蛋白可以与HCV 5′-UTR作用直接促进HCV的复制。但是尚未有研究证实Rev蛋白可以通过间接作用影响HCV的复制,或通过影响其他细胞代谢途径影响HCV的复制,也没有研究证实Rev蛋白和DDX3可以共同作用并对HCV的复制产生影响。
本实验通过分别构建HCV RNA复制细胞模型及表达DDX3、Rev+DDX3的HCV RNA复制细胞模型,研究Rev蛋白和DDX3对HCV RNA复制的影响。旨在为进一步深入研究Rev蛋白和DDX3是否通过共同作用,从而影响HCV RNA复制。
1 材料与方法 1.1 材料Huh7肝癌细胞系和HCV复制模型pCDNA3.1-JFH1均为本实验室保存,Huh7细胞系生长于含10%灭活小牛血清、2 mmol/L谷氨酰胺、氨苄青霉素(100 U/mL)、链霉素(100 U/mL)和DMEM培养基中,37 ℃、5% CO2条件下培养。实验中主要材料包括:真核过表达质粒pCDNA3.1(鼎国生物技术有限公司,北京),各种工具酶、核酸标准分子量Marker以及蛋白质预染Marker(天根生化有限公司,北京),去内毒素质粒大量提取试剂盒(Qiagen公司,德国),质粒转染转染试剂Lipofectamine2000(Invitrogen公司,美国),鼠抗Flag单克隆抗体(Sigma公司,美国)、兔抗人GAPDH单克隆抗体、小鼠抗人DDX3单克隆抗体、小鼠抗HIV Rev单克隆抗体(Abcam公司,美国),HRP 标记的羊抗兔 IgG 二抗,HRP 标记的羊抗小鼠 IgG二抗(福州迈新公司中国),qPCR引物由Invitrogen公司合成。
1.2 方法 1.2.1 含Rev、DDX3基因重组真核表达载体的构建查询NCBI获得Rev蛋白和DDX3的基因表达序 列,并分别在其基因的5′端引入限制性酶切位点Eco RⅠ 和增强表达的Kozak序列,3′端引入限制酶切位点 XbaⅠ和便于Rev、DDX3表达检测的Flag标签蛋白(DYKDDDDK)编码序列,以及便于观察转染效率的mCherry和YFP序列。以上相关基因序列由深圳华大生物科技有限公司协助合成。进一步分别将各自基因序列插入真核过表达载体pCDNA3.1中命名为pCDNA3.1-Rev-Flag-mCherry、pcDNA3.1-DDX3-YFP-Flag。从GenBank中查询目的基因以及上下游的序列,用VectorNTI软件进行PCR引物设计。载体pCDNA3.1-Rev-Flag-mCherry正向引物(5′-AGTCCAGTGTGGTGGAATTCGCCACCATGGAGCCAGTAGATCCTAG-3′)(含同源重组序列、EcoRⅠ酶切位点、Kozak序列,并含有目的基因5′端配对序列),(5′-TAGTCCATGGTGGCGAATTCTTCTTTAGTTCCTGACTCCAATAC-3′)(含同源重组序列、EcoRⅠ酶切位点,并含有目的基因3′端配对序列)。载体pcDNA3.1-DDX3-YFP-Flag正向引物5′-ACGATGACGATAAGCTCGAGGCCACCATGAG-TCATGTGGCAGTGG-3′(含同源重组序列、XhoⅠ酶切位点、Kozak序列,
并含有目的基因5′端配对序列),反向引物5′-GTTTAAACGGGCCCTCTAGATCAGTTACCCCACCAGTCAAC-3′(含同源重组序列、XbaⅠ酶切位点,并含有目的基因3′端配对序列)。
用构建好的重组pCDNA3.1-Rev-Flag-mCherry、pcDNA3.1-DDX3-YFP-Flag质粒分别转化入大肠杆菌DH5α中,均匀涂布接种于含有氨苄青霉素的琼脂糖平板上,次日挑取阳性单克隆菌落摇菌扩增后,抽提质粒进行PCR扩增并进行琼脂糖凝胶电泳(图 1),对扩增产物进行回收,并进行核酸测序。
 |
| 1: 重组pCDNA3.1-Rev-Flag-mCherry质粒; 2: 重组pCDNA3.1-DDX3-YFP-Flag质粒; M: 标准 图 1 重组PCR产物的鉴定 |
采用Lipofectamine2000转染试剂,实验步骤按照使用说明书进行操作。将重组pCDNA3.1-Rev-Flag-mCherry、pCDNA3.1-DDX3-YFP-Flag质粒分别瞬时转染入Huh7细胞中,通过荧光显微镜观察转染效率(图 2)。pCDNA3.1-JFH1瞬时转染入Huh7细胞中,qPCR检测HCV的复制情况。
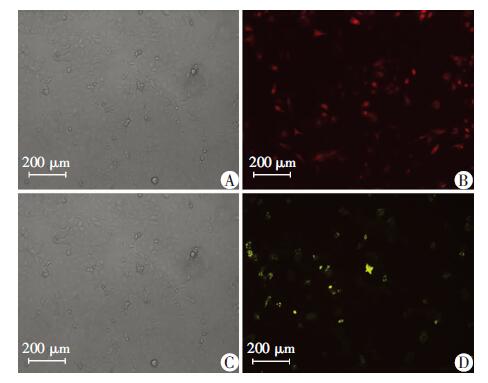 |
| A:重组pCDNA3.1-Rev-Flag-mCherry质粒转染细胞后,普通显微镜下观察转染后的细胞;B:在A的同视野下在荧光显微镜下观察细胞Rev的表达;C:重组pCDNA3.1-DDX3-YFP-Flag转染细胞后,普通显微镜下转染后的细胞;D:在C的同视野下在荧光显微镜下观察细胞DDX3的表达 图 2 荧光显微镜下观察重组pCDNA3.1-Rev-Flag-mCherry、pCDNA3.1-DDX3-YFP-Flag质粒转染Huh7细胞后的转染结果及表达 |
分别转染48 h后,提取细胞总蛋白,进行SDS-PAGE电泳。在4 ℃下、300 mA恒流条件下电转120 min,用封闭液(含5%脱脂牛奶的TBST)室温封闭PVDF膜1 h,TBST洗膜3次,每次10 min,一抗加入1 ∶5 000比例稀释的anti-Rev单克隆抗体4 ℃孵育过夜,TBST洗膜3次,每次10 min,二抗加入1 ∶5 000 比例稀释的辣根过氧化物酶标记的羊抗兔IgG抗体室温孵育2 h,TBST洗膜3次,每次10 min。化学发光试剂检测,以GAPDH为内参。
1.2.5 qPCR检测细胞内Rev、DDX3对HCV复制的影响用Lipofectamine2000转染试剂,实验按照使用说明书进行操作。将pCDNA3.1-DDX3-YFP-Flag和pCDNA3.1-JFH1瞬时共转染入Huh7细胞中,qPCR检测HCV复制情况。将pCDNA3.1-Rev-Flag-mCherry、pCDNA3.1-DDX3-YFP-Flag及pCDNA3.1-JFH1 瞬时共转染入Huh7细胞中,qPCR检测HCV复制情况。查询NCBI中HCV基因组序列,以5′非翻译区为模板设计引物,引物序列为HCV-F: 5′-CCCTGTGAGGAACTACTGTCTT-3′; HCV-R: 5′-TGAGCGGGTTTATCCAAG-3′。 引物序列由美国Invitrogen公司合成。扩增条件为95 ℃ 预变性1 min,95 ℃变性10 s,58 ℃退火扩增30 s,循环40次,最后添加65~95 ℃溶解曲线。标准曲线:取1 μg PCDNA3.1-JFH1按10倍梯度稀释5个梯度后按上述体系进行Real-time PCR检测,最终将每个梯度的Ct值带入对应终浓度计算函数,最终以该函数计算每个样品中对应的HCV复制水平。
1.3 统计学处理采用SPSS 17.0进行统计,实验组与对照组采用两独立样本t检验检测均值是否有显著性差异。
2 结果 2.1 重组pCDNA3.1-Rev-Flag-mCherry、pCDNA3.1-DDX3-YFP-Flag真核表达载体的鉴定含pCDNA3.1-Rev-Flag-mCherryg质粒的菌液经扩增培养后提取纯化质粒,进行PCR鉴定,产物经5%琼脂糖凝胶电泳,分别出现1条特异性条带,均位于400 bp附近。核酸序列测定结果显示,克隆的外源基因全长394 bp(图 1)。含pCDNA3.1-DDX3-YFP-Flag质粒的菌液经扩增培养后提取纯化质粒,进行PCR鉴定,产物经5%琼脂糖凝胶电泳,分别出现2条特异性条带,分别位于2 000 bp附近,选择与预期产物大小接近的条带进行胶回收并测序。核酸序列测定结果显示,克隆的外源基因全长2 035 bp(图 1)。通过对克隆的外源基因序列测序并和GenBank中Rev和DDX3序列对比,证实其基因序列100%同源,提示Rev和DDX3真核表达载体构建成功。
2.2 Rev、DDX3基因分别在Huh7细胞中的表达重组pCDNA3.1-Rev-Flag-mCherry、pCDNA3.1-DDX3-YFP-Flag质粒分别转染Huh7细胞,转染24 h后用荧光显微镜观察荧光(图 2),可见Rev在荧光显微镜下发红光(图 2),DDX3在荧光显微镜下发黄光(图 2);转染48 h后提取细胞总蛋白,通过Western blot检测Rev蛋白和DDX3的表达,凝胶成像仪成像结果(图 3)证明重组pCDNA3.1-Rev-Flag-mCherry、pCDNA3.1-DDX3-YFP-Flag质粒能在Huh7细胞中表达相应的蛋白。
 |
| 1:在只转染pCDNA3.1-JFH1的细胞模型中,没有Rev蛋白和DDX3的表达;2:重组pCDNA3.1-Rev-Flag-mCherry、pCDNA3.1-DDX3-YFP-Flag和pCDNA3.1-JFH1质粒共转染Huh7细胞,可以在细胞中检测到Rev蛋白和DDX3的 表达;3:为重组pCDNA3.1-DDX3-YFP-3Flag和pCDNA3.1- JFH1质粒共转染Huh7细胞,可以在细胞中检测到DDX3的表达 图 3 Western blot检测Rev蛋白和DDX3在Huh7细胞中的表达 |
重组pCDNA3.1-DDX3-YFP-Flag和pCDNA3.1-JFH1质粒共转染Huh-7细胞,48 h后用TRIzol法提取细胞总RNA,qPCR检测HCV的复制水平,进行对照组与实验组的两独立样本t检验。结果表明,瞬时转染DDX3和HCV复制质粒后,HCV的复制水平(1.09×107±0.18×107)明显高于HCV复制质粒单独转染后的HCV复制水平(4.79×106±1.24×106)(P=0.03)。提示,DDX3可以增强HCV在细胞中的复制(表 1)。
| (n=3,x± s) | ||||
| 组别 | 细胞模型 | HCV RNA (IU/mL) | P | t值 |
| 第1组 | Huh7-JFH1 | 4.79×106±1.24×106 | 0.03 | -5.335 |
| Huh7-JFH1-DDX3 | 1.09×107±0.18×107 | |||
| 第2组 | Huh7-JFH1 | 4.17×107±0.46×107 | <0.001 | 8.778 |
| Huh7-JFH1-Rev-DDX3 | 1.74×107±0.40×107 | |||
重组pCDNA3.1-Rev-Flag-mCherry、pCDNA3.1-DDX3-YFP-Flag和pCDNA3.1-JFH1质粒共转染入Huh-7细胞中,转染48 h后,提取细胞总RNA,进行qPCR检测HCV的复制水平,进行对照组与实验组的两独立样本t检验。结果表明,Rev、DDX3和HCV复 制质粒共转染Huh-7细胞后,HCV的复制水平(1.74× 107±0.40×107)明显低于HCV单独转染后的HCV复制水平(4.17×107±0.46×107)(P<0.001)。Rev蛋白和DDX3共同作用可以抑制HCV的复制(表 1)。
3 讨论有研究证实循环血液中的HIV gp120蛋白在与肝细胞表面CCR5和CXCR4接触后可激活肝细胞内TGFβ-1表达从而促进肝细胞内HCV的复制[8]。有研究发现可以从CD4-CXCR4+的原代肝细胞中成功分离出HIV;并且Fromentin[9]证实CD4-CXCR4-的某些肝癌细胞株也可以感染HIV。证明HIV和HCV可共感染同一肝细胞,表明二者有产生直接作用的可能。在HIV、HCV共感染的患者中,HIV可以促进HCV的复制,而且加速肝纤维化的进程[10]。HIV合并HCV感染患者与HIV单独感染患者比较,肝脏相关疾病是非AIDS引起死亡的主要原因[11]。最新的研究表明,HIV和HCV合并感染加速疾病的进程,特别是HIV感染增加HCV的复制、肝细胞凋亡、肠道微生物的移位[12]、损伤HCV的特异性免疫应答。对HIV合并HCV的患者分别进行HIV的抗病毒治疗和HCV的抗病毒治疗,结果表明抗病毒治疗有效的延缓了肝纤维化的进程并减少了HIV合并HCV感染的患者终末期 肝病的并发症[13, 14]。然而HIV合并HCV感染的患者接受常规的PEG-IFN联合利巴韦林治疗所产生的持续性病毒学应答要比单独HCV患者有明显的降低[15]。
有研究表明,在HIV-1致病过程中,Rev蛋白发挥着重要作用,其可以促进HIV-1病毒颗粒的产生,并可以抑制病毒所有调节蛋白的产生[16]。因HIV和HCV在细胞复制中无法自身合成RNA解旋酶,其在细胞中的复制需要细胞内的RNA解旋酶参与。DDX3属于DEAD解旋酶家族,DDX3参与多种细胞进程,包括mRNA的剪接和转录[17]、翻译的起始[18]和RNA的转运[19]。有研究显示,DDX3可以与HIV-1中的Tat蛋白作用,刺激病毒mRNA的翻译[20],也可以和Rev蛋白作用参与REV-RRE介导的输出作用[21]。有研究表明DDX3与HCV Core蛋白结合促进HCV的复制。同时也有学者发现HIV-1 Rev蛋白可与DDX3结合在核膜上形成复合体从而影响细胞质内DDX3的水平。也有研究发现Rev蛋白可以与HCV 5’-UTR作用直接促进HCV的复制。但是尚未有研究证实Rev可以通过间接作用影响HCV的复制,也没有研究证实Rev蛋白和DDX3共同作用对HCV的影响。
本研究证实pCDNA3.1-Rev-Flag-mCherry、pCDNA3.1-DDX3-YFP-Flag可以在真核细胞中表达;转染后48 h qPCR检测发现,DDX3单独与HCV作用时,可以促进HCV RNA的复制;当Rev和DDX3共同作用于HCV时,可以有效抑制HCV RNA的复制。可能原因:①Rev和DDX3在细胞中结合形成复合物,降低了细胞内DDX3的水平,降低了DDX3对HCV RNA的复制作用,从而竞争性抑制了DDX3对HCV复制的影响;②也有可能通过抑制某些信号通路从而影响HCV RNA的复制,因为Rev和DDX3不仅在HCV的表达中起作用,而且参与细胞中的多种信号通路,Rev和DDX3形成复合物后也抑制了相应的信号通路,导致HCV RNA的表达量下降;③或者改变了Rev和DDX3在细胞中的分布,导致它们无法在指定的作用位点与HCV进行相互作用,从而导致HCV RNA表达量的下降。
| [1] | Garten R J,Lai S,Zhang J,et al. Rapid transmission of hepatitis C virus among young injecting heroin users in Southern China[J]. Int J Epidemiol,2004,33(1): 182-188. |
| [2] | Mao Q,Ray S C,Laeyendecker O,et al. Human immunodeficiency virus seroconversion and evolution of the hepatitis C virus quasispecies[J]. J Virol,2001,75(7):3259-3267. |
| [3] | Netski D M,Mao Q,Ray S C,et al. Genetic divergence of hepatitis C virus:the role of HIV-related immunosuppression[J]. J Acquir Immune Defic Syndr,2008,49(2): 136-141. |
| [4] | Fromentin R,Tardif M R,Tremblay M J. Inefficient fusion due to a lack of attachment receptor/co-receptor restricts productive human immunodeficiency virus type 1 infection in human hepatoma Huh7.5 cells[J]. J Gen Virol,2011,92(Pt 3): 587-597. |
| [5] | Upadya M H,Aweya J J,Tan Y J. Understanding the interaction of hepatitis C virus with host DEAD-box RNA helicases[J]. World J Gastroenterol,2014,20(11): 2913-2926. |
| [6] | Ariumi Y. Multiple functions of DDX3 RNA helicase in gene regulation,tumorigenesis,and viral infection[J]. Front Genet,2014,5: 423. |
| [7] | Yedavalli V S,Neuveut C,Chi Y H,et al. Requirement of DDX3 DEAD box RNA helicase for HIV-1 Rev-RRE export function[J]. Cell,2004, 119(3): 381-392. |
| [8] | Lin W,Weinberg E M,Tai A W,et al. HIV increases HCV replication in a TGF-beta1-dependent manner[J]. Gastroenterology,2008,134(3): 803-811. |
| [9] | Xiao P,Usami O,Suzuki Y,et al. Characterization of a CD4-independent clinical HIV-1 that can efficiently infect human hepatocytes through chemokine (C-X-C motif) receptor 4[J]. AIDS,2008,22(14): 1749-1757. |
| [10] | Pineda J A,Romero-Gomez M,Diaz-Garcia F,et al. HIV coinfection shortens the survival of patients with hepatitis C virus-related decompensated cirrhosis[J]. Hepatology,2005,41(4): 779-789. |
| [11] | Koziel M J,Peters M G. Viral hepatitis in HIV infection . N Engl J Med,2007,356(14): 1445-1454. |
| [12] | Kim A Y,Schulze-zur-Wiesch J,Kuntzen T,et al. Impaired hepatitis C virus-specific T cell responses and recurrent hepatitis C virus in HIV coinfection[J]. PLoS Med,2006,3(12): e492. |
| [13] | Data Collection on Adverse Events of Anti-HIV drugs (D: A: D) Study Group,Smith C,Sabin C A,et al. Factors associated with specific causes of death amongst HIV-positive individuals in The D: A: DStudy[J]. AIDS,2010,24(10): 1537-1548. |
| [14] | Qurishi N,Kreuzberg C,Luchters G,et al. Effect of antiretroviral therapy on liver-related mortality in patients with HIV and hepatitis C virus coinfection[J]. Lancet,2003,362(9397): 1708-1713. |
| [15] | Barcaui H S,Tavares G C,May S B,et al. Low rates of sustained virologic response with peginterferon plus ribavirin for chronic hepatitis C virus infection in HIV infected patients in Rio de Janeiro,Brazil[J]. PLoS One,2013,8(7): e67734. |
| [16] | Pollard V W,Malim M H. The HIV-1 Rev protein[J]. Annu Rev Microiol,1998,52: 491-532. |
| [17] | Chao C H,Chen C M,Cheng P L,et al. DDX3,a DEAD box RNA helicase with tumor growth-suppressive property and transcriptional regulation activity of the p21waf1/cip1 promoter,is a candidate tumor suppressor[J]. Cancer Res,2006,66(13): 6579-6588. |
| [18] | Shih J W,Tsai T Y,Chao C H,et al. Candidate tumor suppressor DDX3 RNA helicase specifically represses cap-dependent translation by acting as an eIF4E inhibitory protein[J]. Oncogene,2008,27(5): 700-714. |
| [19] | Kanai Y,Dohmae N,Hirokawa N. Kinesin transports RNA:isolation and characterization of an RNA-transporting granule[J]. Neuron,2004,43(4): 513-525. |
| [20] | Lai M C,Wang S W,Cheng L,et al. Human DDX3 interacts with the HIV-1 Tat protein to facilitate viral mRNA translation[J]. PLoS One,2013,8(7): e68665. |
| [21] | Yedavalli V S,Neuveut C,Chi Y H,et al. Requirement of DDX3 DEAD box RNA helicase for HIV-1 Rev-RRE export function[J].Cell,2004,119(3): 381-392. |



