2. 400016 重庆,重庆医科大学附属第一医院神经外科
2. Department of Neurosurgery, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是神经外科的一种常见病、多发病,临床上常称的SAH一般指自发性SAH,颅内动脉瘤破裂是其主要原因[1]。SAH后72 h内继发的早期脑损伤(early brain injury,EBI)已经成为其主要的致死或致残因素,在很大程度上决定了病情转归及预后[2, 3]。在后续EBI病理机制研究中发现,血脑屏障破坏和脑水肿发挥着重要作用[4]。载脂蛋白E(APOE代表编码载脂蛋白E的基因,apoE代表载脂蛋白E全蛋白)是脑组织中最重要的载脂蛋白,负责胆固醇、磷脂的转运,在神经组织细胞再生,细胞膜、轴突及突触修复或重建等方面起着重要作用[5]。我们的近期研究发现,apoE短肽COG1410能有效降低创伤性脑损伤后血脑屏障(blood brain barrier,BBB)通透性,减轻创伤后脑水肿,并通过抑制水通道蛋白4(aquaproins-4,AQP-4)的过表达减轻脑水肿[6, 7, 8]。但COG1410对SAH后脑水肿的作用少有文献报道。因此我们推测,COG1410是否也可通过抑制AQP-4的过度表达从而减轻SAH后EBI中脑水肿。本研究通过构建小鼠SAH模型,探讨apoE短肽COG1410对SAH后脑组织AQP-4表达和早期脑水肿的影响,明确其神经保护机制,为将来临床转化提供实验依据。
1 材料与方法 1.1 试剂COG1410由美国杜克大学Vitek教授惠赠,纯度>95%。AQP-4抗体购自武汉博士德生物工程有限公司。AQP-4 ELISA检测试剂盒购自武汉优尔生商贸有限公司。建模使用体视学显微镜购自江西凤凰光学仪器公司。
1.2 实验动物与分组健康雄性C57BL/6J小鼠[重庆医科大学实验动物中心提供,实验动物生产许可证号:SCXK(渝)2012-0001;实验动物使用许可证号:SYXK(渝)2012-0001]108只,8~10周龄,SPF级,体质量22~25 g。将108只C57BL/6J小鼠分成假手术对照组(sham)36只、生理盐水组(SAH+生理盐水)36只和治疗组(SAH+COG1410)36只。各个组分为SAH 1、2 d和3 d 3个时相点。COG1410以无菌生理盐水予以溶解后,经尾静脉注射,剂量为1 mg/kg,术后30 min内开始第1次注射,以后每24小时注射1次。
1.3 动物模型的制备参考Bederson等[9]和Veelken等[10]研究,本实验采用改进颅内血管内穿刺法构建模型。用4%水合氯醛麻醉后,将小鼠固定于手术台上,常规消毒铺巾,于颈部正中切口。然后在体视学显微镜下,在小鼠右侧颈部钝性分离出颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA)。将小鼠颈外动脉远心端和近心端各用丝线结扎,在2个结扎之间将颈外动脉剪断。然后用动脉夹将CCA和ICA夹住,在ECA近心端用显微剪剪1个小孔,将1根5-0 Prolene穿刺线从ECA经ICA导入至ACA和MCA交叉处,刺破动脉壁,总进入长度为(10.0±0.5)mm。假手术对照组仅将穿刺线送至ACA和MCA分叉处,稍感阻力即停止继续插入,并迅速退出穿刺线,结扎颈外动脉断端,缝合消毒皮肤,单笼饲养。经预实验证实模型成功的判断标准为:对全部动物进行脑组织剥离,肉眼可见蛛网膜下腔有血液或陈旧性血凝块包绕在脑底血管周围,同时脑实质未受损伤。
1.4 神经损伤严重性评分(NSS)严格按照Chen等[11]使用的方法于SAH后1、2、3 d 对小鼠的运动障碍进行评分,评分标准包括:①运动测试(6分);②感觉测试(2分);③平衡测试(6分);④反射和异常活动(4分)。低分代表神经状态接近正常,高分代表存在着严重的神经功能障碍,满分18分。
1.5 脑含水量测定在各时间点断头取脑组织,用滤纸将脑底表面的 血迹擦干,快速用电子分析天平称重(精确到0.000 1 g),即湿质量;然后置于100 ℃恒温箱里,24 h后取出,用电子分析天平称重,即干质量。用公式:(湿质量-干质量)/湿质量×100%计算脑含水量[12]。
1.6 脑组织AQP-4蛋白免疫组化测定在SAH后各时间点将小鼠以磷酸缓冲液(PBS,pH=7.4)快速冲洗,然后4%多聚甲醛(4 ℃,pH值7.4)灌注100 mL。灌注完毕后断头取脑,将脑组织放入4%多聚甲醛,固定24 h,然后将出血周围脑组织进行包埋、切片,挑片,进行AQP-4免疫组织化学染色。石蜡切片经4% H2O2处理10 min后,用10%正常羊血清封闭30 min,4 ℃孵育一抗(兔抗鼠AQP-4多克隆抗体,博士德,1 ∶600)过夜,SABC试剂盒按说明书进行操作。苏木精复染,常规脱水,透明,干燥,封片。DAB显色后400倍光镜下观察,随机选取6个高倍镜视野记录阳性细胞数,取其平均值。
1.7 ELISA定量检测脑组织AQP-4蛋白SAH后各时间点取小鼠右侧半脑出血周围皮质,在冰上快速将蛋白质匀浆裂解,离心(5 000×g,离心5 min),提取上清液。按照AQP-4 ELISA试剂盒说明书步骤进行操作,然后立即在酶标仪450 nm波长下测量各孔的光密度值[D(450)],进行定量分析。
1.8 脑组织AQP-4 mRNA表达测定取上述已取右侧半脑出血周围皮质置于1 mL玻璃匀浆器中,加入1 mL TRIzol,冰上研磨成组织悬液,悬液转入1.5 mL离心管中,室温下静置5 min。高速冷冻离心机12 000 r/min离心5 min,上清液倒入另一离心管中。按照RNA扩增试剂盒说明书进行反转录和PCR扩增。反转录反应条件为:42 ℃,30 min;90 ℃,5 min;5 ℃,5 min。采用β-actin为内参照,AQP-4引物序列:5′-ACGCAGAACCAGGGCATAGA-3′,β-actin引物序列:5′-ACCCCGTGCTGACCGAG-3′。PCR扩增条件:94 ℃,2 min;94 ℃,30 s;52 ℃,30 s;72 ℃,2.5 min,共30个循环。72 ℃ 5 min末段延伸,最后采用AQP4基因相对β-actin基因的转录量,反应结束后读取数据并做数据分析。
1.9 统计学分析应用SPSS 17.0软件进行统计学分析,上述每组实验均重复4次。计量资料用x±s表示,多个组别间比较采用单因素方差分析,组间两两比较采用TUKEY法,时间点之间两组资料的比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果 2.1 动物模型的评价及神经损伤严重性评分假手术对照组术前术后小鼠饮水、摄食无明显差别。生理盐水组术后小鼠的饮水、摄食明显下降,取出脑组织可见枕大池及基底池大量血凝块聚集。治疗组术后饮水、摄食均优于生理盐水组,同样可见枕大池及基底池大量血凝块聚集。SAH后生理盐水组和治疗组神经功能评分均明显高于假手术对照组(P<0.05)。且生理盐水组和治疗组之间差异有统计学意义(P<0.05,图 1、2)。
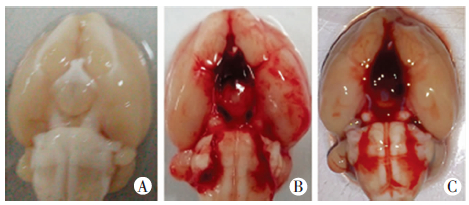 |
| A:假手术组;B:生理盐水组;C:治疗组 图 1 蛛网膜下腔出血模型的构建 |
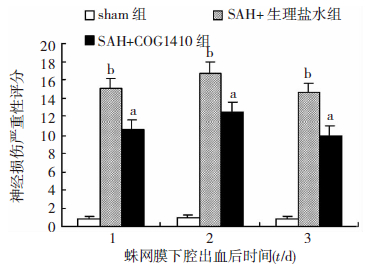 |
| a:P<0.05,与SAH+生理盐水组比较;b:P<0.05,与sham组比较 图 2 各时间点神经损伤严重性评分 |
SAH后各时间点生理盐水组脑含水量的变化与假手术对照组对比,显著升高(P<0.05)。生理盐水组和治疗组脑含水量均在SAH后1 d明显增加,2 d达到高峰,之后逐渐下降,两组间差异均有统计学意义(P<0.05,图 3)。
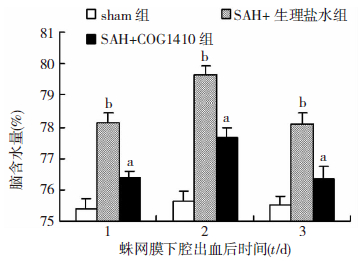 |
| a:P<0.05,与SAH+生理盐水组比较;b:P<0.05,与sham组比较 图 3 各时间点脑组织含水量的变化 |
免疫组化检测结果显示,AQP-4为膜蛋白,细胞 质和细胞核未见染色。SAH后各时间点生理盐水组AQP-4 阳性细胞数与假手术对照组对比显著升高(P<0.05)。生理盐水组和治疗组可见皮质区AQP-4阳性细胞均在SAH后1 d明显增加,2 d达到高峰,之后逐渐下降,两组间差异均有统计学意义(P<0.05,图 4)。
 |
| A:蛛网膜下腔出血后不同时间点的免疫组化结果(×400)↑:示AQP-4阳性细胞;B:蛛网膜下腔出血后不同时间点免疫组化AQP-4阳性细胞计数结果 a:P<0.05,与SAH+生理盐水组比较;b:P<0.05,与sham组比较 图 4 各时间点脑组织 AQP-4阳性细胞的表达差异 |
ELISA检测结果显示,SAH后各时间点生理盐水组蛋白含量与假手术对照组对比显著升高,差异有统计学意义(P<0.05)。生理盐水组和治疗组AQP-4蛋白含量均在SAH后1 d明显增加,2 d达到高峰,之后逐渐下降,两组间差异均有统计学意义(P<0.05,图 5)。
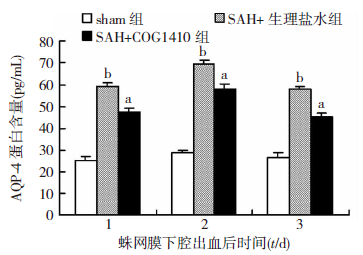 |
| a:P<0.05,与SAH+生理盐水组比较;b:P<0.05,与sham组比较 图 5 各时间点脑组织AQP-4蛋白含量的变化 |
SAH后各时间点生理盐水组AQP-4 mRNA表达与假手术对照组对比显著升高,差异有统计学意义(P<0.05)。生理盐水组和治疗组AQP-4 mRNA表达均在SAH后1 d明显增加,2 d达到高峰,之后逐渐下降,两组间差异均有统计学意义(P<0.05,图 6)。
 |
| a:P<0.05,与SAH+生理盐水组比较;b:P<0.05,与sham组比较 图 6 各时间点脑组织AQP-4 mRNA表达的变化 |
SAH是神经外科常见的危急重症之一,SAH后脑水肿可加重EBI,进而影响患者的预后[13]。本研究选用C57BL/6J野生型小鼠采用线穿法构建SAH模型来探讨外源性载脂蛋白E短肽COG1410对SAH后急性 期小鼠运动功能、脑水肿、AQP-4 mRNA及AQP-4表达量的影响。结果表明,在SAH后1 d,脑组织含水量、AQP-4 mRNA及AQP-4表达量即开始显著增加,2 d 达到高峰,之后逐渐下降,且小鼠的运动功能出现明显障碍;给予COG1410能有效减少脑组织含水量、AQP-4 mRNA及AQP-4的表达,促进小鼠运动功能的恢复。
水通道蛋白家族(aquaporins,AQPs)在脑水肿形成及消退过程中起到非常重要的作用,由此水通道蛋白也成为抑制脑水肿的治疗靶点[14, 15]。AQP-4是细胞膜上一种比较保守的水通道蛋白,它介导水的双向跨膜转运,在脑组织中含量最丰富,主要存在于微血管周围星形胶质细胞血管终足靠近血管腔的胞膜上,与脑水肿关系密切[16]。研究表明,TBI后伤灶周围脑组织中AQP-4蛋白含量显著增加,促进脑水肿的发生、发展[17]。那么在SAH后EBI中是否存在这样的病理生理过程,因此我们选择SAH后前3 d作为此次研究的时相点,探讨COG1410对AQP-4表达和SAH后EBI中脑水肿的影响。
近年来研究表明,AQP-4的表达与血脑屏障的功能密切相关,起着保护血脑屏障功能的作用,且与血脑屏障的通透性呈正相关[18],与脑水肿程度呈正相关[19]。但是当AQP-4蛋白过度表达则会破坏血脑屏障的功能,导致脑水肿加重[20]。敲除AQP-4基因可减轻脑损伤后的细胞毒性脑水肿[21]。Ito等[22]发现,激活鼠星形胶质细胞的NF-κB,可诱导AQP-4的表达,继而引起脑水肿。而抑制P38的激活可降低星形胶质细胞AQP-4的表达及细胞水肿[23]。Ding等[24]研究也证实,通过抑制IL-1β、TNF-α的表达可抑制p38MAPK和NF-κB两条信号通路,进而抑制AQP-4的过表达,减轻脑水肿程度。我们前期研究已发现[25],NF-κB的表达与APOE多态性密切相关,APOEε4转基因小鼠NF-κB表达量明显高于APOEε2和APOEε3转基因小鼠,其脑水肿程度明显较APOEε2和APOEε3转基因小鼠严重。同时,p38MAPK的表达也与APOE多态性密切相关,APOEε4转基因小鼠p38MAPK表达量明显高于APOEε2和APOEε3转基因小鼠[26]。由于COG1410是来源于APOE受体结合区的短肽,因此理论上它可通过抑制p38MAPK和/或NF-κB信号通路的激活降低AQP-4的过表达从而减轻脑水肿。
文献[27]证实,COG1410能明显改善小鼠颅脑损伤后神经功能,其相关机制是抑制颅脑损伤后神经元凋亡、小胶质细胞活化、氧化应激,减轻创伤后轴突损伤等主要的病理生理变化。值得关注的是,Gao等[28]在SAH研究中发现,APOEε4转基因鼠较APOEε3转基因鼠更易于SAH后早期(<72 h)出现高死亡率、神经功能缺失及脑血管痉挛等,而COG1410可缓解脑血管痉挛,并降低病死率及改善神经功能缺失。本研究则从SAH后早期脑损伤中的脑水肿角度证实了COG1410可通过抑制AQP-4明显减轻SAH后脑水肿及改善运动功能缺失。这一系列研究结果对于将来其临床转化有着重要价值。
本研究也存在不足,首先,仅限于野生型小鼠,而SAH后APOE亚型对AQP-4的影响有待进一步研究;其次,主要针对SAH后EBI中脑水肿与AQP-4的关系及COG1410在SAH后EBI中脑水肿中的作用进行研究,但EBI的病理生理发展过程还包括颅内压升高、脑血流量减少、血脑屏障破坏、脑内炎症反应、神经元细胞死亡等,如需全面评估COG1410的神经保护作用及机制尚有待于进一步的研究。
| [1] | Mak C H, Lu Y Y, Wong G K. Review and recommendations on management of refractory raised intracranial pressure in aneurysmal subarachnoid hemorrhage[J]. Vasc Health Risk Manag, 2013, 9: 353-359. DOI:10.2147/VHRM.S34046 |
| [2] | Cahill J, Calvert J W, Zhang J H. Mechanisms of early brain injury after subarachnoid hemorrhage[J]. J Cereb Blood Flow Metab, 2006, 26(11): 1341-1353. DOI:10.1038/sj.jcbfm.9600283 |
| [3] | Chen S, Feng H, Sherchan P, et al. Controversies and evolving new mechanisms in subarachnoid hemorrhage[J]. Prog Neurobiol, 2014, 115: 64-91. DOI:10.1016/j.pneurobio.2013.09.002 |
| [4] | Cahill J, Zhang J H. Subarachnoid hemorrhage is it time for a new direction[J]. Stroke, 2009, 40(3 Suppl): S86-S87. DOI:10.1161/STROKEAHA.108.533315 |
| [5] | Aono M, Bennett E R, Kim K S, et al. Protective effect of apolipoprotein E-mimetic peptides on N-methyl-D-aspartate excitotoxicity in primary rat neuronal-glial cell cultures[J]. Neuroscience, 2003, 116(2): 437-445. |
| [6] | 唐爽, 江涌, 周帅, 等. 载脂蛋白E基因多态性对脑损伤后血脑屏障修复的影响[J]. 中华创伤杂志, 2014, 30(10): 1040-1045.DOI:10.3760/cma.j.issn.1001-8050.2014.10.017 |
| [7] | 刘杰什, 秦兴虎, 曹芳, 等. APOE基因亚型对创伤性脑损伤后COG1410早期神经保护作用的影响[J].第三军医大学学报, 2015, 37(10): 990-995. DOI:10.16016/j.1000-5404.201502003 |
| [8] | 钟建军, 周昌龙, 黄志坚, 等. 短肽cog1410对小鼠创伤性脑损伤灶周围脑水肿的影响[J]. 中华创伤杂志, 2015, 31(3): 259-263.DOI:10.3760/cma.j.issn.1001-8050.2015.03.019 |
| [9] | Bederson J B, Germano I M, Guarino L. Cortical blood flow and cerebral perfusion pressue in a new noncraniotomy model of subarachnoid hemorrhage in the rat[J]. Stroke,1995, 26(6): 1086-1091. |
| [10] | Veelken J A, Laing R J, Jakubowski J. The Sheffield model of subarachnoid hemorrhage in rats[J]. Stroke, 1995, 26(7): 1279-1283. |
| [11] | Chen J, Sanberg P R, Li Y, et al. Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J]. Stroke, 2001, 32(11): 2682-2688. |
| [12] | Xi G, Hua Y, Keep R F, et al. Systemic complement depletion diminishes perihematomal brain edema in rats[J]. Stroke, 2001, 32(1): 162-167. |
| [13] | Claassen J, Carhuapoma J R, Kreiter K T, et al. Global cerebral edema after subarachnoid hemorrhage: frequency, predictors, and impact on outcome[J]. Stroke, 2002, 33(5): 1225-1232. |
| [14] | Papadopoulos M C, Verkman A S. Potential utility of aquaporin modulators for therapy of brain disorders[J]. Prog Brain Res, 2008, 170: 589-601. DOI:10.1016/S0079-6123(08)00446-9 |
| [15] | Taya K, Gulsen S, Okuno K, et al. Modulation of AQP4 expression by the selective V1a receptor antagonist, SR49059, decreases trauma-induced brain edema[J]. Acta Neurochir Suppl, 2008, 102: 425-429. |
| [16] | Fukuda A M, Badaut J. Aquaporin 4: a player in cerebral edema and neuroinflammation[J]. J Neuroinflammation, 2012, 9:279. DOI:10.1186/1742-2094-9-279 |
| [17] | Katada R, Nishitani Y, Honmou O, et al. Expression of aquaporin-4 augments cytotoxic brain edema after traumatic brain injury during acute ethanol exposure[J]. Am J Pathol, 2012, 180(1): 17-23. DOI:10.1016/j.ajpath.2011.09.011 |
| [18] | 崔向宁, 尹岭, 王玉来. 水通道蛋白4在大鼠创伤性脑水肿中的作用机制[J]. 中国康复理论与实践, 2005, 11(9): 719-721. |
| [19] | Ke C, Poon W S, Ng H K, et al. Heterogeneous responses of aquaporin-4 in oedema formation in a replicated severe traumatic brain injury model in rat[J]. Neurosci Lett, 2001, 301(1): 21-24. |
| [20] | Vizuete M L, Venero J L, Vargas C, et al. Differential upregulation of aquaporin-4 mRNA expression in reactive astrocytes after brain injury: potential role in brain edema[J]. Neumbiol Dis, 1999, 6(4): 245-258. DOI:10.1006/nbdi.1999.0246 |
| [21] | Badaut J, Copin J C, Fukuda A M, et al. Increase of arginase activity in old apolioprotein-E deficient mice under Western diet associated with changes in neurovascular unit[J]. J Neuroinflammation, 2012, 9: 132. DOI:10.1186/1742-2094-9-132 |
| [22] | Ito H, Yamamoto N, Arima H, et al. Interleukin-1beta induces the expression of aquaporin-4 through a nuclear factor-kappaB pathway in rat astrocytes[J]. J Neurochem, 2006, 99(1): 107-118. DOI:10.1111/j.1471-4159.2006.04036.x |
| [23] | Rao K V, Reddy P V, Curtis K M, et al. Aquaporin-4 expression in cultured astrocytes after fluid percussion injury[J]. J Neurotrauma, 2011, 28(3): 371-381. DOI:10.1089/neu.2010.1705 |
| [24] | Ding Z, Zhang J, Xu J, et al. Propofol administration modulates AQP-4 expression and brain edema after traumatic brain injury[J]. Cell Biochem Biophys, 2013, 67(2): 615-622. DOI:10.1007/s12013-013-9549-0 |
| [25] | 吴海涛, 江涌, 张晓冬, 等. 载脂蛋白E基因多态性影响星形胶质细胞损伤后早期NF-κB表达的实验研究[J].第三军医大学学报, 2010, 32(2): 103-106. |
| [26] | Maezawa I, Nivison M, Montine K S, et al. Neurotoxicity from innate immune response is greatest with targeted replacement of E4 allele of apolipoprotein E gene and is mediated by microglial p38MAPK[J]. FASEB J, 2006, 20(6): 797-799. DOI:10.1096/fj.05-5423fje |
| [27] | Kaufman N A, Beare J E, Tan A A, et al. COG1410, an apolipoprotein E-based peptide, improves cognitive performance and reduces cortical loss following moderate fluid percussion injury in the rat[J]. Behav Brain Res, 2010, 214(2): 395-401. DOI:10.1016/j.bbr.2010.06.017 |
| [28] | Gao J, Wang H, Sheng H, et al. A novel apoE-derived therapeutic reduces vasospasm and improves outcome in a murine model of subarachnoid hemorrhage[J]. Neurocrit Care, 2006, 4(1): 25-31. DOI:10.1385/NCC:4:1:025 |



