2. 400042 重庆,第三军医大学大坪医院野战外科研究所妇产科
2. Department of Obstetrics and Gynecology, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042, China
宫颈癌是危害女性健康的主要恶性肿瘤之一,在我国妇科恶性肿瘤中其发病率居第二位,仅次于乳腺癌。据WHO报道,每年我国发病人数14万,约占全球发病总人数的1/3[1]。随着社会生活的改变和人乳头瘤病毒感染率的上升,宫颈癌的发病率有明显的上升趋势,并且宫颈癌患者逐渐趋于年轻化[2]。目前对宫颈癌的重要治疗手段之一是切除病患部位组织,但是对于已发生转移的患者手术切除的效果不理想,并且严重影响患者的后续生活质量。因此,寻找一个强有力的抑癌分子靶标并诱导其高表达或是改进宫颈癌治疗效果的有效策略。
SARI(suppressor of AP-1 and regulated by IFN)又称BATF2(basic leucine zipper transcription factor,ATF-like 2),属于碱性亮氨酸拉链转录因子ATF样蛋白(basic leucine zipper transcription factor ATF-like,BATF)家族[3]。SARI含有碱性亮氨酸拉链结构,能和c-Jun结合起到抑制AP-1转录活性的功能[4]。已有研究表明SARI在多种正常组织中广泛表达,但在其对应的肿瘤组织中呈低表达并且其表达量与肿瘤的发生发展呈负相关[5, 6, 7, 8, 9]。研究报道IFN-α/β和地塞米松能有效诱导SARI的表达并显著抑制淋巴瘤细胞的增殖[10]。除抑制肿瘤细胞增殖外,SARI还可以抑制肿瘤的转移及侵袭[7],其表达水平与肿瘤的分期以及患者的预后也有明显相关性[8],亦可作为一个较好的肿瘤诊断因子和预后判断因子,有较好的潜在应用价值。然而SARI在宫颈癌中的生物学功能及相关分子机制尚未见报道。
本研究旨在探讨宫颈癌中SARI的功能及相关分子机制,为SARI可能成为宫颈癌基因靶向治疗的分子靶标提供理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞株与质粒人宫颈癌细胞系HeLa和CaSki购自ATCC,由第三军医大学基础医学部生物化学与分子生物学教研室保存并传代。质粒pSARI:野生型SARI构建于pCMV表达载体,FLAG为表达标签。由首都医科大学基础医学院生化与分子生物学系丁卫教授惠赠。以空载体pCMV为转染对照。
1.1.2 试剂胎牛血清、DMEM低糖培养基(Gibco 公司C11995500BT)、胰酶(HyClone公司SH3004201) ,CCK-8试剂盒(日本Dojindo公司CK04-05)、Trizol(北京康为世纪公司SW0580)、Prime ScriptTM RT Master Mix反转录试剂盒(大连TaKaRa公司RR036A)、Real-time PCR检测试剂盒(大连TaKaRa公司RR820A)、Opti-MEM(Inverogen公司 31985062)、Lipofectamine 2000(Inverogen公司 11668019)、双荧光素酶报告基因检测试剂盒(Promega公司E2920)。蛋白酶抑制剂(美国Roche公司4693159001)、RIPA裂解液(南京碧云天公司P0013B)、BCA检测试剂盒(南京碧云天公司P0010)、APS(南京碧云天公司ST005)、PBS缓冲液(中山金桥ZLI-9061)、SDS-PAGE蛋白上样缓冲液5X(南京碧云天公司P0015)。封闭蛋白干粉(武汉博士德)、小鼠抗人β-actin抗体(美国Santa Cruz公司sc-47778)、 兔抗人SARI抗体(美国Santa Cruz公司sc-130972)、兔抗人mcl-1抗体(美国Santa Cruz公司sc-819)、山羊抗鼠二抗(北京中杉公司)、山羊抗兔二抗(北京中杉公司)、PVDF膜(Bio-Red公司1620177)、ECL化学发光试剂盒(美国Bio-Red公司)。引物使用NCBI Blast在线设计,由生工公司合成。
1.2 方法 1.2.1 细胞的培养和脂质体转染细胞表达质粒HeLa细胞、CaSki细胞分别于含10%胎牛血清的DMEM低糖培养基中培养,每2~3天换液或传代。脂质体转染细胞表达质粒使用Invitrogen LipofectamineTM2000完成,简要过程为:将混有质粒DNA和混有转染试剂的培养基Opti-MEM在室温下混匀并静置20 min,然后将其加入培养的细胞中(适宜细胞密度为80%左右),继续在37℃、5%CO2恒温培养箱中培养。细胞转染处理24h后,进行CCK-8、PCR、Western blot检测,流式细胞仪分析细胞周期及凋亡。以转染pSARI质粒的处理组作为实验组(pSARI组);以转染等量pCMV载体质粒的处理组作为对照组(NC组)。
1.2.2 CCK-8实验取对数生长期的HeLa和CaSki细胞,0.25 g/L胰蛋白酶消化,调整细胞数为5×104/mL,接种于96孔板,100μL/孔,放置在37℃,5% CO2孵箱中培养,12h后吸弃上清;实验组转入pSARI质粒,阴性对照组中转入等量的pCMV质粒,并设置不含细胞的空白对照,每组3个复孔,转染24h后取出。每孔添加10μL CCK-8试剂(注意防止产生气泡),继续培养1h后,取出放入酶标仪检测波长为450 nm时的光密度值。
1.2.3 总RNA提取及逆转录用Trizol法提取转染24h后的细胞总RNA,具体操作按说明书进行。用 核酸检测仪测RNA浓度及纯度[1.8<D(260)/D(280)<2.0]后,按TaKaRa公司的逆转录试剂盒说明书进行逆转录反应得到cDNA,-20℃保存。
1.2.4 Real-time PCR取1.2.3所得cDNA,采用Real-time PCR试剂盒进行实时定量PCR,对SARI mRNA表达水平进行测定。反应体系:SYBR Premix Ex Taq(2×)10μL,SARI上下游引物(10μmol/L) 各1μL,β-actin上下游引物(10μmol/L) 各1μL,cDNA 1μL,补超纯水至20μL。每个样品设3个复孔,置Real-time PCR仪扩增,反应条件:95℃预变性1 min;95℃10s,60℃ 30s,扩增40个循环;95℃ 1 min,55℃ 1 min,55℃ 10s 81个循环(溶解曲线),相对定量用2-△△Ct法计算。引物序列如下:β-actin上游:5′-ATCGTGCGTGACATTAAGGAGAAG-3′,下游:5′-AGGAAGGAAGGCTGGAAGAGTG-3′;SARI上游:5′-CC-ATGTACGTTGCTATCCAGG-3′,5′-TCTCCTTAATGTCACGCACGA-3′。
1.2.5 Western blot实验使用含蛋白酶抑制剂的RIPA裂解液提取转染24h后细胞的总蛋白。用BCA法测定蛋白浓度后标化。加入蛋白上样缓冲液后沸水煮5 min。取等量蛋白,12%的SDS-PAGE凝胶电泳,转膜,37℃ 5%脱脂奶粉封闭1.5h,按分子大小剪膜,一抗β-actin工作浓度为1:1 000,SARI浓度为1:500,Mcl-1浓度为1:1 000,Bcl-2浓度为1:1 000,4℃封闭10~12h,TBST洗涤3次,10 min/次,相应的二抗工作浓度为1:10 000,37℃孵育1h,TBST洗涤3次,10 min/次,超敏ECL化学发光显影。
1.2.6 流式细胞仪分析细胞周期HeLa、CaSki细胞转染24h后,取出培养板,将上清吸入10 mL EP管中,PBS洗2遍,0.25 g/L的胰蛋白酶消化,吸入EP管中,1 000×g离心5 min,弃上清,用PBS洗2遍,预冷的75%乙醇重悬,4℃过夜;1 000×g离心5 min,弃去乙醇,PBS洗2遍,加入核糖核酸酶A(100 ng/L),37℃ 水浴锅消化30 min,加入PI(500 ng/mL)染液300μL,4℃避光孵育1h,400目细胞筛选过滤,流式细胞仪检测细胞周期,Mcycle软件分析各组G0、G1、S、G2、M各期细胞百分比。
1.2.7 流失细胞仪分析细胞凋亡HeLa、CaSki细胞转染24h后,取出培养板,将上清吸入10 mL EP管中,PBS洗2遍,0.25 g/L的胰蛋白酶消化,吸入EP管中,1 000×g离心5 min,弃上清,用PBS洗2遍,弃上清。加入100μL Binding Buffer和FITC标记的Annexin-V(20μg/mL)10μL,室温避光30 min,再加入PI(50μg/mL)5μL,避光反应5 min后,加入400μL Binding Buffer,立即用FAC Scan进行流式细胞术定量检测。
1.2.8 双荧光素酶报告基因检测分别将HeLa、CaSki细胞接种于24孔板中,12h后弃上清,将pAP-1-Luc报告基因质粒与其他重组质粒进行共转染。转染后细胞放置于37℃培养箱中培养24h后,进行双荧光素酶活性测定,具体操作按Promega双荧光素酶报告基因试剂盒说明书进行。启动子活性通常表示为萤火虫荧光素酶活性与海参荧光素酶活性的比值。
1.3 统计学分析数据以x±s表示,采用Graphpad Prism 5 统计软件,各组间均数比较用单因素方差分析。
2 结果 2.1 在宫颈癌细胞中成功构建SARI过表达模型我们利用pSARI转染CaSki和HeLa细胞24h后,分别检测了SARI的mRNA水平(Real-time PCR,图 1A)和蛋白水平(Western blot,图 1B)。结果显示:无论是mRNA水平,还是蛋白水平,实验组(pSARI组)均较对照组(NC组)升高(P<0.05)。
 |
| A:Real-time PCR检测CaSki和HeLa细胞中SARI的mRNA水平 a:P<0.05,与对照组比较;B:Western blot检测CaSki和HeLa细胞中SARI的蛋白水平图 1 在宫颈癌细胞中成功构建SARI过表达模型 |
我们在成功构建SARI过表达模型后,使用CCK-8试剂盒检测过表达SARI(转染pSARI 24h)对宫颈癌细胞增殖的影响。结果显示:无论是CaSki细胞还是HeLa细胞,过表达SARI均会显著抑制细胞的增殖(P<0.01,图 2)。
 |
| a:P<0.01,与对照组比较图 2 过表达SARI对宫颈癌细胞CsSki、HeLa增殖的影响 |
由于细胞周期和细胞凋亡的变化均会影响细胞增殖能力的改变。因此,我们在证实SARI过表达会显著抑制宫颈癌细胞的增殖能力后,进而使用流式细胞术来检测宫颈癌细胞过表达SARI对细胞凋亡及细胞周期的影响。结果显示:在CaSki和HeLa细胞中过表达SARI后细胞发生早期凋亡的比例增加(图 3A),但对细胞周期没有明显的影响(图 3B)。
 |
| A:流式细胞分析过表达SARI后宫颈癌细胞的凋亡;B:流式细胞分析过表达SARI后宫颈癌细胞的周期图 3 过表达SARI对宫颈癌细胞凋亡及细胞周期的影响 |
我们通过双荧光素酶报告基因实验检测了过表达SARI宫颈癌细胞模型中 AP-1的转录活性。结果显示:在CaSki和HeLa细胞中过表达SARI可以显著抑制AP-1的活性(P<0.01,图 4)。
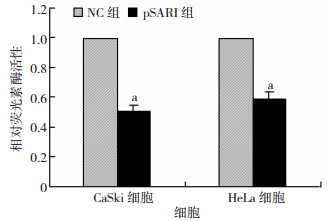 |
| a:P<0.01,与对照组比较图 4 双荧光素酶报告基因检测宫颈癌细胞中过表达SARI后AP-1转录活性的变化 |
除了利用流式细胞术检测过表达SARI的宫颈癌细胞模型的凋亡情况外,我们还通过Western blot检测上述细胞模型中凋亡相关分子Bcl-2及Mcl-1的蛋白水平。结果发现,在CaSki和HeLa细胞中过表达SARI后,Mcl-1的蛋白水平显著下调,但是Bcl-2没有明显的变化(图 5)。
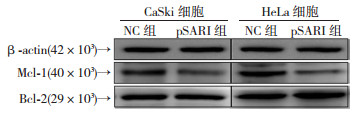 |
| 图 5 Western blot 检测过表达SARI后抗凋亡分子Mcl-1及Bcl-2的变化 |
为了研究SARI在宫颈癌细胞中的主要功能及其潜在的作用机制,我们成功构建了HeLa及CaSki细胞的SARI过表达模型(图 1)。我们初步证实,在宫颈癌细胞系中过表达SARI可以抑制肿瘤细胞的增殖(图 2)。
SARI抑制细胞增殖可通过诱导细胞凋亡[11],也可通过诱导细胞周期阻滞来实现。例如,SARI可以通过与c-Jun结合抑制AP-1的活性,进而下调AP-1下游靶基因cyclinD1、CCN1等基因,导致细胞周期阻滞从而抑制肿瘤细胞的增殖[12]。为了明确宫颈癌细胞中SARI过表达抑制肿瘤细胞增殖的具体作用途径,我们利用流式细胞检测技术检测细胞模型的凋亡及细胞周期(图 3),结果显示:在宫颈癌细胞系中过表达SARI后发生早期凋亡的细胞高于对照组,然而2组细胞的细胞周期均无明显的差异。路钊等[13]的研究结果也证实在A549细胞中过表达SARI会诱导细胞凋亡,但不影响细胞周期。这些结果均提示:在不影响细胞周期的前提下,过表达SARI通过诱导细胞发生早期凋亡来抑制肿瘤细胞增殖或是存在于多种肿瘤组织中的共性抗癌机制。
目前已报道的SARI抗肿瘤功能的机制有以下4种:(1)SARI蛋白通过抑制转录因子AP-1的转录活性(在90%的肿瘤中转录因子AP-1的活性增强),发挥抗肿瘤的作用[3]。(2)SARI可以通过调节GSK-3β(glycogensynthase kinase-3β)-β-catenin信号通路,下调细胞核中的β-catenin水平,抑制EMT的表达,最终抑制肿瘤的侵袭和转移[7]。(3)SARI蛋白与p53发生协同作用抑制NF-κB的转录活性,从而促进p53的促凋亡效应[13]。(4)CCN1基因可以促进肿瘤的发生、发展。SARI蛋白可以在转录水平抑制CCN1基因的表达,从而抑制癌细胞的迁移[14]。这4条通路中,SARI与c-Jun结合抑制AP-1的转录活性是SARI作为抑癌基因发挥功能的主要通路。然而在宫颈癌中这条通路是否存在,在本研究之前尚未见报道。
AP-1(activating protein 1)是由c-Jun和c-Fos蛋白形成的异源二聚体组成,作为一个转录因子,促进细胞的增殖及恶性转化[12, 15, 18]。本研究通过双荧光素酶报告基因实验证实在宫颈癌细胞中过表达SARI可以抑制AP-1的转录活性(图 4),该实验结果也与文献[13]报道相符。此外,有研究报道在肝细胞中促进AP-1表达可以抵抗细胞凋亡[17, 18],又有研究表明AP-1 可以通过下调下游靶分子最终影响Mcl-1的表达[19, 20, 21]。于是我们进一步推测在宫颈癌细胞中SARI抑制AP-1的活性最终诱导细胞的凋亡可能是通过调节Bcl-2家族成员的表达来实现的。
Bcl-2(B cell lymphoma/Leukelia-2)家族是一类重要的细胞凋亡调节基因[22]。按其功能可以分为抗凋亡分子和促凋亡分子两类。Mcl-1及Bcl-2是Bcl-2家族中的抗凋亡成员,二者在淋巴组织及多种组织中表达和分布不同,在细胞凋亡过程中也发挥着不同的功能[23]。Bcl-2参与c-myc诱导的凋亡,而Mcl-1和其他调控凋亡基因协同促进肿瘤细胞的增殖[24, 25, 26]。为了探讨在AP-1的表达下调之后是否可以影响Mcl-1及Bcl-2这两个抗凋亡因子的表达,我们提取了过表达SARI的HeLa及CaSki细胞的总蛋白,检测了Mcl-1及Bcl-2的表达。结果显示在过表达SARI下调AP-1的活性后,Mcl-1的表达明显下调而Bcl-2的表达却无明显改变(图 5)。这表明SARI过表达抑制AP-1活性并可能通过引起Mcl-1表达下调最终促进细胞凋亡。有文献报道在骨髓瘤中血管内皮生长因子VEGF可以促进Mcl-1 的表达[20]。而VEGF基因的启动子区有AP-1 的结合位点[19]。在乳腺癌MCF细胞中已证实AP-1可以与VEGF的启动子区结合促进VEGF转录,进而促进肿瘤的侵袭和转移[21]。因此,我们推测在宫颈癌细胞中亦可能存在相似的分子调控路径:即SARI下调AP-1活性,VEGF的转录受到抑制,Mcl-1的表达进而下调。但这有待进一步验证。
本研究证实了SARI的过表达引起宫颈癌细胞的凋亡,并下调AP-1活性及Mcl-1表达水平,相关实验结果明确。已有研究证实AP-1是重要的转录因子,与Mcl-1(Bcl-2抗凋亡家族成员)一起在宫颈癌细胞的抗凋亡过程中发挥了重要作用。因此,虽然调控细胞凋亡的通路众多,但由于SARI过表达下调宫颈癌中AP-1 活性及Mcl-1表达水平在诱发宫颈癌凋亡过程中或发挥了重要作用,其相关分子机制有待进一步细化。
本研究的一系列结果提示SARI可作为治疗宫颈癌的一个潜在分子靶标,我们对该分子相关作用机制的研究亦为全面绘制该分子的抗肿瘤机制图谱提供了理论依据,具体就宫颈癌而言,SARI的其他抗肿瘤机制(抗侵袭,抗转移等)仍需进一步探索。
志谢 感谢首都医科大学丁卫教授惠赠pSARI、pAP-1-Luc质粒;感谢倪振洪、李新哲、李波、吴亚冉等提供的实验技术指导
| [1] | 马丁, 奚玲. 宫颈癌流行病学及病因学研究进展[J].实用妇产科杂志, 2001, 17(2): 61-62. DOI:10.3969/j.issn.1003-6946.2001.02.001 |
| [2] | 章文华, 李楠, 吴令英. 重视宫颈癌患者年轻化的趋势[J]. 浙江肿瘤, 2000, 6(2): 112-114. |
| [3] | Su Z Z, Lee S G, Emdad L, et al. Cloning and characterization of SARI (suppressor of AP-1, regulated by IFN) [J]. Proc Natl Acad Sci U S A, 2008, 105(52): 20906-20911.DOI:10.1073/pnas.0807975106 |
| [4] | Dorsey M J, Tae H J, Sollenberger K G, et al. B-ATF: a novel human bZIP protein that associates with members of the AP-1 transcription factor family[J]. Oncogene, 1995, 11(11): 2255-2265. |
| [5] | Dash R, Su Z Z, Lee S G, et al. Inhibition of AP-1 by SARI negatively regulates transformation progression mediated by CCN1[J]. Oncogene, 2010, 29(31): 4412-4423. DOI:10.1038/onc.2010.194 |
| [6] | Ma H, Liang X, Chen Y, et al. Decreased expression of BATF2 is associated with a poor prognosis in hepatocellular carcinoma[J]. Int J Cancer, 2011, 128(4): 771-777. DOI:10.1002/ijc.25407 |
| [7] | Wang C, Su Y, Zhang L, et al. The function of SARI in modulating epithelial-mesenchymal transition and lung adenocarcinoma metastasis[J]. PLoS One, 2012, 7(9): e38046. DOI:10.1371/journal.pone.0038046 |
| [8] | Wen H, Chen Y, Hu Z, et al. Decreased expression of BATF2 is significantly associated with poor prognosis in oral tongue squamous cell carcinoma[J]. Oncol Rep, 2014, 31(1): 169-174. DOI:10.3892/or.2013.2863 |
| [9] | 文浩杰, 唐金勇, 刘柏生, 等. BATF2在舌鳞状细胞癌中的表达及临床意义[J]. 中华口腔医学杂志, 2015, 50(1): 13-17. DOI:10.3760/cma.j.issn.1002-0098.2015.01.004 |
| [10] | 黄英辉, 张立, 黄艳, 等. α/β干扰素通过上调SARI表达抑制淋巴瘤细胞的增殖[J].第三军医大学学报, 2012, 34(24): 2465-2468. |
| [11] | Liu Z, Wei P, Yang Y, et al. BATF2 Deficiency Promotes Progression in Human Colorectal Cancer via Activation of HGF/MET Signaling: A Potential Rationale for Combining MET Inhibitors with IFNs[J]. Clin Cancer Res, 2015, 21(7): 1752-1763. DOI:10.1158/1078-0432.CCR-14-1564 |
| [12] | Meggiato T, Calabrese F, De-Cesare C M, et al. C-JUN and CPP32 (CASPASE 3) in human pancreatic cancer: relation to cell proliferation and death[J]. Pancreas, 2003, 26(1): 65-70. |
| [13] | 路钊, 郑少鹏, 牛静, 等. BATF2/SARI通过抑制p53依赖的NF-κB转录活性诱导肿瘤细胞凋亡[J].中国生物化学与分子生物学报, 2011, 27(6): 524-532. |
| [14] | 刘泽兵, 杨瑜, 叶宣光, 等. SARI及CCN1基因在结直肠癌中的表达及其意义[J].中华医学杂志, 2011, 91(34): 2397-2401. DOI:10.3760/cma.j.issn.0376-2491.2011.34.006 |
| [15] | Echlin D R, Tae H J, Mitin N, et al. B-ATF functions as a negative regulator of AP-1 mediated transcription and blocks cellular transformation by Ras and Fos[J]. Oncogene, 2000, 19(14): 1752-1763. DOI:10.1038/sj.onc.1203491 |
| [16] | Yen J H, Kocieda V P, Jing H, et al. Prostaglandin E2 induces matrix metalloproteinase 9 expression in dendritic cells through two independent signaling pathways leading to activator protein 1 (AP-1) activation[J]. J Biol Chem, 2011, 286(45): 38913-38923. DOI:10.1074/jbc.M111.252932 |
| [17] | Ahmed-Choudhury J, Russell C L, Randhawa S, et al. Differential induction of nuclear factor-kappaB and activator protein-1 activity after CD40 ligation is associated with primary human hepatocyte apoptosis or intrahepatic endothelial cell proliferation[J]. Mol Biol Cell, 2003, 14(4): 1334-1345. DOI:10.1091/mbc.E02-07-0378 |
| [18] | Fan M, Goodwin M E, Birrer M J, et al. The c-Jun NH(2)-terminal protein kinase/AP-1 pathway is required for efficient apoptosis induced by vinblastine[J]. Cancer Res, 2001, 61(11): 4450-4458. |
| [19] | Josko J, Mazurek M. Transcription factors having impact on vascular endothelial growth factor (VEGF) gene expression in angiogenesis[J]. Med Sci Monit, 2004, 10(4): RA89-RA98. |
| [20] | Le-Gouill S, Podar K, Amiot M, et al. VEGF induces Mcl-1 up-regulation and protects multiple myeloma cells against apoptosis[J]. Blood, 2004, 104(9): 2886-2892. DOI:10.1182/blood-2004-05-1760 |
| [21] | 殷咏梅, 束永前, 陈晓锋, 等. TNF-α通过JNK和AP-1途径调节乳腺癌MCF-7细胞VEGF的表达[J]. 中国肿瘤生物治疗杂志, 2009, 16(1): 12-17. DOI:10.3872/j.issn.1007-385X.2009.01.004 |
| [22] | Gross A, McDonnell J M, Korsmeyer S J. BCL-2 family members and the mitochondria in apoptosis[J]. Genes Dev, 1999, 13(15): 1899-1911. |
| [23] | Schlaifer D, Krajewski S, Galoin S, et al. Immunodetection of apoptosis-regulating proteins in lymphomas from patients with and without human immunodeficiency virus infection[J]. Am J Pathol, 1996, 149(1): 177-185. |
| [24] | Craig R W. MCL1 provides a window on the role of the BCL2 family in cell proliferation, differentiation and tumorigenesis[J]. Leukemia, 2002, 16(4): 444-454. DOI:10.1038/sj.leu.2402416 |
| [25] | Michels J, O’Neill J W, Dallman C L, et al. Mcl-1 is required for Akata6 B-lymphoma cell survival and is converted to a cell death molecule by efficient caspase-mediated cleavage[J]. Oncogene, 2004, 23(28): 4818-4827. DOI:10.1038/sj.onc.1207648 |
| [26] | 张建中, 桂开林, 周金莲, 等. 凋亡调控基因Mcl-1和bcl-2在反应性及肿瘤性淋巴组织中的表达及其意义[J]. 肿瘤防治杂志, 2002, 9(1): 22-24,29. DOI:10.3969/j.issn.1673-5269.2002.01.007 |



