2.402120 重庆,重庆三峡医药高等专科学校;
3.400038 重庆,第三军医大学西南医院:康复科
2.Chongqing Three Gorges Medical College, Chongqing, 402120, China;
3.Department of Rehabilitation Medicine, Southwest Hospital, Third Military Medical University, Chongqing, 400038;
严重创伤、灾害后幸存者的应激障碍(posttraumatic stress disorder,PTSD)是一个长期困扰临床的问题,主要临床表现为对创伤事件的侵入性回忆、对类似场景主动回避、心理敏感性增高、情感麻木等症状[1]。该病的发病率为5%~14%,尤其女性发病率约为男性的2倍,是排列第4的最常见精神性疾病[2]。由于缺少在人体无创性的研究手段,一直以来对PTSD缺乏深入研究。动物实验研究结果表明,PTSD的形成有明确的脑病理学基础,涉及前额叶、海马、杏仁核等脑区结构和功能的异常[3, 4, 5]。研究发现海马椎体神经元有萎缩的现象,目前理论认为海马是调节应激反应并受应激影响最重要的脑部机构之一,也是糖皮质激素攻击的主要靶区[6]。还有研究认为海马的萎缩是由于兴奋性氨基酸的神经毒性以及细胞内钙离子超载造成的[7]。但目前的理论却不能很好解释PTSD患者其他脑区结构和功能存在的异常。
中枢神经系统功能的维持需要众多金属离子的参与,其中铁离子的作用最为突出。铁是电子的传递者,是线粒体呼吸代谢中不可缺少的辅酶。铁参与脑内许多重要的生理、生化过程,包括DNA、RNA和蛋白质的合成,髓磷脂的合成和神经髓鞘的发生、发展,以及多种神经递质的合成[8]。尽管铁作用非常重要,但由于铁离子在细胞内具有高度氧化毒性作用,细胞会通过铁蛋白等对细胞内的铁含量进行精细调节,保证铁含量稳定在一定范围内[9]。铁蛋白(ferritin,Fn)是细胞内铁的主要贮存蛋白,存贮1/3~3/4的脑铁[10],目前也被认为是细胞内重要的抗氧化作用因子[11]。但在PTSD疾病的发病过程中脑铁蛋白含量是否会发生改变尚不清楚。单次延长刺激(single prolonging stress,SPS)模型是目前研究PTSD疾病应用最广泛的模型之一,文献[12, 13, 14]表明,这种模型在动物行为、激素、脑区受体及递质等方面的改变,均能有效地模拟PTSD患者的疾病状态。本研究通过SPS建立大鼠模型以观察前额叶、纹状体、海马、小脑区域铁蛋白的分布情况,拟初步阐明在PTSD疾病过程中脑铁蛋白的作用特点,为进一步研究PTSD的发病机制提供实验依据。
1 材料与方法 1.1 实验动物及分组清洁级成年健康雄性SD大鼠40只,体质量(200± 20)g(第三军医大学实验动物中心提供)。采用颗粒型普通大鼠饲料喂养,饮用干净水源,室温(20±2)℃,适应性喂养1周后,分为2组,即模型组和对照组,每组20只。模型组接受SPS后常规饲养3 d,对照组无处理常规饲养。
清洁级成年健康雄性SD大鼠20只,体质量(200± 20)g(第三军医大学实验动物中心提供),适应性喂养1周后,分为4组,每组5只。对照组:常规饲养7 d提取海马组织蛋白;模型组:分别下设SPS后1、3、7 d 3个时相点提取海马组织蛋白,每个时相点5只大鼠。
1.2 SPS模型动物的建立采用2005年日本文部省召开的PTSD科学会议确定的大鼠模型[12],具体方法为:①采用塑质大鼠束缚器将SD大鼠束缚2 h;②强迫游泳2 h(水温25 ℃,水深80 cm);③休息15 min;④乙醚麻醉至深昏迷。置于通风干燥处待其苏醒后放回笼中。
1.3 行为学检测 1.3.1 旷场实验在SPS应激后第4天,将模型组和对照组动物置于旷场(内径100 cm,挡板高:40 cm)中央,摄像记录15 min内大鼠活动轨迹,计算机分析各个区间运动路程、各个区间运动时间等活动参数。 1.3.2 高架十字实验
将模型组和对照组动物置于高架十字迷宫中央(臂长50 cm,臂宽10 cm,臂高40 cm,离地1.5 m),面向其中1个开放臂,摄像记录5 min 内大鼠活动轨迹,计算机分析开、闭臂活动路程,活动时间等参数。
1.4 组织处理与切片制备行为学检测完毕后将模型组和对照组动物注射10%水合氯醛麻醉后断头,于冰上取双侧前额叶皮质、双侧纹状体、双侧海马、小脑组织,将模型组SPS后1、3、7 d各个时相点的大鼠麻醉后,取出大鼠双侧海马组织,保存于液氮中,行Western blot及实时荧光定量PCR(qRT-PCR)检测分析。模型组和对照组的大鼠经4%多聚甲醛灌注后取脑,脑组织经多聚甲醛浸泡48 h,置于30%蔗糖中脱水5 d,冰冻后切成30 μm的切片,每隔6片取1片,保存于4%多聚甲醛中行免疫组织化学法(IHC)分析。
1.5 Western blot检测使用总蛋白提取试剂盒提取总蛋白(P0027,碧云天生物)。大鼠脑组织标本加入含有磷酸酶抑制剂及蛋白酶抑制剂的RIPA裂解液,在冰上匀浆,混悬液经4 ℃离心机12 000 r /min 离心 30 min,提取上清液,用BCA试剂盒测蛋白样本浓度(P0010,碧云天生物)。上样:每泳道50 μg蛋白样本;SDS-PAGE 电泳(5% 浓缩胶,10%分离胶,70 V,80 min) 直至蛋白分离,切胶,将含有目的蛋白的胶转移至PVDF膜,100 mA 电转120 min。5%牛奶封闭2 h,兔抗铁蛋白多克隆抗体(ab75973,Abcam)4 ℃孵育48 h。TBST 轻摇清洗3次,每次10 min,加生物素标记山羊抗兔IgG(ZB2010,中杉金桥生物),37 ℃恒温孵育90 min,TBST 轻摇清洗3 次如上述。避光条件下滴加化学发光底物,凝胶成像仪显色。单克隆抗β-actin抗体(A2228,Sigma)用于内参。用Quantity One分析软件分析光密度值。
1.6 免疫组化观察组织切片从多聚甲醛中取出后,PBS 清洗,5 min×3次,然后浸入3% H2O2 15 min,山羊血清封闭后加入兔抗铁蛋白多克隆抗体(ab75973,Abcam)4 ℃孵育过夜。PBS清洗,5 min × 3次,生物素标记山羊抗兔IgG(ZB2301,中杉金桥生物) 37 ℃孵育1 h,辣根酶标记链亲和素(ZB2404,中杉金桥生物)室温孵育1 h,DAB染色5 min,PBS终止染色,裱片,烤箱干燥后,二甲苯透明,中性树胶封片,运用Olympus PM20(DX60,Olympus,日本)自动显微镜和病理学图像采集 系统(DP70,Leica,德国)采集图像。应用Image Pro Plus 6.0 软件对每张切片中海马区域免疫阳性细胞的光密度值进行半定量分析。
1.7 qRT-PCR检测将样本分别用液氮研磨粉碎,加入1 mL TRIzol(Invitrogen),吸取到1.5 mL EP 管中,加入500 μL酚氯仿,振荡混匀,静止5 min。置于离心机中于4 ℃离心10 min,小心吸取上层上清于新的离心管中,加入700 μL异丙醇,混匀。于4 ℃ 12 000 r/min 离心10 min,去上清,用75%乙醇洗涤1次,晾干。溶于50 μL DEPC处理水中,电泳检测。反转录使用反转录试剂盒(superscriptⅢ,Invitrogen),按以下建立反应体系(RNA取到200 ng,补水到10 μL):将RNA 10 μL,Oligo-dT(MDL)1 μL,Random(MDL) 1 μL混匀,离心。加入反应液dNTP 1 μL (MDL),0.1 mol/L DTT 2 μL,5×Buffer 4 μL,RT酶1 μL(ABI)混匀,离心。水浴60 min。建立扩增体系:cDNA 2 μL,qPCRmix 10 μL,primerF 1 μL,primerR 1 μL,ddH2O 6 μL。于PCR仪(7900fast,Applied biosystems)上进行反应。铁蛋白引物序列设计:上游 5′-GTGAATGCAATGGAGTGTGC-3′;下游 5′-TCTTGCGTAAGTAAGTTGGTCACG-3′。GAPDH引物序列设计:上游 5′-GTTACCAGGGCTGCCTTCTC-3′;下游 5′-GGGTTTCCCGTTGATGACC-3′。qRT-PCR数据通过2-△△Ct方法进行分析[15]。
1.8 统计学分析应用SPSS 13.0统计软件做统计学分析,数据以 x±s 表示,模型组和对照组组间比较行两独立样本t检验,模型组中SPS后1、3、7 d 3个时相点之间比较行 单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 SPS对动物行为的影响在高架十字实验中,与对照组相比,模型组进入开臂时间百分比明显减少约49%,进入开臂相应路程百分比减少30.2%,进入开臂次数百分比减少36.5%(P<0.05,表 1)。旷场实验结果表明,模型组与对照组相比进入中央区域活动的时间百分比减少约61.3%,路程百分比减少约66.1%,两者差异明显(P<0.05,表 2)。
| 组别 | 开臂进入时间百分比 | 开臂进入路程百分比 | 开臂进入次数百分比 |
| 对照组 | 14.324±2.100 | 19.002±1.911 | 17.184±1.480 |
| 模型组 | 7.257±1.833a | 13.247±1.635a | 10.926±1.615a |
| a:P<0.05,与对照组比较 | |||
| 组别 | 中央区域活动时间(s) | 中央区域活动路程(cm) |
| 对照组 | 20.716±5.061 | 227.460±41.698 |
| 模型组 | 8.036±2.741 a | 77.417±25.652 a |
| a:P<0.05,与对照组比较 | ||
Western blot检测不同脑区铁蛋白含量结果表明,在海马区域,相对于对照组,模型组铁蛋白表达减少约43.5%,两者之间差异具有统计学意义(P<0.05);在纹状体区域,模型组铁蛋白表达增加约29.4%(P<0.05)。在前额叶和小脑区域,2组铁蛋白表达差异无统计学意义(P>0.05,图 1)。
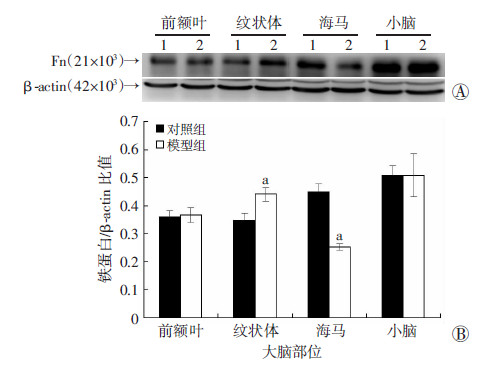 |
| A:Western blot 检测结果 1:对照组;2:模型组;B:半定量分析结果 a:P<0.05,与对照组比较 图 1 Western blot观察前额叶、纹状体、海马、小脑区域铁蛋白变化 |
免疫组化分析海马区域铁蛋白表达,结果与Western blot相一致。海马区域的铁蛋白主要分布于海马椎体细胞层。细胞内铁蛋白主要分布于细胞质,少量位于细胞核。与对照组相比,模型组中海马区域阳性颗粒减少约18.5%,差异具有统计学意义(P<0.05,图 2,表 3)。
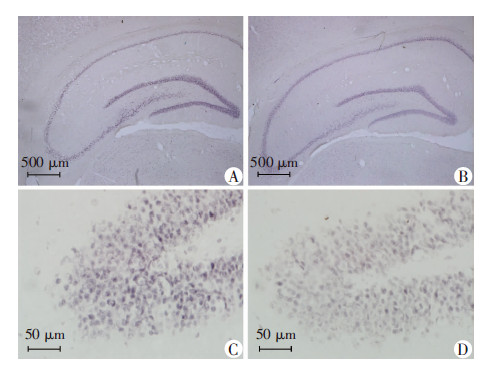 |
| A、C:对照组;B、D:模型组;A、B:铁蛋白在海马区域内的分布;C、D:铁蛋白在细胞内的分布 图 2 免疫组化观察海马区域铁蛋白变化 (IHC) |
qRT-PCR检测结果显示,模型组铁蛋白mRNA表达明显受到抑制(P<0.05)。与对照组相比,模型组海马区域铁蛋白mRNA表达明显减少约90.3%(表 3)。
| 组别 | 海马铁蛋白光密度测量值 | 海马铁蛋白mRNA |
| 对照组 | 0.284±0.012 | 2.000±0.690 |
| 模型组 | 0.231±0.021a | 0.194±0.044a |
| a:P<0.05,与对照组比较 | ||
为了进一步研究铁蛋白减少随时间变化的趋势,我们通过Western blot检测了SPS后1、3、7 d铁蛋白改变的情况,发现和对照组比较,SPS后1 d铁蛋白明显减少约29.8%,3 d时减少约24.6%(P<0.05),7 d 时铁蛋白含量恢复,和对照组比较差异无统计学意义(P>0.05,图 3)。
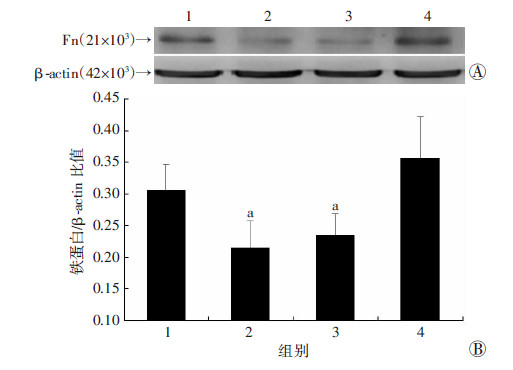 |
| 1:对照组;2:模型组1 d;3:模型组3 d;4:模型组7 d A:Western blot 检测结果;B:半定量分析结果 a:P<0.05,与对照组比较 图 3 Western blot观察SPS应激后海马区域铁蛋白随时间变化的趋势 |
在本实验中,我们主要通过建立PTSD大鼠模型探索铁蛋白的表达情况。与对照组比较,我们发现:①模型组行为发生明显变化;②模型组中铁蛋白在海马区域表达明显减少,在纹状体区域明显增加,在前额叶、小脑区域无明显变化;③模型组海马区域铁蛋白mRNA表达水平明显降低;④模型组海马区域铁蛋白在应激1、3 d明显降低,7 d恢复。这说明铁蛋白表达异常可能参与了PTSD疾病的早期发病过程。
铁蛋白是维持脑内铁稳态的重要因子,主要是通过结合并存储铁池中多余的铁离子,避免细胞发生氧化应激损伤[16]。大量实验表明在一些神经退行性疾病,比如帕金森病、阿尔茨海默病中,脑铁蛋白含量减少导致大量神经元凋亡[17, 18]。早期的研究发现,躯体应激比如游泳、有氧运动、外伤手术可以导致系统铁代谢紊乱[19, 20, 21, 22]。最近国内外研究发现心理和躯体应激可以导致大鼠不同脑区的铁蛋白改变[23, 24]。本研究通过Western blot和IHC检测证明,在SPS后海马区域铁蛋白明显减少,和之前的报道一致[24]。文献[1]表明,海马是发生PTSD疾病的核心区域之一,海马铁蛋白含量的减少可能导致细胞内游离铁增加,产生大量具有氧化毒性作用的羟自由基引起细胞凋亡。除了海马区域,模型组在纹状体观察到铁蛋白含量增加,和文献[24]报道并不完全一致,本研究结果说明在PTSD发病过程中,铁蛋白可能在不同的脑区均具有一定作用。纹状体区域的铁蛋白表达改变,可能导致了纹状体区域结构和功能的异常。相对海马而言,纹状体主要由胶质细胞组成,是对铁较为耐受的区域[25],铁蛋白含量的增加能使多余的铁存贮在细胞内,也可能反映了这些区域神经细胞在脑铁沉积后的代偿机制。我们通过qRT-PCR发现,海马区域的铁蛋白基因表达明显减少,证明应激有可能从基因表达水平影响铁蛋白代谢。目前在帕金森病患者的研究中发现铁蛋白减少也往往伴随铁蛋白基因表达的减少[26]。铁蛋白基因上有铁反应元件,可以与铁调节蛋白结合从而改变铁蛋白的表达。铁调节蛋白是否进行基因调节,还需要进一步实验验证。
为了进一步研究海马区域铁蛋白随时间变化的趋势,我们通过SPS后1、3、7 d进行检测发现,在应激后1 d铁蛋白含量明显减少,3 d铁蛋白含量减少程度和1 d类似,在7 d铁蛋白含量明显恢复。这说明铁蛋白及铁代谢紊乱是一个急性过程,机体在发生紊乱后会有自我代偿调节的机制,但由于细胞内铁离子的巨大毒性作用,疾病早期铁代谢紊乱是否是疾病发生的病因或者一个伴随现象,还不得而知。但我们发现了在PTSD疾病早期过程中存在铁蛋白表达异常,突出了铁代谢在PTSD疾病过程中的作用。
总之,本实验在SPS模型成功建立的基础上发现脑铁蛋白在海马、纹状体的表达存在异常表达,说明在应激早期,铁蛋白可能是造成不同脑区结构和功能异常的重要原因,本研究结果为PTSD的发病机制提供了新的观点。但本实验还存在很多不足,比如没有深入研究纹状体脑铁蛋白的表达异常,没有进行海马铁蛋白变化与行为变化之间的相关性研究,在今后的实验中我们将进一步完善。本研究结果提示铁可能在包括PTSD、抑郁等精神类疾病中发挥作用,以后有可能成为精神性疾病研究的新方向。
| [1] | Pitman R K, Rasmusson A M, Koenen K C, et al. Biological studies of post-traumatic stress disorder[J]. Nat Rev Neurosci, 2012, 13(11): 769-787. |
| [2] | Yehuda R. Post-traumatic stress disorder[J]. N Engl J Med, 2002, 346(2): 108-114. DOI:10.1056/NEJMra012941 |
| [3] | Ponomarev I, Rau V, Eger E I, et al. Amygdala transcriptome and cellular mechanisms underlying stress-enhanced fear learning in a rat model of posttraumatic stress disorder[J]. Neuropsychopharmacology, 2010, 35(6): 1402-1411. |
| [4] | Yamamoto S, Morinobu S, Iwamoto Y, et al. Alterations in the hippocampal glycinergic system in an animal model of posttraumatic stress disorder[J]. J Psychiatr Res, 2010, 44(15): 1069-1074. DOI:10.1016/j.jpsychires.2010.03.013 |
| [5] | Koenigs M, Grafman J. Posttraumatic stress disorder: the role of medial prefrontal cortex and amygdala[J]. Neuroscientist, 2009, 15(5): 540-548. DOI:10.1177/1073858409333072 |
| [6] | Arabadzisz D, Diaz-Heijtz R, Knuesel I, et al. Primate early life stress leads to long-term mild hippocampal decreases in corticosteroid receptor expression[J]. Biol Psychiatry, 2010, 67(11): 1106-1109. DOI:10.1016/j.biopsych.2009.12.016 |
| [7] | Gao J, Wang H, Liu Y, et al. Glutamate and GABA imbalance promotes neuronal apoptosis in hippocampus after stress[J]. Med Sci Monit, 2014, 20: 499-512. |
| [8] | Aisen P, Enns C, Wessling-Resnick M. Chemistry and biology of eukaryotic iron metabolism[J]. Int J Biochem Cell Biol, 2001, 33(10): 940-959. |
| [9] | Hare D, Ayton S, Bush A, et al. A delicate balance: Iron metabolism and diseases of the brain[J]. Front Aging Neurosci, 2013, 5: 34. |
| [10] | Morris C M, Candy J M, Keith A B, et al. Brain iron homeostasis[J]. J Inorg Biochem, 1992, 47(3/4): 257-265. |
| [11] | Harrison P M, Arosio P. The ferritins: molecular properties, iron storage function and cellular regulation[J]. Biochim Biophys Acta, 1996, 1275(3): 161-203. |
| [12] | Liberzon I, Krstov M, Young E A. Stress-restress: effects on ACTH and fast feedback[J]. Psychoneuroendocrinology, 1997, 22(6): 443-453. |
| [13] | Yamamoto S, Morinobu S, Takei S, et al. Single prolonged stress: toward an animal model of posttraumatic stress disorder[J]. Depress Anxiety, 2009, 26(12): 1110-1117. DOI:10.1002/da.20629 |
| [14] | Li X, Han F, Liu D, et al. Changes of Bax, Bcl-2 and apoptosis in hippocampus in the rat model of post-traumatic stress disorder[J]. Neurol Res, 2010, 32(6): 579-586. DOI:10.1179/016164110X12556180206194 |
| [15] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-408. |
| [16] | Arosio P, Ingrassia R, Cavadini P. Ferritins: a family of molecules for iron storage, antioxidation and more[J]. Biochim Biophys Acta, 2009, 1790(7): 589-599. |
| [17] | Connor J R, Snyder B S, Beard J L, et al. Regional distribution of iron and iron-regulatory proteins in the brain in aging and Alzheimer’s disease[J]. J Neurosci Res, 1992, 31(2): 327-335. DOI:10.1002/jnr.490310214 |
| [18] | Grunblatt E, Bartl J, Riederer P. The link between iron, metabolic syndrome, and Alzheimer’s disease[J]. J Neural Transm (Vienna), 2011, 118(3): 371-379. |
| [19] | Konig D, Weinstock C, Keul J, et al. Zinc, iron, and magnesium status in athletes--influence on the regulation of exercise-induced stress and immune function[J]. Exerc Immunol Rev, 1998, 4: 2-21. |
| [20] | Lukaski H C, Hoverson B S, Gallagher S K, et al. Physical training and copper, iron, and zinc status of swimmers[J]. Am J Clin Nutr, 1990, 51(6): 1093-1099. |
| [21] | Nikolova-Todorova Z, Troic T. Effect of surgical trauma on patient nutritional status[J]. Med Arh, 2003, 57(4 Suppl 1): 29-31. |
| [22] | Lyle R M, Weaver C M, Sedlock D A, et al. Iron status in exercising women: the effect of oral iron therapy vs increased consumption of muscle foods[J]. Am J Clin Nutr, 1992, 56(6): 1049-1055. |
| [23] | An L N, Yue Y, Guo W Z, et al. Surgical trauma induces iron accumulation and oxidative stress in a rodent model of postoperative cognitive dysfunction[J]. Biol Trace Elem Res, 2013, 151(2): 277-283. DOI:10.1007/s12011-012-9564-9 |
| [24] | Wang L, Wang W, Zhao M, et al. Psychological stress induces dysregulation of iron metabolism in rat brain[J]. Neuroscience, 2008, 155(1): 24-30. DOI:10.1016/j.neuroscience.2008.03.091 |
| [25] | Erikson K M, Pinero D J, Connor J R, et al. Regional brain iron, ferritin and transferrin concentrations during iron deficiency and iron repletion in developing rats[J]. J Nutr, 1997, 127(10): 2030-2038. |
| [26] | Faucheux B A, Martin M E, Beaumont C, et al. Lack of up-regulation of ferritin is associated with sustained iron regulatory protein-1 binding activity in the substantia nigra of patients with Parkinson’s disease[J]. J Neurochem, 2002, 83(2): 320-330. |



