2. 325035 浙江 温州,温州医科大学附属第一医院急诊科
2. Department of Emergency, First Affiliated Hospital of Wenzhou Medical University, Wenzhou, Zhejiang Province, 325035, China
随着活性氧(reactive oxidative species,ROS)作为第二信使以及它在各种疾病中的广泛研究[1, 2],其测定方法得到了极大的发展,其中二氯荧光黄二乙酸酯(2′,7′-Dichlorodihydrofluorescein diacetate,DCFH-DA)(绿色荧光)探针法是最常用、最快捷、最直观的方法之一。另一方面,4′,6′-二脒基-2-苯基吲哚(4′,6′-diamidino-2-phenylindole,DAPI)(蓝色荧光)作为一种常用的细胞核染料,可透过完整的细胞膜,常用于活细胞和固定细胞的染色,固定后效果更好。为了直观反映不同条件下ROS的变化情况,常规研究需要拍摄绿色荧光照片,同时为了排除非特异的荧光信号和分析数据,还需要拍摄白光或核染色以确定细胞的位置、大小和形态等[3],但白光和绿光在合并时会遇到以下问题:白光太亮或绿光太弱,合并后荧光信号弱;白光太暗,图片不美观;另外利用白光图片定位细胞并不准确(可能有细胞重叠、融合等),也不利于高内涵成像分析系统的分析。由于实现ROS与核的共染能够解决上述问题,而探讨影响ROS与DAPI共染的因素(包括固定试剂的种类、浓度、作用时间、顺序以及活染条件等)对于研究结果的科学性又具有重要作用,因此我们以DCFH-DA探针法和DAPI染色为研究手段,对共染过程中出现的问题进行影响因素分析,以便指导和优化现有方法,为后续研究提供理论支持和技术支撑。
1 材料与方法 1.1 材料与试剂RAW264.7细胞株来自第三军医大学大坪医院野战外科研究所第一研究室;DCFH-DA探针、DAPI染料、DMSO购自美国Sigma公司;0.25%胰蛋白酶、RPMI1640培养基和胎牛血清购自美国HyClone公司;H2O2、多聚甲醛和乙醇由成都市科龙化工试剂厂提供。
1.2 多聚甲醛对共染荧光信号的影响取RAW264.7细胞,弃RPMI1640培养基;用无菌PBS洗涤1次,加0.25%胰酶37 ℃消化3~5 min;用含10% FBS的RPMI1640培养基终止消化,计数;铺板,48孔板,5×104个细胞/孔,37 ℃,5% CO2培养4 h;10 μg/mL LPS刺激12 h,37 ℃,5% CO2培养过夜;PBS洗1次,用0%、0.5%、1%、2%、4%多聚甲醛固定10、30 min,1、2、4 h;PBS洗涤,加入DCFH-DA探针(终浓度20 μmol/L)和DAPI(终浓度1 μg/mL)染料孵育20 min;PBS洗涤2次。高内涵成像分析系统(ImageXpress XLS,Molecular Devices)观察和拍照。
1.3 不同固定方式及其顺序对ROS荧光信号的影响取RAW264.7细胞,按1.2方法常规细胞铺板,37 ℃,5% CO2培养4 h;10 μg/mL LPS刺激12 h,37 ℃,5% CO2培养;次日,1组细胞先用4%多聚甲醛、95%乙醇、70%乙醇固定20 min,PBS洗涤后加入DCFH-DA探针和DAPI染料孵育20 min;另1组先加DCFH-DA探针孵育20 min,再用4%多聚甲醛、95%乙醇、70%乙醇固定20 min,再加DAPI染料孵育20 min;PBS洗涤2次。倒置荧光显微镜(IX71,OLYMPUS)观察和拍照。
1.4 DAPI染色时间对核染色荧光信号的影响细胞培养和铺板方法同1.2。LPS(10 μg/mL)刺激12 h,将细胞分为6组,按DAPI(1 μg/mL)和DCFH-DA(20 μmol/L)顺序依次加样作用,表 1为各试剂加样后的间隔时间。DAPI和DCFH-DA探针孵育后,PBS洗涤2次,倒置荧光显微镜观察和拍照。
| 组别 | DAPI | DCFH-DA |
| 1 | 12 h | 20 min |
| 2 | 4 h | 20 min |
| 3 | 2 h | 20 min |
| 4 | 1 h | 20 min |
| 5 | 20 min | 20 min |
| 6 | 0 min | 20 min |
细胞培养和铺板方法同1.2。根据1.4的实验结果,选择最合适的DAPI染色时间(12 h),分别用LPS(10 μg/mL)进行长效(12 h)刺激或用H2O2(100 μmol/L)进行短效(5 min)刺激;以不加DAPI为对照组,最后加DCFH-DA探针孵育20 min,实验分组设计见表 2。PBS洗涤2次,高内涵成像分析系统进行拍照和数据分析。
1.5实验中每组各设3个重复孔,每孔拍摄9个视野,计算荧光数和荧光强度,用x±s表示,利用SPSS 18.0统计学软件进行t检验。
2 结果 2.1 多聚甲醛负向影响共染效果并呈明显的量效和时效依赖性采用不同浓度(0%、0.5%、1%、2%、4%)多聚甲醛固定不同时间(10、30 min,1、2、4 h)后,高内涵成像分析系统荧光检测结果表明,随着多聚甲醛固定时间的延长和固定浓度的增加,DAPI染色越来越强,但ROS荧光信号越来越弱,甚至消失,两者共染效果极差,同时说明ROS荧光的减弱是由于多聚甲醛固定造成的,而非拍照时间过长自然衰减造成的(因为全部图片的采集仅用5 min),如图 1。
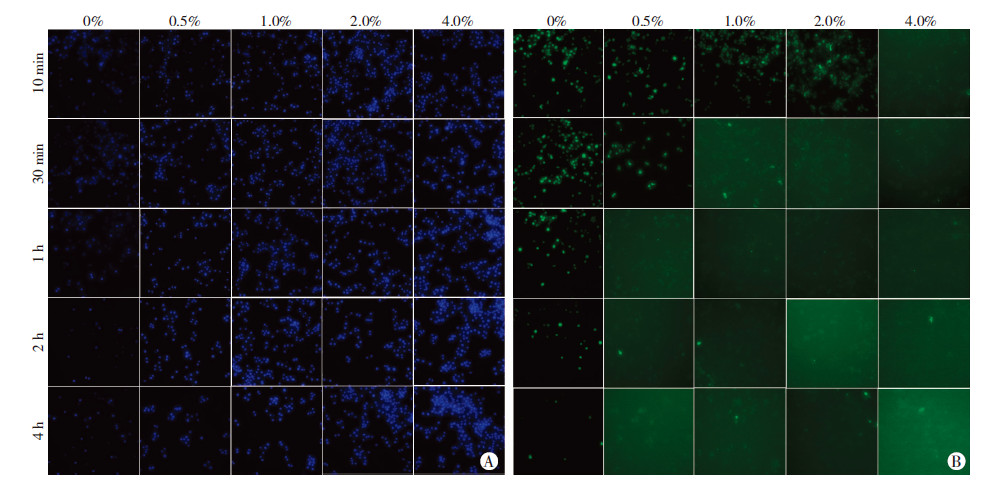 |
| A:不同浓度多聚甲醛固定后DAPI染色结果;B:不同浓度多聚甲醛固定后ROS检测结果图 1 多聚甲醛影响DAPI和ROS荧光信号的量效和时效作用(×200) |
采用3种固定液(4%多聚甲醛、95%冰乙醇、70%冰乙醇)和两种固定顺序(固定在DCFH-DA探针孵育之前和之后)作用细胞后,进行ROS荧光检测。图 2结果表明,无论采用哪种固定方式和固定顺序,只要细胞固定后ROS荧光信号都会减弱甚至消失。
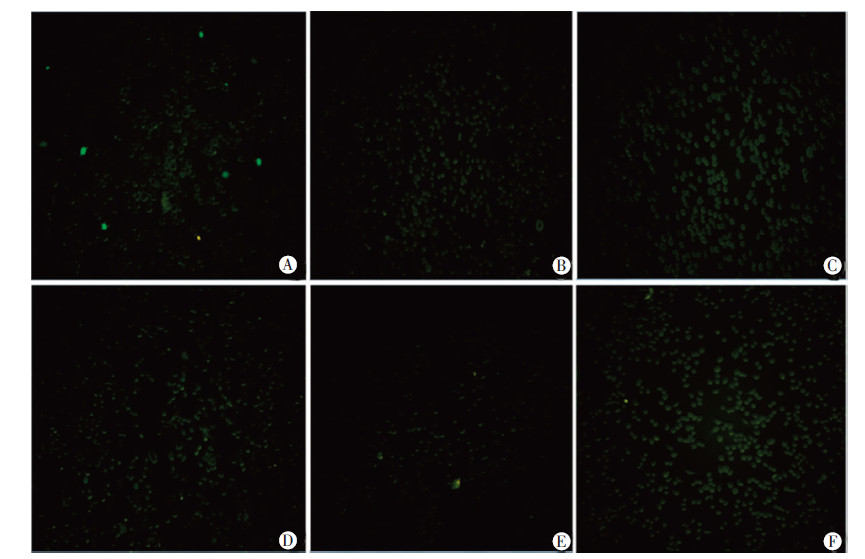 |
| A:不同浓度4%多聚甲醛固定后加探针检测ROS;B:不同浓度95%冰乙醇固定后加探针检测ROS;C:70%冰乙醇固定后加探针检测ROS;D:加探针后4%多聚甲醛固定再检测ROS;E:加探针后95%冰乙醇固定再检测ROS;F: 加探针后70%冰乙醇固定再检测ROS图 2 不同固定方式和顺序与ROS荧光信号的变化(×200) |
DAPI染料在DCFH-DA探针孵育前12、4、2、1 h,20 min以及同时加入后,进行DAPI荧光检测。图 3结果表明,DAPI染色时间越短,染色弱且弥散,而随着DAPI染色时间的延长,核染色信号越强且集中。
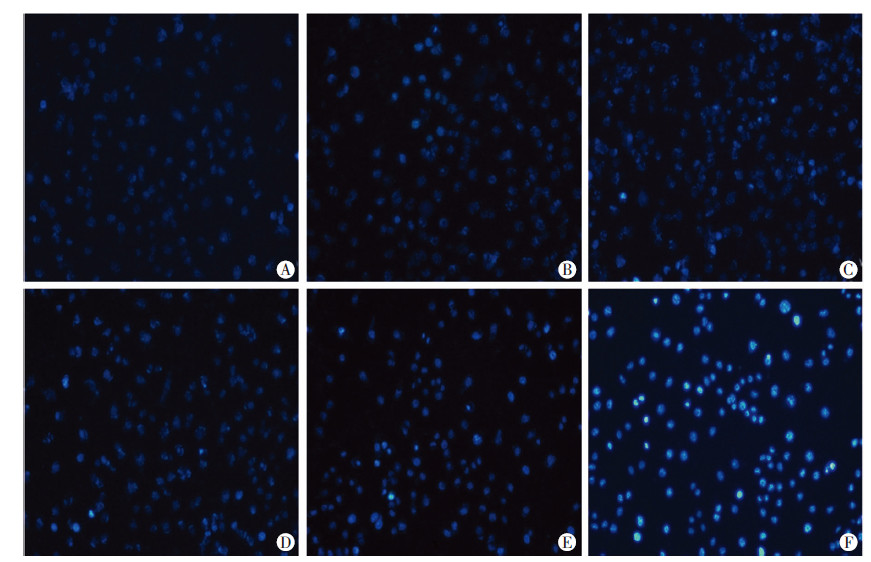 |
| A: DAPI和探针同时加入染色20 min;B: DAPI在探针加入前染色20 min;C: DAPI在探针加入前染色1 h;D:DAPI在探针加入前染色2 h;E: DAPI在探针加入前染色4 h;F:DAPI在探针加入前染色12 h图 3 DAPI染色时间与核染色荧光信号变化(×200) |
分别采用两种刺激方式(LPS长时间刺激和H2O2短时间刺激)产生ROS,同时进行加/不加DAPI染色12 h,再孵育DCFH-DA探针20 min,PBS洗涤后使用高内涵成像分析系统荧光检测。每个实验组3个重复孔,每孔9个视野。结果表明,DAPI染色12 h对两种刺激方式产生的ROS的平均荧光数和平均荧光强度均无统计学差异(P>0.05),即DAPI染色12h不影响ROS的产生和荧光信号的检测(图 4)。
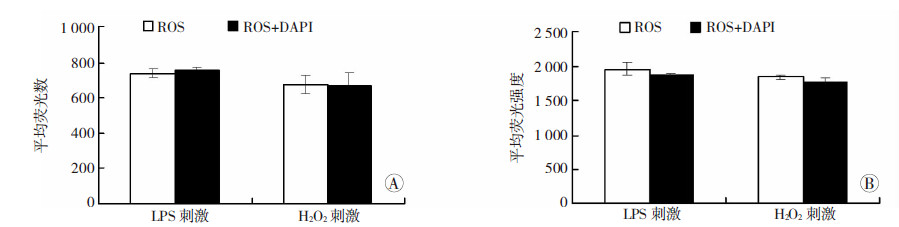 |
| A:荧光数;B:荧光强度图 4 DAPI对不同方式产生ROS荧光信号的影响 |
采用DAPI活细胞染色12 h后进行ROS检测,图 5结果显示,既能检测到ROS的荧光信号,同时细胞核也着色明显,该条件很好实现了二者的共染。
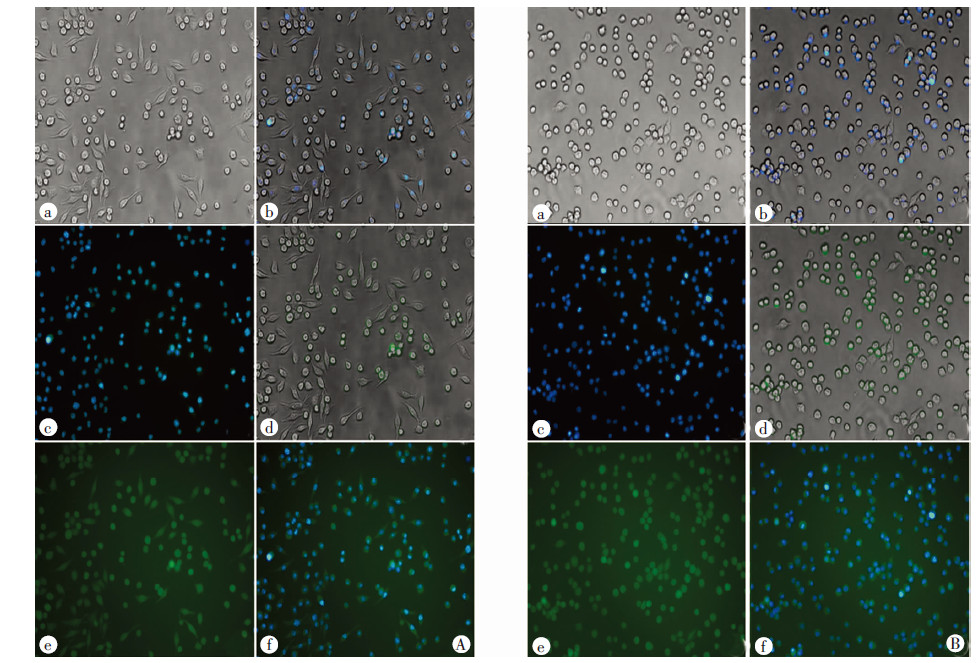 |
| A: LPS刺激下,DAPI与ROS染色结果;B:H2O2刺激下,DAPI与ROS染色结果;a:白光观察;b: DAPI染色结果; c: ROS染色结果;d:白光和DAPI融合; e:白光和ROS融合; f: DAPI和ROS融合图 5 不同方式产生的ROS与DAPI的共染效果(×200) |
ROS的检测对于及时了解正常或疾病条件下的机体生理/病理反应、预防疾病发生具有重要意义[4, 5, 6, 7, 8, 9, 10, 11, 12]。目前常用于ROS测定的荧光探针包括DCFH-DA、双氢罗丹明、氢化乙啡啶等,而DCFH-DA探针法因其简单、方便被广泛使用[13],其原理包括酯酶的水解和活性氧的氧化两个过程[14]。
按惯性思维在ROS检测时采用固定后DAPI染色(不同固定试剂、浓度、顺序),虽然可以染核,但ROS荧光信号减弱甚至消失,这个现象在A549和HeLa等细胞中也被观察到,分析其原因可能有:ROS检测主要针对细胞膜没有损坏的活细胞,而一经固定,细胞膜的通透性可能发生改变或者固定后导致细胞死亡,从而使活性氧消亡;因此,DCFH-DA探针法不宜与细胞固定一起使用。在不固定细胞的前提下,直接DAPI进行活染,则发现活细胞短时间染核存在荧光信号弱,弥散,漏染等问题,影响图片合并效果和定量分析,因此建议DAPI在染活细胞时,延长染色时间至4~12 h(相对固定细胞的10 min短染),且在探针孵育前染色,因为ROS的产生和消亡是一个比较快速的过程(20~30 min)。
由于本研究使用的高内涵成像系统是一款集速度、图像、数据为一体的荧光系统,耗时短(一般每孔扫描时间在几秒到几十秒之间),特别适合荧光反应迅速的样品检测,例如本研究完成全部孔荧光检测仅用5 min,有效避免常规研究中将“固定导致的荧光衰减”误判为是“拍照后期荧光的自然衰减”,另外可以对荧光信号进行定量分析,从而保证数据的可信度和结论的可靠性。
综上所述,DCFH-DA探针法检测ROS荧光时不能与细胞固定连用,这可能使它在免疫组化和免疫荧光中的应用受到一定限制;但是,DAPI在DCFH-DA探针孵育前12 h加入,并不影响ROS荧光的产生和检测,同时又能将细胞核染色,实现ROS与DAPI在活细胞水平的共染,有助于准确研究ROS在创伤、炎症和疾病组织及细胞中的表达和定位。
| [1] | Holmstrom K M, Finkel T. Cellular mechanisms and physiological consequences of redox-dependent signalling[J]. Nat Rev Mol Cell Biol, 2014, 15(6): 411-421.DOI:10.1038/nrm3801 |
| [2] | Phaniendra A, Jestadi D B, Periyasamy L. Free radicals: properties, sources, targets, and their implication in various diseases[J]. Indian J Clin Biochem, 2015, 30(1): 11-26.DOI:10.1007/s12291-014-0446-0 |
| [3] | Kunz A, Dirnagl U, Mergenthaler P. Acute pathophysiological processes after ischaemic and traumatic brain injury[J]. Best Pract Res Clin Anaesthesiol, 2010, 24(4): 495-509. |
| [4] | 梁馨予, 张婷, 周永, 等. 杨梅素减轻高糖诱导的血管内皮细胞氧化应激损伤[J]. 第三军医大学学报, 2013, 35(21): 2301-2305. |
| [5] | Kalyanaraman B, Darley-Usmar V, Davies K J, et al. Measuring reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations[J]. Free Radic Biol Med, 2012, 52(1): 1-6. |
| [6] | Dikalov S I, Harrison D G. Methods for detection of mitochondrial and cellular reactive oxygen species[J]. Antioxid Redox Signal, 2014, 20(2): 372-382.DOI:10.1089/ars.2012.4886 |
| [7] | Mo C, Wang L, Zhang J, et al. The crosstalk between Nrf2 and AMPK signal pathways is important for the anti-inflammatory effect of berberine in LPS-stimulated macrophages and endotoxin-shocked mice[J]. Antioxid Redox Signal, 2014, 20(4): 574-588.DOI:10.1089/ars.2012.5116 |
| [8] | 王真真, 刘地川, 蔡敏, 等. 别嘌呤醇对慢性心衰大鼠心功能的改善作用[J]. 第三军医大学学报, 2014, 36(10): 1021-1025. |
| [9] | Yadav U C, Kalariya N M, Srivastava S K, et al. Protective role of benfotiamine, a fat-soluble vitamin B1 analogue, in lipopolysaccharide-induced cytotoxic signals in murine macrophages[J]. Free Radic Biol Med, 2010, 48(10): 1423-1434. |
| [10] | Halliwell B. The wanderings of a free radical[J]. Free Radic Biol Med, 2009, 46(5): 531-542. |
| [11] | Barnham K J, Masters C L, Bush A I. Neurodegenerative diseases and oxidative stress[J]. Nat Rev Drug Discov, 2004, 3(3): 205-214. |
| [12] | Maiese K. New Insights for Oxidative Stress and Diabetes Mellitus[J] . Oxid Med Cell Longev, 2015, 2015: 875961. |
| [13] | Roy K, Wu Y, Meitzler J L, et al. NADPH oxidases and cancer[J]. Clin Sci (Lond), 2015, 128(12): 863-875.DOI:10.1042/CS20140542 |
| [14] | Huang S K, Zhang Q, Qiu Z, et al. Mechanistic impact of outdoor air pollution on asthma and allergic diseases[J]. J Thorac Dis, 2015, 7(1): 23-33.DOI:10.3978/j.issn.2072-1439.2014.12 .13 |



