2. 400038 重庆,第三军医大学:西南医院肝胆外科
2. Department of Hepatobiliary Surgery, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
Gasdermin A3基因简称Gsdma3,位于小鼠第11号染色体,是Gasdermin基因家族成员之一[1, 2]。Gsdma3 基因特异的表达于小鼠皮肤上皮细胞,其基因突变鼠具有毛囊分化异常、角质层增厚及表皮过度增殖等表型[3]。
角质蛋白是一个大的蛋白家族,是皮肤、毛发以及指甲的重要组成成分[4]。Krt6b蛋白是角蛋白的一种,属于二型角蛋白。Krt6b基因多表达于生长期毛囊的外根鞘、甲床上皮细胞以及口腔和食管上皮细胞谱系的细胞中[5]。Krt6b蛋白可以和其他角蛋白相互作用形成角蛋白细丝。这些细丝可以形成稠密的网络,从而可以给皮肤及其他组织提供支撑。这些角蛋白细丝 网络可以保护这些组织,使得这些组织不会受到外界摩擦以及机械压力的损伤。Krt6b蛋白与其他一些角蛋白还参与创伤修复[4]。除此之外,更重要的是,Krt6b蛋白是皮肤角质形成细胞分化的一个重要标志物。
Gsdma3基因突变后可造成毛囊分化的异常,而Krt6b基因又是分化的重要标志物。本研究拟通过对Gsdma3基因突变鼠的Krt6b基因表达进行检测,初步探究Gsdma3基因与Krt6b基因表达之间的关系。
1 材料与方法 1.1 主要材料 1.1.1 实验动物成年雄性Gsdma3基因突变鼠由南京大学模式动物研究中心友情馈赠,雌性野生型鼠购自第三军医大学实验动物中心,实验用的Gsdma3基因突变鼠和野生型鼠是由雄性Gsdma3基因突变鼠和雌性野生型鼠交配而得。实验材料:分别取雌性,出生后8 d(P8d,毛囊生长期)、16 d(P16d,毛囊退化期)及25 d(P25d,毛囊静止期)的Gsdma3基因突变鼠和野生型鼠背皮组织材料。
1.1.2 主要试剂及仪器TRIzol(Roche,瑞士),反转录第1链cDNA合成试剂盒(天根,中国;TaKaRa,日本),SYBR Premix Ex TaqⅡ(TaKaRa,日本),兔源Krt6b抗体(Abcam,美国),555标记驴抗兔(Invitrogen,美国),抗原修复液、抗荧光猝灭封片剂、免疫染色封闭液(碧云天,中国),StainFree蛋白凝胶制备试剂盒、蛋白定量试剂盒(Bio-Rad,美国),RIPA、一抗、二抗稀释液、Western封闭液(碧云天,中国),Cocktail(Roche,瑞士),HRP标记的驴抗兔(碧云天,中国),DAPI(碧云天,中国)。垂直电泳仪、湿转仪,化学发光仪(Bio-Rad,美国),石蜡切片机(Leica,德国),凝胶成像仪、实时定量PCR仪、横向电泳仪(Bio-Rad,美国),荧光显微镜(Nikon,日本),蛋白定量分析仪(Thermo,美国)。
1.2 方法 1.2.1 取材、固定及石蜡切片取不同鼠龄Gsdma3基因突变鼠(AE)和野生型鼠(WT),颈椎脱臼法处 死,取其颈背部皮肤,4%多聚甲醛4 ℃固定过夜,常规梯度酒精脱水,二甲苯透明,浸蜡包埋,5 μm石蜡切片。
1.2.2 免疫荧光检测常规脱蜡、梯度酒精水合;改进型柠檬酸盐抗原修复液95~100 ℃修复7 min;冷却至室温;PBS清洗3次,每次5 min;免疫染色封闭液封闭1 h;加入兔来源Krt6b抗体(工作浓度1 ∶200),4 ℃ 孵育过夜,另外取一张片子以PBS代替一抗作为空白对照。一抗孵育结束后PBS清洗3次,每次10 min;加入555标记的驴抗兔的荧光二抗,4 ℃孵育4 h;加入DAPI染色液染细胞核;PBS清洗4次,每次10 min;用抗荧光猝灭封片剂封片,荧光显微镜下观察记录。
1.2.3 实时定量PCR和RT-PCR检测RNA的提取:在加有液氮的研钵中将获得的小鼠皮片分别磨碎,随后加入TRIzol提取RNA。分别取1 μg mRNA作为模板进行逆转录反应获得cDNA,具体条件参照天根公司和TaKaRa公司的逆转录反应步骤。实时定量PCR反应体系包括: 总体积20 μL,Mixer10 μL,1 μL上游引物(浓度为10 μmol/L),1 μL下游引物(浓度为10 μmol/L),1 μL cDNA 200 ng,加ddH2O补足20 μL。反应条件为95 ℃预变性30 s,95 ℃ 5 s,60 ℃ 30 s,读值,回到第2步,反应39个循环,95 ℃10 s,绘制溶解曲线。每次每个样本重复3个复管,将采集到的信号做统计学分析。RT-PCR反应体系包括: 总体积25 μL,PCR Mixer12.5 μL,上游引物(浓度为10 μmol/L)1 μL,下游引物(浓度为10 μmol/L)1 μL,cDNA1 μL,加ddH2O补足25 μL。反应条件为95 ℃预变性5 min,95 ℃ 30 s,60 ℃1 min,72 ℃ 30 s,反应25个循环,72 ℃延伸10 min后4 ℃保存。将所得的DNA产物置1%琼脂糖凝胶电泳,在凝胶成像仪下采集图像(表 1)。
| 基因名称 | 引物序列(5′→3′) |
| Krt6b | 上游 TGTGTCCTCTCGCTTCTCTTTTT 下游 GAAAAATGGGGTTTCCCAGGC |
| Gsdma3 | 上游 CAGCTTGGCTCTACTGGGAC 下游 CGCCTGATCTTAGGGAAGGTTT |
| β-actin | 上游 AGGGAAATCGTGCGTGACAT 下游 AGCTCAGTAACAGTCCGCCT |
| GAPDH | 上游 TGTGTCCGTCGTGGATCTGA 下游 TTGCTGTTGAAGTCGCAGGAG |
在加有液氮的研钵中将小鼠皮片分别研碎,依照每20 mg组织加200 μL RIPA 裂解液,并用RIPA裂解液将10×的cocktail稀释为1×。将组织粉末裂解完全14 800×g离心10 min,共离心3次,收集上清液。BCA法测定蛋白浓度,蛋白在100 ℃变性5 min。待StainFree 蛋白凝胶凝固后,将胶上架,放入电泳槽内,槽内加入电泳缓冲液。蛋白 样品上样20 μg,电泳后将胶取出,用化学发光仪去照胶上蛋白,然后电转到PVDF膜上,用TBST漂洗PVDF膜,在Western封闭液中室温封闭1~2 h,用一抗稀释液按照1 ∶2 000稀释抗Krt6b抗体,4 ℃过夜。PBS漂洗3次,每次15 min。用二抗稀释液依照1 ∶1 000 的比例稀释HRP标记的抗兔二抗,将膜在室温条件下孵育1 h。PBS漂洗4次,每次15 min配置好发光显色液后显色1 min,之后用化学发光仪采集相片。
1.2.5 小鼠注射实验Gsdma3基因突变鼠Gsdma3 回补实验退化期Gsdma3基因突变鼠的AdGsdma3注射:分别在出生后第16、18、20天3次向Gsdma3基因突变鼠背部皮肤注射Gsdma3腺病毒及RFP对照病毒(AdRFP),出生后第24天取材。按常规材料处理方式进行固定包埋切片,然后进行免疫荧光检测。
拔毛模型AdGsdma3注射:对出生后50 d野生型鼠麻醉后进行拔毛,并于出生后第50、52、54天3次向野生型鼠背部皮肤注射Gsdma3腺病毒及RFP对照病毒(AdRFP),出生后第57天取材。按常规材料处理方式进行固定包埋切片,然后进行免疫荧光检测。
1.3 统计学分析采用GraphPad Prism 6软件进行统计处理,组间差异采用t检验。
2 结果 2.1 Gsdma3基因突变后Krt6b基因在小鼠毛囊周期中的表达定位免疫荧光结果显示(图 1):无论是在Gsdma3基因突变鼠的颈背部皮肤中,还是在野生型鼠的颈背部皮肤中,Krt6b蛋白在生长期(P8d)以及退化期(P16d)的毛囊中,在静止期(P25d)的毛囊中几乎没有检测到明显的Krt6b基因表达。其中,退化期的Krt6b基因的表达阳性强度最大。毛囊生长期(P8d),Krt6b蛋白定位在表皮、毛囊外根鞘以及毛球部外侧。在毛囊退化期(P16d),表达量增多,Krt6b蛋白定位在表皮和毛囊外根鞘,在Gsdma3基因突变鼠背部皮肤中,毛母质也有Krt6b基因的表达。在静止期(P25d),Gsdma3基因突变鼠和野生型鼠的表Gsdma3基因突变鼠Krt6b基因阳性细胞出现在毛囊外根鞘和毛母质外侧。总体看来,同时期的Gsdma3基因突变鼠与野生型鼠相比,Gsdma3 基因突变鼠Krt6b基因的阳性表达强度要大些。
 |
| 红色:Krt6b;蓝色:DAPI 图 1 免疫荧光观察Gsdma3基因突变鼠(AE)与野生型鼠(WT)背部皮肤Krt6b基因在毛囊周期中的表达定位 |
实时定量PCR检测结果显示:Krt6b基因 mRNA高表达于毛囊生长期和退化期的小鼠背皮中,而静止期的表达量很少。相同时期Gsdma3基因突变鼠的Krt6b基因mRNA表达量均显著高于野生型鼠(P<0.01,图 2A)。RT-PCR检测结果显示:与实时定量PCR检测的结果保持相同的趋势,Krt6b基因 mRNA高表达于退化期,生长期时表达量较少,在静止期时表达最低(图 2B)。
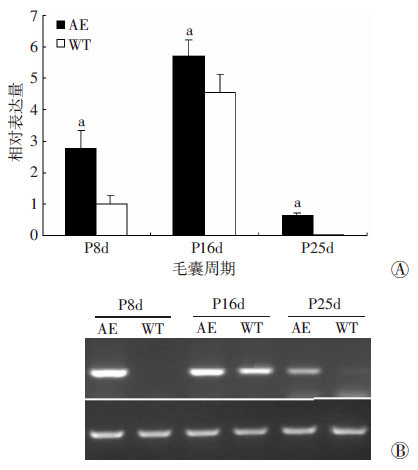 |
| A:实时定量PCR检测结果 a:P<0.01,与WT比较;B:RT-PCR检测结果 图 2 PCR检测Gsdma3基因突变鼠(AE)与野生型鼠(WT)背部皮肤Krt6b基因在毛囊周期中的表达 |
Western blot检测结果显示:Krt6b蛋白在小鼠出生后16 d(退化期)表达量最大,在小鼠出生后8 d(生长期)和25 d(静止期)的表达量都比较小。相同时期的Gsdma3基因突变鼠和野生型鼠Krt6b蛋白表达量之间差异均有统计学意义(P<0.05,图 3)。
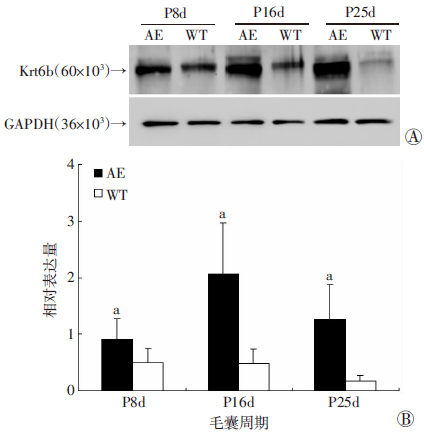 |
| A:Western blot 检测结果;B:半定量分析 a:P<0.05,与WT比较 图 3 Western blot检测Gsdma3基因突变鼠(AE)与野生型鼠 (WT)背部皮肤Krt6b蛋白在毛囊周期中的表达 |
为了进一步探讨Gsdma3基因突变与Krt6b基因表达之间的相关性,我们对退化期(P16d)的Gsdma3基因突变鼠进行了Gsdma3腺病毒的注射。并对腺病毒注射区进行免疫荧光检测发现,AdGsdma3注射后,毛囊外根鞘,毛球部以及表皮的Krt6b基因表达量明显下降,并且可以看出AdGsdma3处理鼠皮肤中细胞数量远远多于AdRFP鼠(图 4A~D)。实时定量PCR检测结果显示(图 4E):AdGsdma3处理后的小鼠背皮注射区Krt6b基因mRNA的表达量要低于AdRFP处理后的小鼠背皮注射区(P<0.05);Western blot检测结果显示(图 4F):AdGsdma3处理后的小鼠背皮注射区Krt6b蛋白的表达量要低于AdRFP处理后的小鼠背皮注射区。表明Gsdma3基因表达与Krt6b基因表达之间存在负相关,Gsdma3基因可能具有抑制Krt6b基因表达的作用。
 |
| A:免疫荧光检测AdRFP处理鼠注射区Krt6b基因表达(×100);B:免疫荧光检测AdGsdma3处理鼠注射区Krt6b基因表达(×100);C:免疫荧光检测AdRFP处理鼠注射区表皮细胞中Krt6b基因的表达(×400);D:免疫荧光 检测AdGsdma3处理鼠注射区表皮细胞中Krt6b基因的表达(×400)红色:Krt6b;蓝色:DAPI;E:AdRFP和AdGsdma3 处理鼠注射区实时定量PCR检测结果 a:P<0.01,与AdGsdma3处理鼠比较;F:AdRFP和AdGsdma3处理鼠注射区Western blot 检测结果 图 4 免疫荧光、实时定量PCR及Western blot检测AdGsdma3及AdRFP对Gsdma3基因突变鼠毛囊Krt6b基因表达的影响 |
为进一步了解Gsdma3基因对Krt6b基因表达的作用,我们对第2轮毛囊周期静止期的野生型鼠进行了拔毛处理,从而可以使得野生型鼠同步化进入生长期。对此同步化野生型鼠进行了Gsdma3的腺病毒注射,并对注射区进行了免疫免疫荧光检测,发现AdRFP处理组毛囊形态完整,而与AdRFP处理组相比,过表达Gsdma3基因的背部皮肤中见不到明显完整的毛囊结构,仅有部分长成的类毛囊结构。注射AdRFP区域的毛囊其Krt6b基因阳性表达强度明显高于注射AdGsdma3区域,其中注射AdRFP区域的毛囊在毛球部有较强的Krt6b基因的表达(图 5A~D)。同时,实时定量PCR检测结果显示(图 5E):AdGsdma3处理后的小鼠背皮注射区Krt6b基因mRNA的表达量要低于AdRFP处理后的小鼠背皮注射区(P<0.05);Western blot检测结果显示(图 5F):AdGsdma3处理后的小鼠背皮注射区Krt6b蛋白的表达量要低于AdRFP处理后的小鼠背皮注射区。
 |
| A:免疫荧光检测AdRFP处理鼠注射区Krt6b基因表达(×100);B:免疫荧光检测AdGsdma3处理鼠注射区Krt6b基因表达(×100);C:免疫荧光检测AdRFP处理鼠注射区毛球部Krt6b基因的表达(×400);D:免疫荧光检测AdGsdma3处理鼠注射区类毛囊状结构Krt6b基因的表达(×400) 红色:Krt6b;蓝色:DAPI;E:AdRFP和AdGsdma3处理鼠注射区实时定量PCR检测结果 a:P<0.01,与AdGsdma3处理鼠比较;F:AdRFP和AdGsdma3处理鼠注射区Western blot 检测结果 图 5 免疫荧光、实时定量PCR及Western blot检测AdGsdma3及AdRFP处理对野生型鼠毛囊Krt6b基因表达的影响 |
近年来,有报道发现Gsdma3基因除了可以表达在如毛囊毛球部细胞这种分裂中的细胞,还在位于上基底层以及毛囊内根鞘的已分化的皮肤角质形成细胞中有表达[6, 7]。因此可以看出,Gsdma3基因与皮肤上皮组织增殖、分化有非常密切的关系[7],是分化中不可或缺的重要因子。本研究通过检测皮肤角质形成细胞分化相关基因Krt6b在Gsdma3基因突变后的异常表达,充实了有关Gsdma3基因突变后导致毛囊分化异常的证据,揭示了Gsdma3基因与Krt6b基因之间表 达的相关性,证实在小鼠皮肤角质形成细胞中,Gsdma3 基因具有影响Krt6b基因表达的新功能,是调节Krt6b基因表达的新因子。
目前,国内外鲜有关于Krt6b基因的表达与小鼠毛囊生长周期关系的报道。然而,本研究发现,Krt6b基因的表达随着毛囊生长周期进程发展而变化(图 2、3)。小鼠毛囊生长周期是一个皮肤角质形成细胞从 分化初始到分化终末,最后回到静息的过程。在毛囊生长期时(P8d),毛囊干细胞不断分化以建成完整的毛囊,此时是皮肤角质形成细胞的分化初始阶段,此过程中仍有部分细胞未到终末分化阶段。因此,Krt6b基因的表达量相对较低。然而,毛囊的退化期(P16d),是皮肤角质形成细胞分化至终末分化的阶段。此时绝大部分皮肤角质形成细胞均进入到终末分化阶段,因此在这一时期时Krt6b基因的表达量最高。到最后,进入到静止期,此时的毛囊处于静息的状态,所有干细胞几乎不进行分化,因此几乎没有了终末分化细胞,所以,在这时候Krt6b基因的表达量降至最低。Krt6b基因的表达量随着毛囊的生长周期的变化而变化,说明Krt6b基因是参与毛囊生长周期的重要因子,参与了皮肤角质形成细胞的分化过程。
研究报道,Krt6b基因在毛囊外根鞘有表达[8, 9, 10, 11],毛囊外根鞘的角质形成细胞可以分化形成毛干[12]。本研究也发现Krt6b基因在毛囊外根鞘有表达,提示 Krt6b基因可能参与了外根鞘中角质形成细胞的分化。此外,我们还发现Krt6b基因在表皮的上基底层也有表达(图 1)。表皮的上基底层是基底层原始细胞向上分化为棘层的阶段,而棘层细胞可以参与伤口愈合。提示Krt6b基因可能参与了皮肤表皮的创伤修复。
从图 2可见,在Gsdma3基因突变鼠中Krt6b基因的表达量无论是在mRNA水平还是在蛋白水平均高于野生型鼠,表明Gsdma3基因抑制Krt6b基因的表达。通过基因回补,我们发现Gsdma3基因突变鼠在基因回补后,Krt6b基因的表达回归到正常水平,同时,表皮角质层及毛囊形态接近野生型小鼠。我们之前的研究发现,Gsdma3基因突变后,小鼠皮肤会增厚,而毛囊会出现退化期延长,静止期缺失的现象[3]。这些均进一步证明Gsdma3基因可以通过影响Krt6b基因的表达量来引起表皮及毛囊细胞分化异常。
那么Gsdma3基因究竟如何调节Krt6b基因的表达呢?Wnt/β-catenin信号通路对毛囊分化起着重要的调节作用。Frizzled是Wnt/β-catenin信号通路的受体,其基因家族中有7个成员。近年有报道称Frizzled基因家族中的成员:Frizzled3、Frizzled4以及Frizzled6等在毛囊中均有表达[13]。又有报道称,Krt6b基因在转录水平可以受到Frizzled6基因的调节[14],而Frizzled6蛋白是Wnt信号通路的受体之一[15]。因此,Krt6b基因可以受到Wnt信号通路的调节。同时,我们之前研究发现Gsdma3基因可以控制调节β-catenin的表达[16],β-catenin是Wnt/β-catenin信号通路的核心分子。综上所述,我们推测Gsdma3基因可能通过Wnt信号通路来调节Krt6b基因表达。然而,这一猜想还需要我们进一步进行实验验证。
| [1] | Katoh M, Katoh M. Evolutionary recombination hotspot around GSDML-GSDM locus is closely linked to the oncogenomic recombination hotspot around the PPP1R1B-ERBB2-GRB7 amplicon[J]. Int J Oncol, 2004, 24(4): 757-763. |
| [2] | Runkel F, Marquardt A, Stoeger C, et al. The dominant alopecia phenotypes Bareskin, Rex-denuded, and Reduced Coat 2 are caused by mutations in gasdermin 3[J]. Genomics, 2004, 84(5): 824-835. DOI: 10.1016/j.ygeno.2004.07.003 |
| [3] | Bai X, Lei M, Shi J, et al. Roles of Gasdermin A3 in catagen-telogen transition during hair cycling[J]. J Invest Dermatol, 2015, 135(9): 2162- 2172. DOI: 10.1038/jid.2015.147 |
| [4] | Lessard J C, Pina-Paz S, Rotty J D, et al. Keratin 16 regulates innate immunity in response to epidermal barrier breach[J]. Proc Natl Acad Sci U S A, 2013, 110(48): 19537-19542. DOI: 10.1073/pnas.1309576110 |
| [5] | Chen J, Jaeger K, Den Z, et al. Mice expressing a mutant Krt75(K6hf) allele develop hair and nail defects resembling pachyonychia congenita[J]. J Invest Dermatol, 2008, 128(2): 270-279. DOI: 10.1038/sj.jid.5701038 |
| [6] | Lunny D P, Weed E, Nolan P M, et al. Mutations in gasdermin 3 cause aberrant differentiation of the hair follicle and sebaceous gland[J]. J Invest Dermatol, 2005, 124(3): 615-621. DOI: 10.1111/j.0022-202X.2005.23623.x |
| [7] | Tanaka S, Tamura M, Aoki A, et al. A new Gsdma3 mutation affecting anagen phase of first hair cycle[J]. Biochem Biophys Res Commun, 2007, 359(4): 902-907. DOI: 10.1016/j.bbrc.2007.05.209 |
| [8] | Rothnagel J A, Seki T, Ogo M, et al. The mouse keratin 6 isoforms are differentially expressed in the hair follicle, footpad, tongue and activated epidermis[J]. Differentiation, 1999, 65(2): 119-130. DOI: 10.1046/j.1432-0436.1999.6520119.x |
| [9] | Takahashi K, Yan B, Yamanishi K, et al. The two functional keratin 6 genes of mouse are differentially regulated and evolved independently from their human orthologs[J]. Genomics, 1998, 53(2): 170-183. DOI: 10.1006/geno.1998.5476 |
| [10] | Winter H, Langbein L, Praetzel S, et al. A novel human type Ⅱ cytokeratin, K6hf, specifically expressed in the companion layer of the hair follicle[J]. J Invest Dermatol, 1998, 111(6): 955-962. DOI: 10.1046/j.1523-1747.1998.00456.x |
| [11] | Wojcik S M, Imakado S, Seki T, et al. Expression of MK6a dominant-negative and C-terminal mutant transgenes in mice has distinct phenotypic consequences in the epidermis and hair follicle[J]. Differentiation, 1999, 65(2): 97-112. DOI: 10.1046/j.1432-0436.1999.6520097.x |
| [12] | Hardy M H. The secret life of the hair follicle[J]. Trends Genet, 1992, 8(2): 55-61. |
| [13] | 陈年, 伍津津, 邱伟明, 等. Frizzled4在小鼠毛囊周期中的表达[J].第三军医大学学报, 2014, 36(7): 631-635. |
| [14] | Cui C Y, Klar J, Georgii-Heming P, et al. Frizzled6 deficiency disrupts the differentiation process of nail development[J]. J Invest Dermatol, 2013, 133(8): 1990-1997. DOI: 10.1038/jid.2013.84 |
| [15] | Dale T C. Signal transduction by the Wnt family of ligands[J]. Biochem J, 1998, 329(Pt 2): 209-223. |
| [16] | Lei M, Yang T, Lai X, et al. Upregulation of interfollicular epidermal and hair infundibulum beta-catenin expression in Gsdma3 mutant mice[J]. Acta Histochem, 2013, 115(1): 63-69. DOI: 10.1016/j.acthis.2012.04.002 |



