Gu Qiang,E-mail:Qiang.gu@hotmail.com
STAT3 被上游信号通路激活后[1],通过其蛋白区域的 SH2 功能域的磷酸化形成同源或异源的二聚体,进入核内结合 DNA,调控下游靶基因如 Bcl-xL、Bcl-2、Mcl-1、CyclinD1、c-Myc、c-Jun、Fas 和 VEGF 等。
MicroRNAs(miRNAs)是一组不编码蛋白质的21-25nt 长的单链小分子RNA,广泛存在于植物、动物以及病毒等真核细胞生物中,参与了动植物许多复杂的生命过程,包括生长发育、器官形成、细胞凋亡、细胞增殖等。一些miRNA被证实参与调控心脏疾病的病理生理发展过程[2, 3, 4]。
miR-17-5p属于miR-17-92基因簇,定位于人染色体13q31,是一种编码6个miRNA的多顺反子性的miRNA[5, 6]。有研究显示[7],在心肌缺血再灌注小鼠模型和体外由H2O2诱导的氧化应激小鼠心肌细胞模型中,miR-17-5p参与调控STAT3的表达,从而调节心肌细胞功能。本实验旨在研究心肌慢性缺氧过程中miR-17-5p和STAT3的表达变化以及miR-17-5p通过对STAT3信号通路的调控对缺氧心肌细胞的影响。
1 资料与方法 1.1 资料与分组经本院伦理委员会批准,术前征得患儿家属同意并签字。选择2014年8月-2015年4月期间,因术前诊断为先天性心脏病并在我科接受体外循环心内直视手术的患者共20例。根据术前有无紫绀可分为两组,一组为非紫绀型先心病组(非紫绀组,n=10),另一组为紫绀型先心病组(紫绀组,n=10)。术前安静状态不吸氧1 h以上测四肢血氧饱和度。选取标准:紫绀组,平均血氧饱和度<85%,术中证实为法洛氏四联症。非紫绀组,平均血氧饱和度>95%,术中证实为室间隔缺损合并右心室流出道狭窄。患儿病例资料见表 1。
| (x±s ) | |||||
| 组别 | 男/女 | 手术时年龄 (月) | 射血分数 (%) | 术前血氧饱 和度(%) | 血红蛋白 (g/L) |
| 紫绀组 | 6/4 | 61.5±46.5 | 66.8±6.0 | 61.8±14.5a | 120.0±20.6 |
| 非紫绀组 | 1/9 | 43.2±32.1 | 72.2±4.7 | 97.7±0.9 | 96.3±19.6 |
| a: P<0.05,与非紫绀组比较 | |||||
主要试剂:miR-17-5p 引物(锐博公司)、u6 引物(锐博公司)SYBR Premix Ex Tap Ⅱ(TaKaRa公司)、Primescript RT reagent Kit WITH gDNA Ereaser (Perfect Real Time)(Takara公司),H9c2心肌细胞株(ATCC 美国),DMEM/高糖培养基(Gibco,美国),优质胎牛血清(Gibco,美国),胰酶(Sigma,美国),agomir miR-17-5p(吉玛公司)、antagomir miR-17-5p(吉玛公司)、NC miR-17-5p(吉玛公司)、Lipofectamine_2000(life technology)、Opti-MEM Reduced Serum Medium(life technology)、p-STAT3抗体 (CST),STAT3抗体(CST),c-Myc抗体(CST),HRP标记的IgG(山羊抗兔,CST)、一步法TUNEL细胞凋亡检测试剂盒(红色荧光)(碧云天公司)、Cell Counting Kit-8(CCK-8试剂盒 )(碧云天公司)、PVDF膜(Roche)、Western封闭液(碧云天公司)、BCA蛋白浓度测定试剂盒(碧云天公司)、SDS上样缓冲液(5X)(碧云天公司)、SDS-PAGE凝胶配制试剂盒(碧云天公司)、彩色预染蛋白质分子量标准(碧云天公司)、BeyoECL Plus(碧云天公司)、PMSF(苯甲基磺酰氟)(碧云天公司)。
1.3 方法 1.3.1 标本的采集静脉复合麻醉,正中开胸建立体外循环,取手术中切除的右心室流出道心肌组织作为标本,液氮保存。
1.3.2 检测心肌细胞标本miR-17-5p 的表达情况 (RT-PCR)每个样本(n=20)取心肌组织约100 mg,按照Takara反转录试剂盒、Real-time PCR试剂盒的说明书进行操作,使用ABI 7300 Real-time PCR仪以u6作为内参进行相对定量检测miR-17-5p的表达(miR-17-5p及u6引物从锐博公司购买),反应条件如下:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,72 ℃ 45 s,40个循环。使用比较△△Ct值方法计算相对基因表达水平。每组设置3个复孔,实验重复3次。
1.3.3 检测慢性缺氧的大鼠H9c2心肌细胞miR-17-5p 的表达情况(RT-PCR)①慢性缺氧心肌细胞模型的建立:取出液氮中的细胞冻存管,复苏H9c2心肌细胞,10%胎牛血清加入培养基培养;倒置显微镜下观察购得的细胞生长良好、长满瓶底后,可行传代。倾去培养瓶中的培养液,向100 mL培养瓶中加入约5 mL 37 ℃ 预温的0.25%胰蛋白酶溶液,倒置显微镜下观察到贴壁细胞收缩、细胞间隙变大,细胞由贴壁的多角形变为圆形后,倾去培养瓶中的胰蛋白酶溶液,迅速加入10%小牛血清1640培养基。用吸管反复吹打瓶底,使贴壁细胞悬浮,将悬浮的细胞悬液等量移入4个100 mL 培养瓶中,向每个培养瓶中加入10%小牛血清1640培养基5~10 mL,置于37 ℃、5%CO2培养箱中继续培养。此后,每隔2~3天换液一次。当细胞生长至铺满瓶底80%左右时,用0.25%胰蛋白酶消化分散细胞,进行传代培养。②分组:将H9c2细胞分为对照组和慢性缺氧组(5%CO2及95%N2混合气体),其中慢性缺氧组分为缺氧培养12、24、48、72 h;共分为5组(n=5)。③检测miR-17-5p 的表达:提取H9c2心肌细胞mRNA后按照1.3.2中所述步骤进行RT-PCR实验。每组设置3个复孔,实验重复3次。
1.3.4 miR-17-5p的转染①将H9c2心肌细胞接种于24孔板上,常氧培养24 h,然后按照说明书操作步骤通过Lipofectamine 2000和Opti-MEM培养基分别转染agomir、antagomir 和NC进入H9c2心肌细胞,常氧培养24 h,提取H9c2心肌细胞mRNA按照1.3.2中所述步骤进行RT-PCR试验。每组设置3个复孔,实验重复3次。②分组:H9c2细胞分为agomir组、antagomir组 、空白组和对照组(n=4)。
1.3.5 TUNEL实验将转染后的心肌细胞及空白组常氧培养24 h后(n=4),再缺氧培养48 h,通过TUNEL检测法检测各组心肌细胞的凋亡情况:将4组细胞爬片用4%多基聚甲醛固定30 min,PBS缓冲液洗5 min,加入含0.1%TritonX-100的PBS冰浴孵育2 min,PBS缓冲液冲洗2次×10 min,将TUNEL工作液加入6孔板中37 ℃避光孵育60 min,PBS缓冲液冲洗3次×10 min,DAPI染色液染色10 min,PBS缓冲液冲洗3次×5 min,将爬片取出,抗荧光淬灭剂封片,免疫荧光显微镜下采集图片。用Image-Pro Plus6.0软件随机抽取6个区域分别测定TUNEL荧光数量,DAPI染色细胞核数量,用TUNEL荧光数量/DAPI细胞核数量表示凋亡细胞水平。实验重复3次。
1.3.6 Western blot检测STAT3将转染后的心肌细胞及空白组常氧培养24 h后(n=4),再缺氧培养48 h,将处理好的细胞培养板取出后,加入4 ℃预冷的PBS溶液漂洗3遍,吸尽残留的PBS溶液,加入RIPA裂解液,于冰上裂解,30 min后用细胞刮收集蛋白,然后超速离心后取上清,运用BCA法测定蛋白浓度,并按比例加入SDS-PAGE蛋白上样缓冲液(5×)混匀,煮沸5 min,保存于-20 ℃。取40 μg/孔蛋白上样,8%分离胶进行电泳,将相应分子量的蛋白转移至PVDF膜,BSA封闭2 h,分别与相对应的一抗(p-Tyr-705-STAT3、STAT3、c-myc、β-actin)4 ℃摇床过夜,TBST洗4次,每次5 min。再分别与抗兔的HRP 标记的二抗室温孵育2 h,TBST洗4次,每次5 min,最后使用ECL 化学发光。用灰度值表示蛋白表达量p-Tyr-705-STAT3及其下游调控蛋白c-myc蛋白含量。实验重复3次。
1.3.7 CCK8实验将转染后的心肌细胞及空白组常氧培养12 h后(n=4),再分别接种于4块96孔板,常氧继续培养12 h后,然后通过CCK8试剂检测各组心肌细胞的增殖情况:将大鼠H9C2心肌细胞计数并稀释,取100 μL含2×103个细胞/孔接种于96孔板。置于37 ℃,5% CO2,及95%N2混合气体孵箱中。 按照CCK-8试剂盒说明书分别于缺氧第0、12、24、48 h 以酶标仪测量波长450 nm处吸光度值[D(450)]。每组设置5个复孔,实验重复3次。
1.4 统计学方法所有数据采用统计软件SPSS 13.0分析,数值均采用x±s表示。多组比较采用单因素方差分析法,两两比较用LDS法;两组比较采用t检验。
2 结果 2.1 心肌组织标本的miR-17-5p的表达情况(RT-PCR)RT-PCR检测显示,紫绀组(1.450±0.705)miR-17-5p相对表达量与非紫绀组(0.482±0.163)相比,表达量明显升高(P<0.01)。
2.2 慢性缺氧的大鼠H9c2心肌细胞miR-17-5p的表达情况(RT-PCR)RT-PCR检测显示,缺氧0(0.933±0.115)、12(1.802±0.130)、24(1.973±0.140)、48(2.030±0.134)、72(2.113±0.220) h后,大鼠H9c2心肌细胞miR-17-5p表达逐渐增高,并趋于稳定(P<0.01)。
2.3 转染miR-17-5p的agomir、antagomir后细胞内miRNA-17-5p的水平检测(RT-PCR)转染后将细胞在常温常氧培养箱培养24 h后,用RT-PCR检测细胞内miRNA-17-5p的水平。上调组(19.333±0.577)与对照组(0.876±0.125)和空白组(0.970±0.061)相比,miRNA-17-5p的水平明显增高(P<0.01);下调组(0.397±0.019)与对照组(0.876±0.125)和空白组(0.970±0.061)相比,miRNA-17-5p的水平明显降低(P<0.01)。
2.4 缺氧大鼠H9c2心肌细胞miR-17-5p过表达和抑制对STAT3,p-Tyr-705-STAT3及其下游调控蛋白c-myc的影响(Western blot)miR-17-5p过表达的大鼠H9c2心肌细胞缺氧48 h 后,与对照组及空白组相比,STAT3,p-Tyr-705-STAT3及其下游调控蛋白c-myc的表达下降(P<0.01)(如图 1、表 2);而miR-17-5p抑制的大鼠H9c2心肌细胞缺氧48 h后,与对照组及空白组相比,STAT3,p-Tyr-705-STAT3及其下游调控蛋白c-myc的表达无明显改变(P>0.05)(如图 1、表 2)。
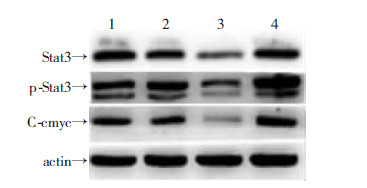 |
| 图 1 缺氧48 h后各组大鼠H9c2心肌细胞中的STAT3、p-Tyr-705-STAT3及C-cmyc表达情况 |
| [n=4,x±s] | |||
| 组别 | STAT3 | p-STAT3 | c-myc |
| 对照组 | 0.624±0.041 | 1.469±0.071 | 0.515±0.061 |
| 下调组 | 0.531±0.051 | 1.621±0.049 | 0.455±0.033 |
| 上调组 | 0.302±0.029 | 0.966±0.045 | 0.254±0.038 |
| 空白组 | 0.546±0.060 | 1.928±0.733 | 0.509±0.051 |
TUNEL实验检测结果显示,缺氧48 h后,和对照组相比,上调组大鼠H9c2心肌细胞明显凋亡增加(P<0.01),而下调组、空白组则无明显差异 (P>0.05)(如图 2)[TUNEL-阳性细胞比值:空白组(0.094 8± 0.0132 86);对照组(0.106 3±0.0109 69);上调组(0.159 9±0.020 16);下调组(0.094 1±0.019 13)]。 CCK8实验检测结果显示,缺氧0、6、24、48 h后,和对照组相比,上调组大鼠H9c2心肌细胞增殖明显减少(P<0.01),而下调组、空白组则无明显差异(P>0.05)(如表 3)。
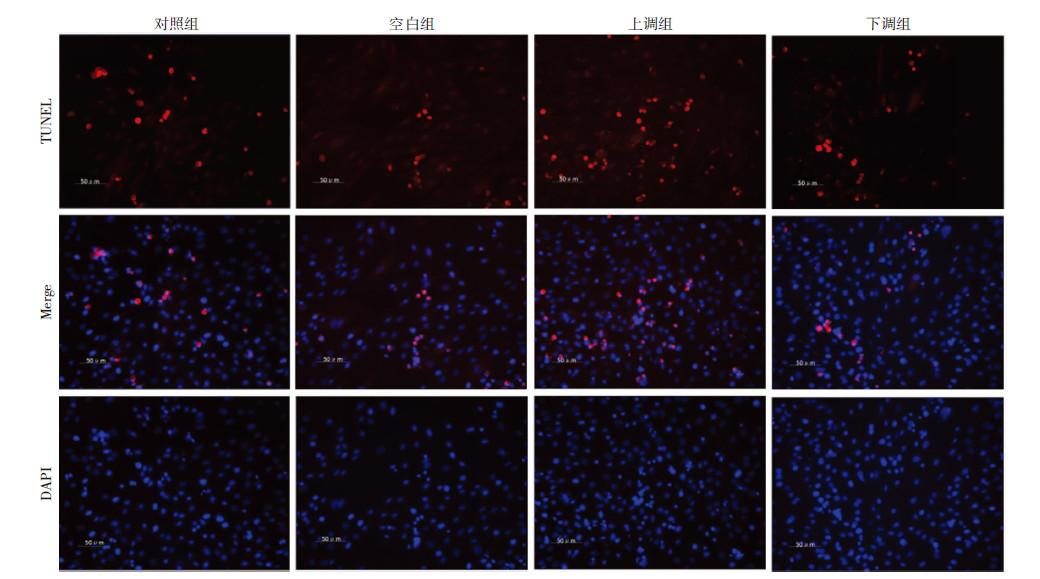 |
| 图 2 缺氧48 h后各组大鼠H9c2心肌细胞的TUNEL检测结果 |
| [D(450),n=4] | ||||
| 组别 | 0 h | 12 h | 24 h | 48 h |
| 上调组 | 0.341±0.016 | 0.403±0.021 | 0.558±0.025 | 0.805±0.031 |
| 下调组 | 0.347±0.007 | 0.392±0.021 | 0.777±0.091 | 0.971±0.085 |
| 空白组 | 0.374±0.010 | 0.474±0.023 | 0.855±0.086 | 0.988±0.161 |
| 对照组 | 0.372±0.007 | 0.524±0.059 | 0.797±0.020 | 1.034±0.087 |
miR-17-92 基因簇为一种典型的含有多顺反子启动子的高度保守的基因簇,位于人染色体13q31.3 处,C13orf25 基因第3个内含子区,其转录前体包含6 个串联的茎环发卡结构,最终可产生miR-17,miR-18,miR-19a,miR-20,miR-19b 和miR-92 等6 个成熟的miRNA。miR-17-92 基因簇在肿瘤发生和肺、心脏、免疫器官的正常发育过程中都起着至关重要的作用[8, 9, 10, 11],同时调节对病原感染的免疫反应[12, 13]。研究发现,缺乏miR-17-92的老鼠因为肺发育不良和室间隔缺损在出生后短时间内死亡[14]。miR-17-5p属于miR-17-92基因簇,定位于人染色体13q31,是一种编码6个miRNA的多顺反子性的miRNA 。许多研究证实,miR-17-5p在许多不同肿瘤亚型中都参与调节肿瘤细胞的增殖与发展[5, 6]。有研究发现,miR-17-5p通过STAT3信号通路来调控骨髓抑制细胞生长(MDSC)[15]。Du[7]等最新研究发现,在心肌缺血再灌注小鼠模型和体外由H2O2诱导的氧化应激小鼠心肌细胞模型中,miR-17-5p表达增高,并通过和STAT3的3′UTR结合,降低STAT3的表达,从而促进心肌细胞凋亡。
慢性缺氧是紫绀型先心病的共同的病理生理基础[16],缺氧心肌细胞是如何完成从细胞信号传导、蛋白合成到代谢的转变[17],维持心肌细胞慢性缺氧代偿性适应,具体机制未完全研究清楚。许多研究显示IL-6-JAK-STAT3信号通路起着至关重要的作用。许多研究显示,IL-6-JAK-STAT3信号通路在心脏病理、生理方面具有保护作用[18]。而特异性过表达的STAT3则促进心脏向心性肥大[19]。之前我们的研究显示,在心肌慢性缺氧过程中,作为STAT3自身诱导调节因子,SOCS3 参与调控的 IL-6/JAK2/STAT3 信号通路及 NF-κB 信号通路的交联作用对慢性缺氧条件下,心肌细胞的存活和功能调节有重要意义。
我们实验发现,在心肌慢性缺氧过程中,人心肌组织及大鼠H9C2心肌细胞中的miR-17-5p表达均增高。之前我们的实验证实,大鼠H9C2心肌细胞慢性缺氧过程中p-Tyr-705-STAT3、 STAT3蛋白表达均随缺氧时间的延长,逐渐升高,后呈稳定表达状态,维持在高水平。本次实验中,我们通过脂质体转染antagomir miR-17-5p 和 agomir miR-17-5p 至H9c2心肌细胞,成功过表达与干扰miR-17-5,发现心肌细胞缺氧过程中,过表达的miR-17-5p明显抑制p-Tyr-705-STAT3、 STAT3蛋白表达,从而抑制心肌细胞的增殖,促进心肌细胞的凋亡。而沉默的miR-17-5p则并不增高p-Tyr-705-STAT3、 STAT3蛋白表达,可能与心肌其他信号通路如SOCS3抑制STAT3有关。
通过本次实验我们推断,慢性缺氧心肌适应的机制中,细胞自我调节的信号稳态可以较好的维持心肌 细胞活性,miR-17-5p表达增高,并通过和STAT3的3′UTR 结合,调控STAT3及p-Tyr-705-STAT3的表达,从而调控STAT3信号通路,对心肌细胞凋亡、能量代谢、细胞重构起重要作用。过表达的miR-17-5p则打破信号平衡稳态,促进心肌凋亡。而沉默的miR-17-5p则并不抑制心肌细胞凋亡,促进心肌细胞增殖。
| [1] | Brand K, Page S, Walli A K, et al.Role of nuclear factor-kappa B in atherogenesis[J]. Exp Physiol, 1997, 82(2): 297-304. |
| [2] | Ren X P, Wu J, Wang X, et al.MicroRNA-320 is involved in the regulation of cardiac ischemia/reperfusion injury by targeting heat-shock protein 20[J]. Circulation, 2009, 119(17): 2357-2366.DOI:10.1161/CIRCULATIONAHA.108.814145 |
| [3] | Wang X, Zhang X, Ren X P, et al.MicroRNA-494 targeting both proapoptotic and antiapoptotic proteins protects against ischemia/reperfusion-induced cardiac injury[J]. Circulation, 2010, 122(13): 1308-1318.DOI:10.1161/CIRCULATIONAHA.110.964684 |
| [4] | Pan Z, Sun X, Ren J, et al.miR-1 exacerbates cardiac ischemia-reperfusion injury in mouse models[J]. PLoS One, 2012, 7(11): e50515.DOI:10.1371/journal.pone.0050515 |
| [5] | Mogilyansky E, Rigoutsos I. The miR-17/92 cluster: a comprehensive update on its genomics, genetics, functions and increasingly important and numerous roles in health and disease[J]. Cell Death Differ, 2013, 20(12): 1603-1614. |
| [6] | Zhou L, Qi R Q, Liu M, et al.MicroRNA miR-17-92 cluster is highly expressed in epidermal Langerhans cells but not required for its development[J]. Genes Immun, 2014, 15(1): 57-61.DOI:10.1038/gene.2013.61 |
| [7] | Du W, Pan Z, Chen X, et al.By targeting Stat3 microRNA-17-5p promotes cardiomyocyte apoptosis in response to ischemia followed by reperfusion[J]. Cell Physiol Biochem, 2014, 34(3): 955-965.DOI:10.1159/000366312 |
| [8] | Baumjohann D, Kageyama R, Clingan J M, et al.The microRNA cluster miR-17/92 promotes TFH cell differentiation and represses subset-inappropriate gene expression[J]. Nat Immunol, 2013, 14(8): 840-848.DOI:10.1038/ni.2642 |
| [9] | Cox M B, Cairns M J, Gandhi K S, et al.MicroRNAs miR-17 and miR-20a inhibit T cell activation genes and are under-expressed in MS whole blood[J]. PLoS One, 2010, 5(8): e12132. |
| [10] | Kang S G, Liu W H, Lu P, et al.MicroRNAs of the miR-17/92 family are critical regulators of T(FH) differentiation[J]. Nat Immunol, 2013, 14(8): 849-857.DOI:10.1038/ni.2648 |
| [11] | Shan S W, Lee D Y, Deng Z, et al.MicroRNA MiR-17 retards tissue growth and represses fibronectin expression[J]. Nat Cell Biol, 2009, 11(8): 1031-1038. |
| [12] | Philippe L, Alsaleh G, Pichot A, et al.MiR-20a regulates ASK1 expression and TLR4-dependent cytokine release in rheumatoid fibroblast-like synoviocytes[J]. Ann Rheum Dis, 2013, 72(6): 1071-1079.DOI:10.1136/annrheumdis-2012-201654 |
| [13] | Poitz D M, Augstein A, Gradehand C, et al. Regulation of the Hif-system by micro-RNA 17 and 20a - role during monocyte-to-macrophage differentiation[J]. Mol Immunol, 2013, 56(4): 442-451.DOI:10.1016/j.molimm.2013.06.014 |
| [14] | Ventura A, Young A G, Winslow M M, et al.Targeted deletion reveals essential and overlapping functions of the miR-17 through 92 family of miRNA clusters[J]. Cell, 2008, 132(5): 875-886. |
| [15] | Zhang M, Liu Q, Mi S, et al.Both miR-17-5p and miR-20a alleviate suppressive potential of myeloid-derived suppressor cells by modulating STAT3 expression[J]. J Immunol, 2011, 186(8): 4716-4724. |
| [16] | Essop M F. Cardiac metabolic adaptations in response to chronic hypoxia[J]. J Physiol, 2007, 584(Pt 3): 715-726. |
| [17] | Heather LC, Cole M A, Tan J J, et al.Metabolic adaptation to chronic hypoxia in cardiac mitochondria[J]. Basic Res Cardiol, 2012, 107(3): 268.DOI:10.1007/s00395-012-0268-2 |
| [18] | Boengler K, Hilfiker-Kleiner D, Drexler H, et al.The myocardial JAK/STAT pathway: from protection to failure[J]. Pharmacol Ther, 2008, 120(2): 172-185.DOI:10.1016/j.pharmthera.2008.08.002 |
| [19] | Osugi T, Oshima Y, Fujio Y, et al.Cardiac-specific activation of signal transducer and activator of transcription 3 promotes vascular formation in the heart[J]. J Biol Chem, 2002, 277(8): 6676-6681. |



