肺炎克雷伯菌(Klebsiella pneumoniae) 为革兰阴性杆菌,近年来常常引起社区获得性感染和院内感染,是一种重要的条件致病菌[1]。其毒力因子主要包括荚膜多糖[2]、脂多糖[3]、菌毛[4]、铁摄入因子[5, 6]等。荚膜多糖是最基本的毒力因子,其在菌体的表面聚集成复合物(荚膜),使细菌具有粘性,在防御机制中可介导细菌逃避或抵抗宿主天然免疫的杀伤。而肺炎克雷伯菌因菌株表面含有丰富的多糖类物质,使细菌具有特有的超粘性表型[7]。荚膜多糖亦在生物膜形成中发挥重要作用[8],生物膜的形成是细菌致病性与产生耐药性的原因之一[9]。在大肠杆菌k-12 中,转录调控子RcsB 是参与荚膜多糖合成必不可少的条件之一[10],本研究通过构建肺炎克雷伯菌rcsB基因缺失的突变株与回补株,分析转录调控子RcsB对肺炎克雷伯菌超粘性和生物膜形成的调控作用,为进一步了解肺炎克雷伯菌的致病机制打下基础。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒肺炎克雷伯菌株NTUH-K2044和质粒pKO3-Km(卡那霉素抗性)[11]均由国立台湾大学馈赠,大肠杆菌DH5α和质粒pBAD33(氯霉素抗性)由本实验室保存。
1.1.2 主要试剂dNTPs、Ex Taq DNA 聚合酶、Pfu DNA 聚合酶、DNA分子量标准物均购自宝生物工程大连有限公司;PCR产物(胶)回收试剂盒为Qiagen公司产品;限制性内切酶NotⅠ、T4 DNA 连接酶、KpnⅠ内切酶、SalⅠ内切酶为New England Biolabs公司产品;其他的生化试剂为国产分析纯。
1.2 方法 1.2.1 构建rcsB 基因缺失的突变株根据菌株NTUH-K2044 的rcsB 基因上下游序列,设计引物(表 1),扩增得到rcsB基因侧翼序列。然后用该产物作为模板,用引物对KP_RcsB_A/D 进行PCR,得到缺失rcsB基因的同源臂融合片段。回收纯化后的同源臂融合片段和质粒pKO3-Km分别用限制性内切酶NotⅠ进行酶切,之后用T4 DNA 连接酶进行连接,连接产物转化到大肠杆菌DH5α 感受态细胞中,取转化产物涂于LB 平板(含50 μg/mL km) 上,30 ℃培养至长出单菌落。PCR筛选重组质粒pKO3-Km-rcsB,重组质粒pKO3-Km-rcsB转化入NTUH-K2044 感受态细胞[12],经过同源重组,PCR鉴定筛选出突变株ΔrcsB。
| 引物名称 | 序列(5′→3′) | 扩增产物 | 长度(bp) |
| KP1_3872_RcsB_A |  |
上游同源臂 | 675 |
| KP1_3872_RcsB_B | CAGCGAGACGGAAGAGAGGTAGTGACTTACGAATACCGAACAG | ||
| KP1_3872_RcsB_C | CTGTTCGGTATTCGTAAGTCACTACCTCTCTTCCGTCTCGCTG | 下游同源臂 | 652 |
| KP1_3872_RcsB_D | 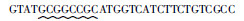 |
||
| KP1_3872_RcsB_RT_F | GCGGCTATGGCGATAAACG | 基因内部序列 | 200 |
| KP1_3872_RcsB_RT_R | GCGAGACGGAAGAGAGGTAG | ||
| KP1-3552-rcsB-HB-KpnI-P-F | TCCGGTACCAGGAGGAATTCACCATGAACACTATGAACGTAATT | rcsB基因序列 | 651 |
| KP1-3552-rcsB-HB-SalI-P-R | 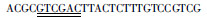 |
||
| 波浪线标记的碱基为限制性内切酶 NotⅠ的酶切位点,单下划线标记的碱基为限制性内切酶 KpnⅠ的酶切位点,双下划线标记的碱基为限制性内切酶SalⅠ的酶切位点 | |||
根据肺炎克雷伯菌株NTUH-K2044 的rcsB基因序列设计引物(表 1),PCR扩增得到rcsB基因片段,利用限制性内切酶KpnⅠ和SalⅠ对rcsB基因片段和质粒pBAD33分别进行双酶切。将酶切后的基因片段和质粒以适当比例混合,用 T4 DNA 连接酶连接,连接产物转化到大肠杆菌 DH5α 感受态细胞中,涂布于 LB 平板(含 35 μg/mL Cm),37 ℃培养至长出单菌落。PCR 筛选含有重组质粒pBAD33-rcsB的转化子,再将重组质粒pBAD33-rcsB 转入突变株ΔrcsB 的感受态细胞,37 ℃培养至长出单菌落。PCR 筛选出含有重组质粒的菌株,即为回补株C-ΔrcsB。
1.2.3 粘度实验肺炎克雷伯菌菌株表面含有丰富的多糖类物质,它赋予了细菌具有超粘性表型,保护细菌免受宿主的免疫系统攻击。超粘性表型是肺炎克雷伯菌特有表型。根据超粘性的强弱可以初步推测菌株毒力强弱[13]。
1.2.3.1 沉淀离心实验用接种环挑取单菌落接种在LB肉汤中(回补株菌体培养时加入 1.5% 阿拉伯糖诱导),37 ℃、200 r/min振荡培养至OD600为2.0 左右。收集菌体,5 200 r/min离心15 min后观察上层液体的透明度,之后取上层液体测OD600[2, 7]。
1.2.3.2 超粘性实验在5%绵羊血平板上划线,37 ℃培养16 h,用接种环可以使血平板上单菌落拉丝长度>5 mm,判定为超粘性阳性菌株。否则为超粘性阴性菌株[7, 13]。
1.2.4 荚膜染色观察荚膜是肺炎克雷伯菌新陈代谢所产生的细胞外物质,主要成分为多糖,荚膜多糖是使细菌具有超粘性的主要物质。因荚膜折射率低,对染料亲和力低,不易着色,常用Anthony荚膜染色法染色。培养的菌液制成涂片后在空气中干燥,用1%的结晶紫水溶液染色1 min,以20%的硫酸铜水溶液冲洗,可以使背景及菌体呈色而荚膜无色[14]。
1.2.5 生物膜表型实验将细菌接种于5 mL LB 肉汤,37 ℃ 200 r/min培养至OD600=1.0左右,将菌液50倍稀释至LB肉汤中,再分装至小试管中,每管2 mL。按 37 ℃ 150 r/min培养12、24、36 h ,每个时间点每株菌设置3个重复。
将菌液转移至5 mL试管中,吹打混匀,测定OD600。试管用2 mL去离子水洗3次,洗去游离菌体,然后加入3 mL 0.1%结晶紫溶液,染色30 min。弃去结晶紫,用3 mL去离子水洗试管5次。待试管干燥后,拍照染色后的生物膜。
2 结 果 2.1 突变株的构建PCR筛选鉴定rcsB基因突变株。用KP1_3872_RcsB_A/D 作为引物对,以突变株基因组 DNA 作为模板时,PCR 扩增得到1 282 bp 片段(图 1,泳道2),比以野生株为模板时的 PCR 片段1 867 bp (泳道4)缺少了长度为585 bp 的rcsB基因片段。用rcsB基因片段上的引物对KP1_3872_RcsB_RT_F/R扩增时,突变株应无扩增引物(泳道5),而以野生株为阳性对照可得到大小为200 bp的片段(泳道7)。由图 1可见,电泳结果与理论值相符合,表明突变株ΔrcsB 构建成功。
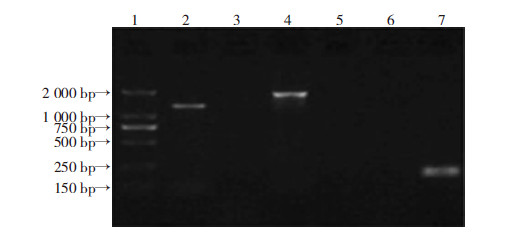 |
| 1:DNA标志物DL 2000; 2:以突变株ΔrcsB为模板,以KP1_3872_RcsB_A/D为引物对的PCR产物; 4:以野生株为模板,以KP1_3872_RcsB_A/D为引物对的PCR产物; 5:以突变株ΔrcsB为模板,以KP1_3872_RcsB_RT_F/R为引物对的PCR产物; 7:以野生株为模板,以KP1_3872_RcsB_RT_F/R为引物对的PCR产物; 3、6:阴性对照 图 1 PCR鉴定突变株ΔrcsB的电泳图 |
PCR鉴定回补株C-ΔrcsB,用KP1_3552_rcsB_HB_KpnI_P_F和KP1_3552_rcsB_HB_SalI_P_R 作为引物对,以回补株基因组 DNA 作为模板时,PCR 扩增得到 651 bp 片段(图 2,泳道2),与以野生株为模板时的 PCR 片段651 bp(泳道3)一样。由图 2可见,电泳结果与理论值相符合,表明回补株C-ΔrcsB 构建成功。
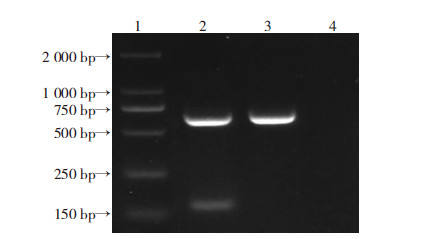 |
| 1:DNA标志物DL 2000; 2:以回补株C-ΔrcsB为模板,以KP1-3552-rcsB-HB-KpnⅠ-P-F和KP1-3552-rcsB-HB-SalⅠ-P-R为引物对的PCR产物; 3:以野生株为模板,以KP1-3552-rcsB-HB-KpnⅠ-P-F和KP1-3552-rcsB-HB-SalⅠ-P-R为引物对的PCR产物; 4:阴性对照 图 2 PCR鉴定回补株C-ΔrcsB的电泳图 |
与野生株相比,突变株ΔrcsB菌体更容易离心沉淀下来,上层液体更清亮,回补株介于两者之间(图 3)。 取上层液体测定D(600),突变株D(600)=0.045,野生株D(600)=1.427,回补株D(600)=0.874,进一步表明突变株的粘度减弱,从而菌体更容易离心沉淀。回补株因携带了表达rcsB基因的质粒,其粘度表型得到了部分恢复。
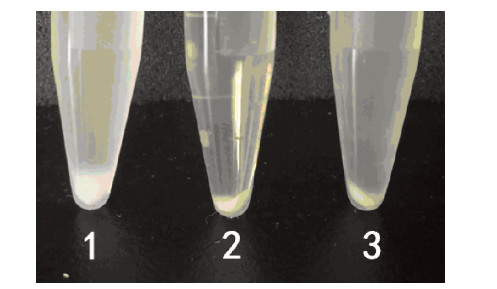 |
| 1:野生株; 2:突变株ΔrcsB; 3:回补株C-ΔrcsB 图 3 离心沉淀结果 |
取野生株、突变株和回补株的典型菌落,同时在5%绵羊血平板上划线,37 ℃培养16 h后,用接种环对血平板上的单菌落进行拉丝实验。结果如图 4所示,可见野生株和回补株C-ΔrcsB拉丝长度均>5 mm,突变株ΔrcsB拉丝长度<5 mm,表明突变株ΔrcsB 超粘性减弱。据此可以初步推测突变株毒力减弱。
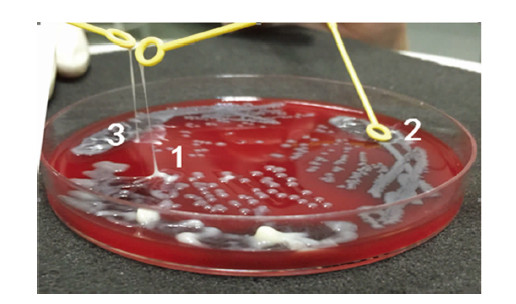 |
| 1:野生株; 2:突变株ΔrcsB; 3:回补株C-ΔrcsB 图 4 超粘性实验结果 |
荚膜经Anthony荚膜染色法染色后在显微镜(100倍油镜)下观察,结果如图 5,从图中可以看出野生株、突变株ΔrcsB、回补株C-ΔrcsB荚膜在形态学上没有明显差异。
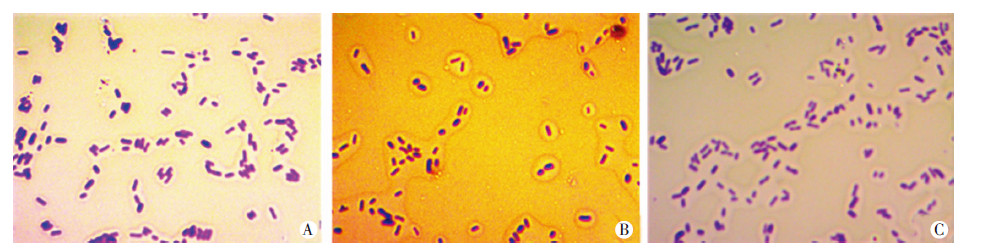 |
| A:野生株; B:突变株ΔrcsB; C:回补株C-ΔrcsB 图 5 荚膜染色镜检 |
用玻璃试管培养菌体,具有生物膜形成能力的菌株可在固体介质表面形成生物膜,通过结晶紫染色法可测定生物膜形成能力。以 12、24、36 h 为3个时间点,测定生物膜形成量,每株菌每个时间点 3 个重复。以野生株为对照,观察突变株和回补株的生物膜形成量,结果见图 6从图中可以看出突变株的生物膜形成能力明显比野生株弱,回补株介于两者之间。
 |
| 1:野生株; 2:突变株ΔrcsB; 3:回补株C-ΔrcsB 图 6 结晶紫染色法测定生物膜形成量 |
肺炎克雷伯菌是临床上引起医源性感染的重要条件致病菌之一,能引起肺炎、菌血症以及尿路感染等病症,严重时危及人的生命[15]。荚膜多糖是其最基本的毒力因子,它能够促进细菌与细胞表面或细菌之间的粘附,进而使细菌粘度增加,同时也促进生物膜的形成[16]。本文研究结果表明rcsB可能参与肺炎克雷伯 菌荚膜多糖的调控。沉淀离心实验结果显示rcsB基因缺失株与野生株相比,粘度降低,使细菌更容易离心沉淀,说明在rcsB基因缺失的条件下荚膜多糖可能发 生改变;rcsB基因回补后,粘度加强,荚膜多糖合成能力得到恢复。超粘性实验中,突变株拉丝长度明显<5 mm,基因回补后,拉丝长度>5 mm,其超粘性得到恢复。而超粘性与菌株的毒力又是正相关的,据此我们也可以初步推测rcsB基因缺失株毒力可能减弱。进一步将荚膜染色后镜检发现野生株、突变株ΔrcsB、回补株C-ΔrcsB荚膜在形态学上没有看到明显差异。推测突变株ΔrcsB粘性发生改变可能不是荚膜多糖数量上的改变,而是荚膜多糖的成分或结构发生了变化。在生物膜表型实验中,rcsB基因缺失株生物膜形成能力明显减弱,基因回补后,生物膜形成能力也得到恢复,这说明rcsB可能参与生物膜形成能力的调控。
综上所述,rcsB基因可能参与调控肺炎克雷伯菌荚膜多糖的合成和生物膜的形成从而影响其毒力。深入研究rcsB在肺炎克雷伯菌毒力和生物膜形成中的作用,对防治肺炎克雷伯菌感染具有重要的理论研究意义。
| [1] | Keynan Y, Rubinstein E. The changing face of Klebsiella pneumoniae infections in the community[J]. Int J Antimicrob Agents, 2007, 30(5): 385-389.DOI:10.1016/j.ijantimicag.2007.06.019 |
| [2] | Chuang Y P, Fang C T, Lai S Y, et al.Genetic determinants of capsular serotype K1 of Klebsiella pneumoniae causing primary pyogenic liver abscess[J]. J Infect Dis, 2006, 193(5): 645-654.DOI:10.1086/499968 |
| [3] | Cortes G, Borrell N, de-Astorza B, et al.Molecular analysis of the contribution of the capsular polysaccharide and the lipopolysaccharide O side chain to the virulence of Klebsiella pneumoniae in a murine model of pneumonia[J]. Infect Immun, 2002, 70(5): 2583-2590. |
| [4] | Struve C, Bojer M, Krogfelt K A. Identification of a conserved chromosomal region encoding Klebsiella pneumoniae type 1 and type 3 fimbriae and assessment of the role of fimbriae in pathogenicity[J]. Infect Immun, 2009, 77(11): 5016-5024.DOI:10.1128/IAI.00585-09 |
| [5] | Hsieh P F, Lin T L, Lee C Z, et al.Serum-induced iron-acquisition systems and TonB contribute to virulence in Klebsiella pneumoniae causing primary pyogenic liver abscess[J]. J Infect Dis, 2008, 197(12): 1717-1727. |
| [6] | Ma L C, Fang C T, Lee C Z, et al.Genomic heterogeneity in Klebsiella pneumoniae strains is associated with primary pyogenic liver abscess and metastatic infection[J]. J Infect Dis, 2005, 192(1): 117-128. |
| [7] | Fang C T, Chuang Y P, Shun C T, et al.A novel virulence gene in Klebsiella pneumoniae strains causing primary liver abscess and septic metastatic complications[J]. J Exp Med, 2004, 199(5): 697-705. |
| [8] | Wu M C, Lin T L, Hsieh P F, et al.Isolation of genes involved in biofilm formation of a Klebsiella pneumoniae strain causing pyogenic liver abscess[J]. PLoS One, 2011, 6(8): e23500.DOI:10.1371/journal.pone.0023500 |
| [9] | Podschun R, Ullmann U. Klebsiella spp. as nosocomial pathogens: epidemiology, taxonomy, typing methods, and pathogenicity factors[J]. Clin Microbiol Rev, 1998, 11(4): 589-603. |
| [10] | Brill J A, Quinlan-Walshe C, Gottesman S. Fine-structure mapping and identification of two regulators of capsule synthesis in Escherichia coli K-12[J]. J Bacteriol, 1988, 170(6): 2599-2611. |
| [11] | Pan Y J, Fang H C, Yang H C, et al.Capsular polysaccharide synthesis regions in Klebsiella pneumoniae serotype K57 and a new capsular serotype[J]. J Clin Microbiol, 2008, 46(7): 2231-2240.DOI:10.1128/JCM.01716-07 |
| [12] | 郑艳, 刘喜朋,刘建华. 外源载体高效转化肺炎克雷伯菌的新途径[J]. 微生物学报, 2007, 47(4): 721-724. |
| [13] | Lin Y C, Lu M C, Tang H L, et al.Assessment of hypermucoviscosity as a virulence factor for experimental Klebsiella pneumoniae infections: comparative virulence analysis with hypermucoviscosity-negative strain[J]. BMC Microbiol, 2011, 11: 50.DOI:10.1186/1471-2180-11-50 |
| [14] | 凌云, 肖智杰, 连宾. 胶质芽孢杆菌荚膜染色方法的比较与改进[J]. 南京师大学报:自然科学版, 2007, 30(4): 84-88. |
| [15] | Cheng H Y, Chen Y S, Wu C Y, et al.RmpA regulation of capsular polysaccharide biosynthesis in Klebsiella pneumoniae CG43[J]. J Bacteriol, 2010, 192(12): 3144-3158.DOI:10.1128/JB.00031-10 |
| [16] | Costerton J W, Cheng K J, Geesey G G, et al.Bacterial biofilms in nature and disease[J]. Annu Rev Microbiol, 1987, 41: 435-464. |



