吉祥草为百合科吉祥草属植物Reineckia carnea (Andr.) Kunth的干燥的全草,又名观音草、玉带草、小叶万年青等,具有清肺止咳、凉血止血、解毒利咽的功效,民间主要用于肺热咳嗽、咯血、吐血、衄血、便血、咽喉肿痛、目赤翳障痈肿疮疖等[1]。研究表明吉祥草的化学成分主要含有甾体皂苷类、萜类、黄酮类,此外还含有一些微量元素、脂肪酸、生物碱等成分[2]。我们前期研究发现其乙酸乙酯部位和其中甾体皂苷RCE-4均具有良好的人宫颈癌Caski细胞增殖抑制活性,初步证实线粒体途径可能是其诱导Caski细胞凋亡的重要途径之一[3]。本研究拟在此基础上通过裸鼠宫颈癌Caski移植瘤模型,观察RCE-4对裸鼠Caski细胞移植瘤的抑制作用,并探寻其可能的机制,以期为其用于宫颈癌的临床治疗提供实验依据。
1 材料与方法 1.1 材料与试剂人宫颈癌Caski细胞株由三峡大学肿瘤微环境与免疫治疗湖北省重点实验室王艳林教授惠赠。雌性BALB/c-nu 裸鼠30只,6~8周龄,体质量20~22 g,由北京维通利华实验动物有限公司提供,生产许可证号:SCXK(京)2012-0001。吉祥草药材采自湖北省长阳土家族自治县乐园乡,经三峡大学生物与制药学院杨进副教授鉴定为Reineckia carnea (Andr.) Kunth。RPMI1640(Gibco公司),胎牛血清(四季青公司),HEPES、胰蛋白酶(Amresco公司),TUNEL试剂盒(Roche公司),Bcl-2、Bax、Caspase-9、Caspase-3和GAPDH(上海生工公司,表 1),COX-2和Survivin一抗(Cell Signaling公司),β-actin抗体(博奥森公司),羊抗兔二抗(中杉金桥公司),蛋白抽提试剂盒、ECL发光试剂盒、蛋白含量测定试剂盒(碧云天公司),其余试剂为市售分析纯。
| 基因 | 引物序列 | 片段长度(bp) |
| Bcl-2 | 上游 5′-TGTGGCCTTCTTTGAGTTCG-3′ 下游 5′-TCACTTGTGGCTCAGATAGG-3′ | 280 |
| Bax | 上游 5′-GCGTCCACCAAGAAGCTGAG-3′ 下游 5′-ACCACCCTGGTCTTGGATCC-3′ | 311 |
| Caspase-3 | 上游 5′-TTTGTTTGTGTGCTTCTGAGCC-3′ 下游 5′-GATGTTCTGGAGAGCCCCG-3′ | 400 |
| Caspase-9 | 上游 5′-CCCACACAGATGCTGTTTACCAT-3′ 下游 5′-GCACAACAAAGCACTTCATCCTC-3′ | 153 |
| GAPDH | 上游 5′-GGGAGCCAAAAGGGTCATCTC-3′ 下游 5′-CCATGCCAGTGAGCTTCCGTTC-3′ | 353 |
将干燥的吉祥草根茎切成小段,用95%乙醇在65 ℃回流提取3次,每次2 h,将3次的提取液合并,回收乙醇,得深棕色浸膏,然后加入适量蒸馏水,混悬至浸膏完全溶解。依次用石油醚、乙酸乙酯、水饱和的正丁醇萃取,回收萃取液,得石油醚部位、乙酸乙酯部位和正丁醇。然后取乙酸乙酯部位浸膏硅胶柱层析,采用氯仿-甲醇=15 ∶1梯度洗脱,经甲醇重结晶即得。
1.3 模型的制备及给药取对数生长的Caski细胞,PBS稀释,制成4×107/mL的细胞悬液。裸鼠局部皮肤消毒后,将细胞悬液0.3 mL注射于裸鼠右侧后腿背部皮下。待肿瘤体积达到100~200 mm3后,将造模成功的动物按瘤体积大小分为5组:模型组(灌胃给予0.5%羧甲基纤维素钠溶液)、紫杉醇(皮下注射10 mg/kg)和RCE-4(灌胃给予25、50、100 mg/kg)组,1次/d,连续4周。
1.4 观察裸鼠成瘤情况及一般状态每天观察裸鼠的精神状态、活动力、进食量、饮水量、肿瘤生长情况、大便形态等。每3天测量1次裸鼠 体质量、饮食量、饮水量。分组后第2天开始测量各组移植瘤的长度(L)和宽度(W),每3天测量1次,肿瘤体积(V)=(L×W2)/2。以观测时间(d)作为横轴,瘤体积的均值(mm3)为纵轴绘制移植瘤生长曲线[4]。
1.5 称量瘤质量和计算抑瘤率末次给药的次日颈椎脱臼法处理裸鼠,将肿瘤完 整剥离,称量各组肿瘤质量,按照公式计算抑瘤率:抑瘤率= [1-(治疗组瘤质量/模型组瘤质量)]×100%。
1.6 肿瘤组织形态学观察剥取肿瘤组织后,取2 mm×2 mm肿瘤组织用4%多聚甲醛溶液固定,石蜡包埋,切片,HE染色,在光学显微镜下观察肿瘤组织形态学变化。
1.7 TUNEL检测肿瘤组织细胞凋亡取肿瘤组织切片经脱蜡后,滴加蛋白酶K(20 μg/mL),室温放置20 min,PBS洗涤3次,然后滴加TUNEL反应液(酶液:标记液=1:9),37 ℃孵育1 h,PBS洗涤3次后,滴加POD液,37 ℃再次孵育30 min。PBS洗涤3次,DAB显色(90 s),苏木精复染5 min,中性树脂封片。在低倍镜下选取细胞均匀分布的视野,然后在高倍镜下随机选取0.04 mm2的10个视野计算肿瘤组织中阳性细胞数[5]。
1.8 免疫组化检测肿瘤组织中COX-2表达取肿瘤组织切片常规脱蜡至水后,将整个架子放入枸橼酸盐缓冲液中,微波炉加热至沸腾后断电,间隔5~10 min,反复1~2次,室温自然冷却后用PBS洗3遍,每次洗完静置5 min,擦干。滴加3% H2O2,以液体覆盖整个组织为准,室温5~10 min,以灭火内源性酶。PBS洗3遍,每次洗完静置5 min,擦干。滴加5% BSA封闭液,室温20 min,甩去多余的水,不洗。滴加适当稀释的一抗,4 ℃过夜,PBS洗3遍,每次洗完静置5 min,擦干。滴加二抗,室温放置30 min。PBS洗3遍,每次洗完静置5 min,擦干。滴加SABC,室温放置30 min,PBS洗3遍,每次洗完静置5 min,擦干。DAB显色(1~2 min),苏木精复染5 min,中性树脂封片,然后在光学显微镜下采用半定量积分综合计量法分析各个实验组移植瘤细胞中COX-2的蛋白表达。具体方法依照李龙等[6]报道进行。
1.9 实时定量PCR检测肿瘤组织中Bcl-2、Bax、Caspase-3和Caspase-9 mRNA表达按照RNA提取试剂盒说明书,提取肿瘤组织RNA,反转录为cDNA。在反应管中加入SYBR Premix Ex TaqTM Ⅱ(2X)12.5 μL,10 μmol/L PCR上游引物r和PCR 10 μmol/L下游引物r各1 μL,cDNA模板2 μL,灭菌蒸馏水8.5 μL,最终反应体系为25 μL。 将样品放入实时定量PCR扩增仪中按95 ℃预变性30 s、95 ℃变性5 s、退火30 s、72 ℃延伸20 s条件扩增30次。利用PCR仪汇出扩增曲线,进行结果分析。
1.10 Western blot检测肿瘤组织中Survivin蛋白表达按照蛋白质提取试剂盒说明书,提取肿瘤组织蛋白,进行蛋白定量后,加样品缓冲液煮沸5 min,各取20 μL加样;10%聚丙烯酰胺凝胶,在120 V、28 mA条件下电泳1.5 h;100 mA条件下PVDF膜转膜3 h;5%脱脂牛奶封闭,滴加Survivin一抗(1 ∶200),4 ℃过夜;用含0.1% Tween 20的TBS冲洗5 min×3次,再加二抗(1 ∶1 000)室温下孵育2 h,用0.1% TBST冲洗15 min×3次,ECL发光检测,X线片显影,扫描图像,测得各条带的灰度值,以β-actin为内对照标准化后,比较其表达量的变化。
1.11 统计学分析采用SPSS 19.0统计软件,计量资料以x±s表示,组间比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 RCE-4的结构鉴定RCE-4波谱数据:1H-NMR(400 MHz,C5D5N)δ 0.85(3 H,s,H-18),1.34(3 H,s,H-19),1.15(3 H,s,H-21),1.08 (3 H,d,J=6.5 Hz,H-27),1.76 (3 H,d,J=6.1 Hz,CH3-Rha),6.63(1 H,s),5.11(1 H,d,J= 7.3 Hz);13C-NMR (100 MHz,C5D5N)δ:75.9(C-1),27.3(C-2),67.3(C-3),34.2(C-4),31.8(C-5),26.4(C-6),26.4(C-7),35.6(C-8),42.0(C-9),39.4(C-10),21.4(C-11),40.3(C-12),40.7(C-13),56.4(C-14),32.2(C-15),81.3(C-16),62.9(C-17),16.7(C-18),19.4C-19),42.5(C-20),14.9(C-21),109.7(C-22),26.3(C-23),26.2(C-24),27.3(C-25),65.1(C-26),16.3(C-27),98.1(xyl,C-1),76.9(xyl,C-2),79.2 (xyl,C-3),71.6(xyl,C-4),67.4(xyl,C-5),101.9(rha,C-1),72.0(rha,C-2),72.2(rha,C-3),74.5(rha,C-4),69.9(rha,C-5),18.8 (rha,C-6)。该化合物为无色针状结晶,分子式C38H62O12,鉴定该化合物为(1β,3β,5β,25S)-螺甾烷-1,3-二醇1-[α-L-鼠李糖-(1→2)-β-D-木吡喃糖苷](图 1,简称RCE-4)。
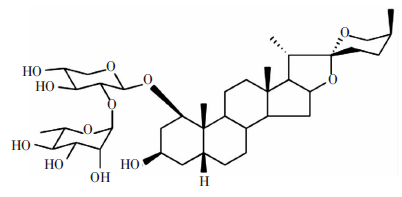 |
| 图 1 RCE-4的化学结构 |
Caski细胞接种裸鼠8 d后,裸鼠右侧后腿背部出现黄豆大小的移植瘤,20只裸鼠全部成瘤,用药前各组间平均肿瘤体积大小差异无统计学意义(P>0.05),提示宫颈癌肿瘤模型成功,9 d起开始给药。实验期间各组裸鼠精神状态良好,每天的进食、饮水及二便均正常。
2.3 RCE-4对宫颈癌裸鼠移植瘤生长的影响治疗期间,测量移植瘤大小,计算瘤体积,绘制移植瘤生长曲线图(图 2)。各实验组裸鼠移植瘤的体积均随着时间延长有不同程度的增大;模型组的增长速度明显快于紫杉醇和RCE-4治疗组;各治疗组无论是自身前后比较还是与同时间的模型组比较,差异均有统计学意义(P<0.05,P<0.01),而且RCE-4给药组呈现出较好的量效关系。
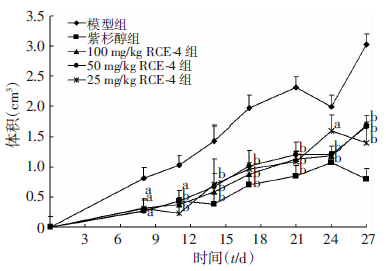 |
| a:P<0.05, b:P<0.01,与同时间点模型组比较图 2 各组宫颈癌裸鼠移植瘤生长情况 |
模型组裸鼠移植瘤体积和肿瘤质量最大,用紫杉醇(10 mg/kg)和RCE-4(25、50、100 mg/kg)治疗后,瘤质量均出现了明显的减小,与模型组比较具有统计学差异(P<0.01,表 2、图 3)。
| (n=6) | |||
| 组别 | 瘤体积(cm3,x±s ) | 瘤质量(g,x±s ) | 抑瘤率(%) |
| 模型组 | 3.25±2.40 | 3.011±0.171 | - |
| 10 mg/kg紫杉醇组 | 0.51±0.36 | 0.585±0.093a | 80.57 |
| 25 mg/kg RCE-4组 | 1.72±1.51 | 1.939±0.253a | 35.60 |
| 50 mg/kg RCE-4组 | 1.13±0.80 | 1.434±0.545a | 52.37 |
| 100 mg/kg RCE-4组 | 0.80±0.07 | 0.934±0.602a | 68.98 |
| a:P<0.01,与模型组比较 | |||
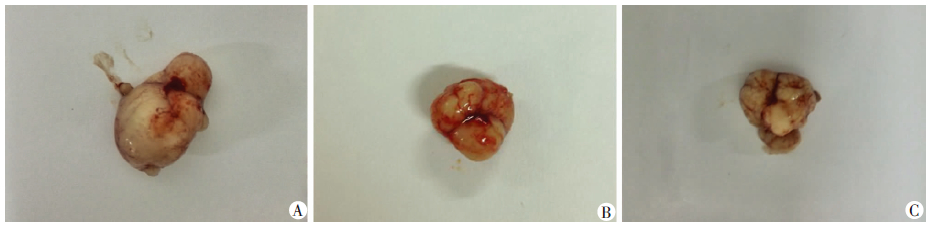 |
| A:模型组;B:紫杉醇组;C: 100 mg/kg RCE-4组图 3 各组宫颈癌裸鼠移植瘤大小观察 |
HE染色观察显示,模型组裸鼠移植瘤组织中肿瘤细胞生长迅速,染色质增多,核体积明显增大,呈2个或多个,核仁轮廓清晰;用紫杉醇(10 mg/kg)和RCE-4 (25、50、100 mg/kg)治疗后,可见肿瘤细胞皱缩,细胞质浓缩,细胞核染色质向边缘聚集,并伴随有成片的红染坏死区域,而且随RCE-4剂量的增加,其作用效果更为明显(图 4)。
 |
| A: 模型组;B: 紫杉醇组;C: 100 mg/kg RCE-4组图 4 各组宫颈癌裸鼠移植瘤组织形态学观察 (HE ×400) |
紫杉醇组和RCE-4组(25、50、100 mg/kg)裸鼠移植瘤细胞凋亡率分别为、(70.33±5.69)%、(26.17±7.38)%、(49.77±4.82)%、(61.06±6.36)%,与模型组(15.96±4.57)%比较差异有统计学意义(P<0.05,P<0.01),且随RCE-4剂量的增加,其作用效果更为明显。由图 5可见,凋亡细胞主要表现为细胞核固缩成均一致密物,呈棕黄色。模型组阳性反应区域较少,多呈蓝色;用紫杉醇(10 mg/kg)和RCE-4 (25、50、100 mg/kg)和治疗后,可见凋亡细胞明显增多,且随着RCE-4剂量的增加,其作用效果更为明显。
 |
| A: 模型组;B: 紫杉醇组;C: 100 mg/kg RCE-4组;箭头示凋亡细胞图 5 各组宫颈癌裸鼠移植瘤组织细胞凋亡观察 (TUNEL×400) |
COX-2蛋白表达为细胞质呈棕黄色颗粒,紫杉醇组(0.33±0.52)和RCE-4 (25、50、100 mg/kg)组(分别为1.00±0.89、0.67±0.82、0.50±0.55)COX-2蛋白表达量明显减少,与模型组(2.50±0.55)比较差异有统计学意义(P<0.05、P<0.01,图 6)。
 |
| A: 模型组;B: 紫杉醇组;C: 100 mg/kg RCE-4组;箭头示COX-2蛋白表达图 6 RCE-4对宫颈癌裸鼠移植瘤组织中COX-2蛋白表达的影响 (×400) |
由表 3可知,模型组裸鼠移植瘤组织中Bcl-2 mRNA 表达水平明显增加,Bax mRNA表达水平明显降低;用紫杉醇(10 mg/kg)和RCE-4 (25、50、100 mg/kg)治疗后,Bcl-2 mRNA表达和Bcl-2/Bax值明显降低,Bax mRNA表达明显升高,与模型组比较差异有统计学意义(P<0.05,P<0.01),而且其改善作用随剂量的增加而增强。
| (n=4,x±s) | |||
| 组别 | Bcl-2/GAPDH | Bax/GAPDH | Bcl-2/Bax |
| 模型组 | 0.657±0.036 | 0.367±0.034 | 1.794±0.072 |
| 10 mg/kg紫杉醇组 | 0.327±0.040b | 0.634±0.045b | 0.514±0.032b |
| 25 mg/kg RCE-4组 | 0.502±0.064a | 0.496±0.053a | 1.010±0.046b |
| 50 mg/kg RCE-4组 | 0.427±0.033b | 0.574±0.065b | 0.746±0.033b |
| 100 mg/kg RCE-4组 | 0.379±0.032b | 0.611±0.073b | 0.622±0.031b |
| a:P<0.05, b:P<0.01,与模型组比较 | |||
由表 4可见,模型组裸鼠移植瘤组织中Caspase-3、Caspase-9 mRNA表达水平明显降低;用紫杉醇(10 mg/kg) 和RCE-4 (25、50、100 mg/kg)治疗后,上述异常表达得到有效的逆转,与模型组比较差异有统计学意义(P<0.05,P<0.01),且随RCE-4剂量的增加,其作用效果更为明显。
| (x±s,n=4) | ||
| 组别 | Caspase-3/GAPDH | Caspase-9/GAPDH |
| 模型组 | 0.408±0.060 | 0.360±0.054 |
| 10 mg/kg紫杉醇组 | 0.702±0.076b | 0.622±0.064b |
| 25 mg/kg RCE-4组 | 0.552±0.103a | 0.468±0.072a |
| 50 mg/kg RCE-4组 | 0.618±0.062b | 0.538±0.094b |
| 100 mg/kg RCE-4组 | 0.656±0.052b | 0.561±0.043b |
| a:P<0.05, b:P<0.01,与模型组比较 | ||
由图 7可见,模型组裸鼠移植瘤组织中Survivin蛋白表达水平明显升高;用紫杉醇(10 mg/kg) 和RCE-4 (25、50、100 mg/kg)治疗后,Survivin蛋白表达水平明显降低,与模型组比较差异有统计学意义(P<0.05,P<0.01),且随RCE-4剂量的增加,其作用效果更为明显。
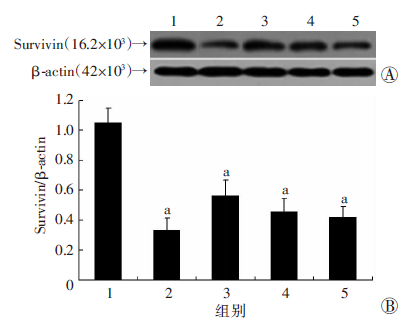 |
| A:移植瘤组织Survivin蛋白表达;B:半定量分析;1:模型组,2:紫杉醇组,3:25 mg/kg RCE-4组,4:50 mg/kg RCE-4组,5:100 mg/kg RCE-4组;a:P<0.01,与模型组比较图 7 Western blot检测各组宫颈癌裸鼠移植瘤组织中Survivin蛋白表 |
本实验用Caski细胞皮下移植建立宫颈癌移植瘤模型,发现模型组肿瘤生长迅速,肿瘤组织中COX-2、Bcl-2、Survivin表达水平明显增加,Bax、Caspase-3、Caspase-9表达水平明显降低;用紫杉醇和RCE-4治疗后,可显著抑制移植瘤的生长和逆转移植瘤组织中COX-2、Survivin、Bcl-2、Bax、Caspase-3、Caspase-9的异常表达。表明RCE-4对宫颈癌裸鼠移植瘤的生长具有显著抑制作用。
近年靶向Survivin成为肿瘤防治的重要措施之一[7, 8]。本实验中模型组移植瘤组织中Survivin蛋白表达水平明显升高;用紫杉醇和RCE-4治疗后,其表达水平明显降低,实验结果与Chen等[9]的报道一致。作为细胞凋亡通路的重要靶标之一,Survivin需要和下游的多种信号通路相结合,组成系列完整的信号网络来实现调控细胞凋亡的进程,比如:死亡受体、线粒体途径,细胞周期蛋白等[8]。
作为细胞凋亡信号通路的重要靶蛋白Bcl-2家族,其Bcl-2、Bcl-x等抗凋亡蛋白和Bax、Bad等促凋亡蛋白组成上游与Survivin衔接的信号通络,掌控着细胞的命运;而Caspase蛋白激酶家族则在细胞凋亡通路的下游发挥调控作用,它们组成Survivin-Bcl-2 家族-Caspase蛋白激酶家族信号调节通路,调控细胞凋亡的进程[10]。当Survivin介导的Bcl-2家族的抗凋亡蛋白和凋亡蛋白平衡体系被打破后,Bcl-2、Bax等表达及Bcl-2/Bax值将出现异常变化,其结果是线粒体膜通透性改变,使得细胞质中细胞色素C、凋亡蛋白酶活化因子-1的表达异常,进而使得Caspase-9、Caspase-3等出现异常表达,导致细胞凋亡紊乱[11, 12]。本研究发现,宫颈癌裸鼠移植瘤组织中Bcl-2表达水平明显增加,Bax、Caspase-3、Caspase-9表达水平明显降低;用紫杉醇和RCE-4治疗后,与模型组比较可显著降低Bcl-2 mRNA表达水平,升高Bax、Caspase-3、Caspase-9 mRNA 表达水平及降低Bcl-2/Bax值;本结果与其降低宫颈癌裸鼠移植瘤体积和瘤质量、肿瘤组织形态学分析和TUNEL法分析细胞凋亡的结果一致。本研究表明,抑制Bcl-2 家族和Caspase蛋白激酶家族的异常表达可能是RCE-4治疗肿瘤的重要作用机制之一。
COX分为COX-1、COX-2两种亚型,其中COX-1是属于结构性表达,COX-2为诱导性表达。在正常情况下,COX-2鲜见表达,然而当机体受到外源或内源刺激时,常被激活[13]。近年研究发现,COX-2的高表达,与许多肿瘤肿瘤(如肝癌、胃癌、前列腺癌、宫颈癌、肺癌等)的发生、发展、转移密切相关,它的持续高表达常预示肿瘤的不良预后。因此,针对COX-2开展积极干预成为肿瘤防治的又一重要靶标[14]。本实验中免疫组化分析结果显示模型组移植瘤组织COX-2的表达水平明显升高,用紫杉醇和RCE-4治疗后,其表达水平明显降低,这与我们前期研究[15]证实其具有良好抗炎活性和抗肿瘤作用一致。由此我们初步推断抑制COX-2的表达可能是RCE-4抑制肿瘤生长的重要作用机制之一。
综上所述,RCE-4对宫颈癌裸鼠移植瘤的生长具 有显著抑制作用,其机制可能与其上调Bax、Caspase-9、 Caspase-3的表达和下调Survivin、Bcl-2、COX-2的表达有关,但是RCE-4是否仅通过该通路发挥作用还是有其他通路参与其中,我们正在进一步研究。
| [1] | 中华本草编委会. 中华本草[J]. 第8册22卷. 上海: 上海科学技术出版社, 1999: 178-180. |
| [2] | 王倩. 吉祥草根茎化学成分及其细胞毒活性研究[J]. 宜昌: 三峡大学, 2012. |
| [3] | Wang G, Huang W, He H, et al. Growth inhibition and apoptosis-inducing effect on human cancer cells by RCE-4, a spirostanol saponin derivative from natural medicines[J]. Int J Mol Med, 2013, 31(1): 219-224. DOI: 10.3892/ijmm.2012.1178 |
| [4] | 曾建华, 钟玲, 徐波. 地塞米松对宫颈癌细胞裸鼠移植瘤生长的抑制作用[J]. 第三军医大学学报, 2008, 30(13): 1279-1382. |
| [5] | Roomi M W, Kalinovsky T, Cha J, et al. Effects of a nutrient mixture on immunohistochemical localization of cancer markers in human cervical cancer HeLa cell tumor xenografts in female nude mice[J]. Exp Ther Med, 2015, 9(2): 294-302. DOI: 10.3892/etm.2014.2127 |
| [6] | 李龙, 尚卫华, 赵娟, 等. 阿司匹林对宫颈癌裸鼠移植瘤生长的影响及Bax与VEGF的表达变化[J]. 西安交通大学学报: 医学版, 2013, 34(6): 808-812. DOI: 10.7652/jdyxb201306022 |
| [7] | Jaiswal P K, Goel A, Mittal R D. Survivin: A molecular biomarker in cancer[J]. Indian J Med Res, 2015, 141 (4): 389-397. DOI: 10.4103/0971-5916.159250 |
| [8] | Khan S, Ferguson-Bennit H, Asuncion-Valenzuela M M, et al. Localization and upregulation of survivin in cancer health disparities: a clinical perspective[J]. Biologics, 2015, 9: 57-67. DOI: 10.2147/BTT.S83864 |
| [9] | Chen Z Y, Liang K, Lin Y, et al. Study of the UTMD-based delivery system to induce cervical cancer cell apoptosis and inhibit proliferation with shRNA targeting Survivin[J]. Int J Mol Sci, 2013, 14(1): 1763-1777. DOI: 10.3390/ijms14011763 |
| [10] | Spagnuolo C, Russo G L, Orhan I E, et al. Genistein and cancer: current status, challenges, and future directions[J]. Adv Nutr, 2015, 6(4): 408-419. DOI: 10.3945/an.114.008052 |
| [11] | Wang Z, Zhao Z, Lu J, et al. A comparison of the biological effects of 125I seeds continuous low-dose-rate radiation and 60Co high-dose-rate gamma radiation on non-small cell lung cancer cells[J]. PLoS One, 2015, 10(8): e0133728. DOI: 10.1371/journal.pone.0133728 |
| [12] | 王爱玲, 王海燕, 覃慧林, 等. 南赤瓟醇提物对裸鼠宫颈癌Caski移植瘤的抑制作用[J]. 三峡大学学报: 自然科学版, 2015, 37(3): 108-112. |
| [13] | Jones R P, Bird N T, Smith R A, et al. Prognostic molecular markers in resected extrahepatic biliary tract cancers; a systematic review and meta-analysis of immunohistochemically detected biomarkers[J]. Biomark Med, 2015, 9(8): 763-775. DOI: 10.2217/BMM.15.48 |
| [14] | Misra S, Sharma K. COX-2 signaling and cancer: new players in old arena[J]. Curr Drug Targets, 2014, 15(3): 347-359. |
| [15] | Bai C H, He H B, Cheng F, et al. A steroidal saponin RCE-4 inhibits lipopolysaccharide-stimulated inflammatory responses via blocking PI3K/Akt-mediated NF-κB activation in RAW264.7 cells[J]. Applied Mechanics and Materials, 2014, (568/570): 1901-1906. |



