近年来干细胞移植技术已成为医学研究的热点,在帕金森病及阿尔茨海默病等[1, 2]神经系统疾病的临床治疗中有着广泛的应用,然而在脊髓损伤等疾病的临床治疗研究进展缓慢。神经干细胞(neural stem cells,NSCs)[3]正常情况下大多向胶质细胞方向分化,极少数分化为神经元,这对神经系统损伤后功能的修复造成了很大的困难。Wnt信号是生物进化上非常保守的形态发生信号,参与胚胎发生、细胞增殖与分化及器官再生等多种生理过程[4, 5],其中Wnt/β-catenin信号通路是Wnt信号通路中最经典的信号通路,在哺乳动物中枢神经系统的发育过程中起着至关重要的作用[6]。目前,β-catenin对NSCs分化作用的研究主要涉及脑源性NSCs[7, 8, 9],而对脊髓来源NSCs的研究甚少。本研究探讨β-catenin对脊髓源性NSCs的分化作用,以期为脊髓损伤后的修复提供理论基础。
1 材料与方法 1.1 主要实验试剂细胞培养基DMEM/F12、胎牛血清、无血清培养添加剂B27、Glu和胰酶(Gibco公司),bFGF和EGF(金斯瑞公司),抗巢蛋白(Nestin)抗体、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体和神经核(nerve nuclei,NeuN)抗体(Abcam公司),细胞裂解液和RNA提取试剂盒(百泰克公司),反转录试剂盒和PCR Mix(天根公司)。
1.2 细胞和重组腺病毒无菌条件取出E14的CD1胎鼠(重庆医科大学实验动物中心提供)脊髓,置于PBS(pH 7.4)中漂洗,于解剖显微镜下剥去脊膜,用手术刀片将组织切碎,加入少量DMEM/F12(1∶1)无血清培养基,经200目尼龙网滤过,1 000 r/min离心10 min收集细胞,之后将细胞吹打成单细胞悬液,于每培养瓶中(T75培养瓶)接种5×105个细胞,使用含B27的DMEM/F12(1∶1)无血清培养基,加用bFGF(20 ng/mL),37 ℃5%CO2培养。待原代克隆形成后再次机械分离克隆制成单细胞悬液,每培养瓶中加入5×104个细胞,并换成Neurobasal培养基,加入胎牛血清(5%)、B27(2%)、Glu(1%)、bFGF(20 ng/mL)及EGF(20 ng/mL),37 ℃5%CO2培养。每4~5天机械分离克隆传代1次,方法同前。人胚肾HEK293细胞、Adβ-catenin重组腺病毒及AdGFP重组腺病毒均为本课题组保存。
1.3 重组腺病毒Adβ-catenin及AdGFP扩增293细胞接种于培养皿,细胞达60%~80%汇合时,加入病毒原液,24 h后观察荧光表达,3~4 d后约90%细胞表达荧光时离心收集细胞,经反复冻融3次后,高速离心收集上清液得到较高滴度的重组腺病毒,-80 ℃保存备用。
1.4 实验分组及处理实验分3组:单独培养的NSCs(空白组);GFP组:将NSCs接种于培养皿中,细胞达60%左右融合时,加入适量AdGFP病毒原液,使其成为感染空载AdGFP腺病毒的NSCs;β-catenin组:将NSCs接种于培养皿中,细胞达60%左右融合时,加入适量Adβ-catenin病毒原液,使其成为感染Adβ-catenin腺病毒的NSCs。NSCs继续传代培养,24 h后观察GFP组及β-catenin组荧光表达情况,补加相应腺病毒,达到48 h后观察荧光表达一致(感染率约50%)。
1.5 RNA提取及RT-PCR检测参照RNA提取试剂盒提取处理5 d后的各组细胞RNA,反转录合成cDNA,以其为模板,特异扩增神经元特异烯醇化酶(NSE)的引物(正向:5′-AGCCCTCATCAGCTCAGGTA-3′,反向:5′-CTGAGCAATGTGGCGATAGA-3′,片段大小184 bp)、GFAP的引物(正向:5′-CACGAACGAGTCCCTAGAGC-3′,反向:5′-GTAGGTGGCGATCTCGATGT-3′,片段大小196 bp),以及内参β-actin的引物(正向:5′-AGGGAAATCGTGCGTGAC-3′,反向:5′-CGCTCGTTGCCAATAGTGA-3′,片段大小146 bp),进行降落聚合酶链式反应。PCR产物经琼脂糖电泳后凝胶成像仪上观察拍照。
1.6 细胞免疫荧光检测细胞分组处理后5 d,细胞铺板,待细胞贴壁后弃培养基,多聚甲醛固定细胞15 min,弃多聚甲醛,PBS洗3次,每次5 min,Triton作用后,牛血清白蛋白封闭,一抗(1 ∶300)4 ℃孵育过夜,复温1 h,回收一抗,PBS洗3次,每次5 min,相应二抗(1 ∶1 000)室温下孵育1 h,回收二抗,PBS洗3次,每次5 min,DAPI染核5 min后,PBS洗3次,每次5 min,封片液封片,荧光显微镜下观察拍照。
1.7 总蛋白提取及Western blot检测细胞分组处理后5 d,PBS洗2遍,细胞刮刮下细胞吸入1.5 mL无酶离心管,加入裂解液RIPA(提前加入终浓度为1 mmol/L的蛋白酶抑制剂PMSF)200 μL,冰上裂解30 min后,4 ℃、13 000 r/min离心5 min,吸取上清至1.5 mL无酶离心管中,BCA法检测蛋白浓度,10%分离胶、5%浓缩胶进行电泳,电泳后湿转法转膜,5%脱脂牛奶封闭1 h,一抗(1 ∶5 000)于4 ℃孵育过夜,复温1 h,回收一抗,TBST洗膜3次,二抗(1 ∶2 000)于室温孵育1 h,回收二抗,TBST洗膜3次,ECL发光试剂滴于膜上,置于发光成像仪上观察拍照。
1.8 统计学分析每组实验重复3次,应用SPSS 19.0统计软件,计量资料以x±s表示,两两组间比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果 2.1胎鼠神经干细胞形态及鉴定胎鼠脊髓中获得的原代细胞,经1.2中方法培养24 h,未见细胞克隆形成,2 d后可见少许克隆形成,培养5~6 d,可见细胞集落明显增大,以球型为主(图 1A)。原代克隆经4~5次机械分离及传代培养后,更换为Neurobasal培养基培养,并加入胎牛血清、EGF、FGF、B27、Glu等因子,形成单细胞悬液,细胞贴壁生长(图 1B),贴壁的细胞克隆经细胞免疫荧光检测,约90%细胞神经干细胞特征性标志物Nestin呈强阳性(图 1C~E)。
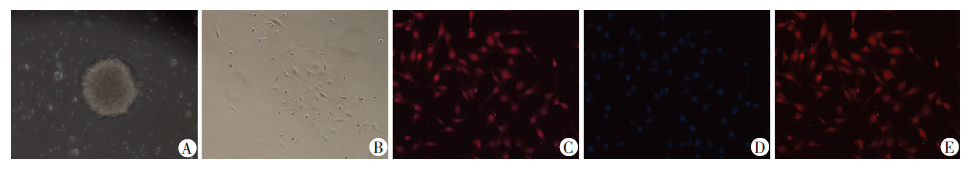 |
| A:培养基中呈悬浮球形生长的克隆;B:贴壁生长的细胞克隆;C~E:克隆细胞呈Nestin阳性(C为融合图,D为DAPI,E为Nestin阳性细胞) 图 1 分离的神经干细胞及Nestin免疫荧光鉴定 (×200) |
NSCs经腺病毒感染后,生长状态良好。感染3 d,荧光显微镜观察细胞的荧光表达率均为60%左右(图 2)。保证了后续实验结果的可信性及组间数据的可比性。
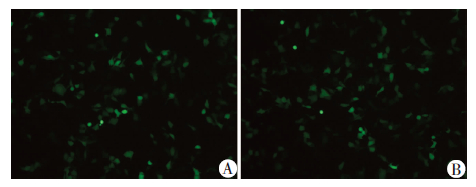 |
| A:GFP组;B:β-catenin组图 2 荧光显微镜观察AdGFP及Adβ-catenin腺病毒感染NSCs (×100) |
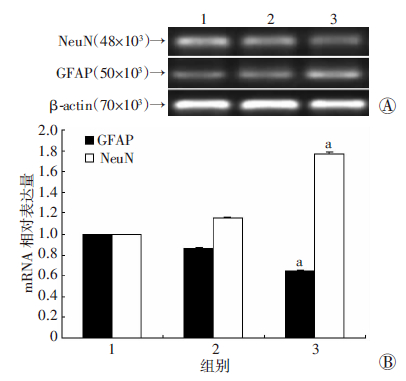
RT-PCR检测结果显示,β-catenin组NSE mRNA表达水平显著高于空白组和GFP组,而GFAP mRNA表达均显著低于其他两组(P<0.05,图 3)。
 |
| 1:空白组;2:GFP组;3:β-catenin组 A:RT-PCR检测;B:半定量分析 a:P<0.05,与空白组及GFP组比较图 3 不同处理组GFAP、NSE及Nestin mRNA表达 |
感染AdGFP及Adβ-catenin腺病毒5 d后,GFAP细胞质与细胞核均有表达;β-catenin组的细胞阳性率显著低于空白组和GFP组(图 4)。NeuN主要定位于细胞核内,β-catenin组阳性率显著高于其他两组(P<0.05,图 5、6)。
 |
| 图 4 免疫荧光检测各组GFAP表达及定位 (×200) |
 |
| 图 5 免疫荧光检测各组NeuN表达及定位 (×200) |
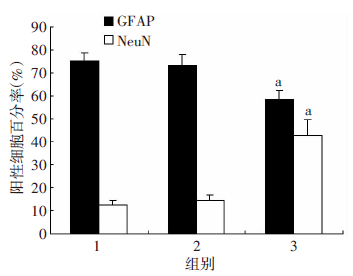 |
| 1:空白组;2:GFP组;3:β-catenin组 a:P<0.05,与空白组及GFP组比较图 6 免疫荧光检测各组阳性细胞百分比 |
Western blot结果显示,Adβ-catenin腺病毒感染NSCs后NeuN表达显著高于空白组和GFP组(P<0.05),而GFAP表达水平则显著低于其他两组(P<0.05,图 7)。
 |
| 1:空白组;2:GFP组;3:β-catenin组 A:Western blot检测;B:半定量分析 a:P<0.05,与空白组及GFP组比较图 7 Western blot检测不同处理组GFAP、NeuN的表达 |
近年来,干细胞作为治疗疾病的种子细胞在基础实验中取得了良好的治疗效果[10]。如NSCs在脑组织及脑血管再生等方面发挥了重要作用[11, 12]。
Wnt是一类通过自分泌或旁分泌发挥作用的分泌型糖蛋白,目前在哺乳动物中发现了19种Wnt蛋白[13]。β-catenin是经典Wnt信号通路中的关键分子,不仅对组织创面有修复作用[14],还对动物的神经系统发育起着关键作用[15, 16]。Inestrosa等[17]发现Wnt/β-catenin信号可以促进多个脑区中NSCs的自我增殖,调节其向神经元方向分化。经β-catenin基因敲除的小鼠,其脑部存在明显发育缺陷,神经前体细胞出现增殖停滞,而过表达β-catenin基因的小鼠其脑内神经前体细胞数量明显增加[18]。目前关于β-catenin对脊髓来源NSCs分化的研究甚少。
本实验显示,通过酶消化法取材胎鼠脊髓的原代细胞,利用单细胞克隆技术扩增培养,细胞免疫荧光鉴定结果显示约90%细胞Nestin蛋白呈强阳性。Nestin蛋白属于中间丝蛋白,特异性的表达于神经外胚层。感染AdGFP及Adβ-catenin腺病毒后荧光显微镜拍照显示感染情况可,感染效率一致。感染5 d后,RT-PCR、Western blot及免疫荧光检测NSCs感染后细胞的分化情况。NSE是由成熟神经元和神经元起源细胞持续表达的胞质蛋白,是一种脑特异性的糖酵解酶,在细胞内能量代谢中起着重要的作用。在发育过程中,NSE的水平非常低,但在神经元形态和功能成熟过程中增加。GFAP是最广泛使用的星形胶质细胞的标记之一。RT-PCR结果显示β-catenin组中GFAP mRNA表达显著低于其他两组,而NSE的表达则显著增高,表明分离的Nestin阳性细胞为NSCs,具有向神经元及星形胶质细胞分化的潜能。NeuN作为神经元核蛋白,能够在脊椎动物的神经细胞中检测到,是一种能够识别神经元特异的核蛋白单克隆抗体产生的。免疫荧光结果显示β-catenin组细胞NeuN的表达较空白组及GFP组显著增高,主要表达在细胞核内,GFAP相对其他两组降低,表面β-catenin可以促进NSCs向神经元及星形胶质细胞分化,而向神经元方向分化的细胞比例要大于星形胶质细胞。Western blot结果显示β-catenin组细胞NeuN的表达较空白组及GFP组显著增高,GFAP降低,也证实了脊髓源性NSCs有分化为神经元、星形胶质细胞的潜能,β-catenin可以作为一种调节因子调控NSCs向神经元分化。
综上所述,Wnt/β-catenin信号途径参与了NSCs向神经元细胞分化的过程。在体外细胞培养中,其对NSCs的分化起着至关重要的作用。当Wnt通路活化时,可激活细胞内的酪蛋白激酶1ε(CKIε),使散乱蛋白磷酸化后释放GBP,结合β-catenin上的GSK3β,从而抑制GSK3β对β-catenin 的磷酸化,未磷酸化的β-catenin被转运到核中,破坏淋巴增强因子及T细胞因子家族形成复合物,启动神经元分化相关靶基因的转录[19],调控NSCs向神经元方向分化。然而细胞分化的调控是一个复杂的过程,涉及众多调控通路,信号通路对细胞增殖与分化的调控也同时存在不同的调控机制。因此,Wnt/β-catenin信号途径对NSCs向神经元细胞分化的调控机制还有待进一步研究。
| [1] | Lim D A, Huang Y C, Alvarez-Buylla A. The adult neural stem cell niche: lessons for future neural cell replacement strategies[J]. Neurosurg Clin N Am, 2007, 18(1): 81-92, ix. DOI: 10.1016/j.nec.2006.10.002 |
| [2] | Singh S, Mishra A, Shukla S. ALCAR Exerts Neuroprotective and Pro-Neurogenic Effects by Inhibition of Glial Activation and Oxidative Stress via Activation of the Wnt/β-Catenin Signaling in Parkinsonian Rats[J]. Mol Neurobiol, 2015: 1-16. DOI: 10.1007/s12035-015-9361-5 |
| [3] | Yuan T, Chen M. Neural Stem Cells[J]. Electronic J Biol, 2008, 4(2): 34-35. |
| [4] | Croce J C, McClay D R. Evolution of the Wnt pathway[J]. Methods Mol Biol, 2008, 469: 3-18. DOI: 10.1007/978-1-60327-469-2_1 |
| [5] | Kim H, Kim S, Song Y, et al. Dual Function of Wnt Signaling during Neuronal Differentiation of Mouse Embryonic Stem Cells[J]. Stem Cells Int, 2015, 2015: 459301. DOI: 10.1155/2015/459301 |
| [6] | Lewis A E, Vasudevan H N, O’Neill A K, et al. The widely used Wnt1-Cre transgene causes developmental phenotypes by ectopic activation of Wnt signaling[J]. Dev Biol, 2013, 379(2): 229-234. DOI: 10.1016/j.ydbio.2013.04.026 |
| [7] | Chen B Y, Wang X, Wang Z Y, et al. Brain-derived neurotrophic factor stimulates proliferation and differentiation of neural stem cells, possibly by triggering the Wnt/β-catenin signaling pathway[J]. J Neurosci Res, 2013, 91(1): 30-41. DOI: 10.1002/jnr.23138 |
| [8] | Braunschweig L, Meyer A K, Wagenfuhr L, et al. Oxygen regulates proliferation of neural stem cells through Wnt/β-catenin signalling[J]. Mol Cell Neurosci, 2015, 67: 84-92. DOI: 10.1016/j.mcn.2015.06.006 |
| [9] | Wang L, Liu Y, Li S, et al. Wnt signaling pathway participates in valproic acid-induced neuronal differentiation of neural stem cells[J]. Int J Clin Exp Pathol, 2015, 8(1): 578-585. |
| [10] | Mimeault M, Batra S K. Recent progress on tissue-resident adult stem cell biology and their therapeutic implications[J]. Stem Cell Rev, 2008, 4(1): 27-49. DOI: 10.1007/s12015-008-9008-2 |
| [11] | Makri G, Lavdas A A, Katsimpardi L, et al. Transplantation of embryonic neural stem/precursor cells overexpressing BM88/Cend1 enhances the generation of neuronal cells in the injured mouse cortex[J]. Stem Cells, 2010, 28(1): 127-139. DOI: 10.1002/stem.258 |
| [12] | Wu W, Chen X, Hu C, et al. Transplantation of neural stem cells expressing hypoxia-inducible factor-1alpha (HIF-1alpha) improves behavioral recovery in a rat stroke model[J]. J Clin Neurosci, 2010, 17(1): 92-95. DOI: 10.1016/j.jocn.2009.03.039 |
| [13] | 曹旻. 神经发生中的wnt信号通路[J]. 中国组织工程研究, 2013, 17(2): 358-362. DOI: 10.3969/j.issn.2095-4344.2013.02.031 |
| [14] | 王钰, 龙爽, 谭力, 等.粒细胞集落刺激因子激活β-catenin促进创面修复[J]. 第三军医大学学报, 2015, 37(16): 1648-1651. DOI: 10.16016/j.1000-5404.201411088 |
| [15] | Ortega F, Gascon S, Masserdotti G, et al. Oligodendrogliogenic and neurogenic adult subependymal zone neural stem cells constitute distinct lineages and exhibit differential responsiveness to Wnt signalling[J]. Nat Cell Biol, 2013, 15(6): 602-613. DOI: 10.1038/ncb2736 |
| [16] | 才礼扬, 赵斌, 王栓科, 等. 脊髓损伤后Wnt-3a表达对神经干细胞增殖的影响[J]. 国际骨科学杂志, 2011, 32(2): 129-131. DOI: 10.3969/j.issn.1673-7083.2011.02.021 |
| [17] | Inestrosa N C, Varela-Nallar L. Wnt signalling in neuronal differentiation and development. Cell Tissue Res, 2015, 359(1): 215-223. DOI: 10.1007/s00441-014-1996-4 |
| [18] | Zechner D, Fujita Y, Hulsken J, et al. beta-Catenin signals regulate cell growth and the balance between progenitor cell expansion and differentiation in the nervous system[J]. Dev Biol, 2003, 258(2): 406-418. |
| [19] | Kleber M, Lee H, Wurdak H, et al. Neural crest stem cell maintenance by combinatorial Wnt and BMP signaling[J]. J Cell Biol, 2005, 169(2): 309-320. DOI: 10.1083/jcb.200411095 |



