茱萸碱(Evodiamine,Evo)是从芸香科植物吴茱萸[Evodia rutaecarpa (Juss.)Benth]的近成熟果实中分离出的一种生物碱,临床可用于治疗胃肠道功能紊乱、头痛和产后出血等疾病[1]。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)是细胞增殖启动的重要调节因子,其蛋白水平反应细胞的增殖状态。半胱氨酸天冬氨酸蛋白酶(Caspase)属于半胱氨酸蛋白水解酶类,在细胞的凋亡、坏死及炎症反应中具有重要重用。近年研究表明,Evo具有较强的抗肿瘤活性,对多种肿瘤细胞具有抑制增殖作用,如肺癌、乳腺癌、胃癌和结肠癌细胞等[2, 3],但其具体的分子机制目前仍不十分清楚。目前,化疗是结肠癌临床治疗的一种重要方式,但由于化疗药物的细胞毒性及结肠癌的转移等因素[4],寻找低细胞毒性及基因靶向药物依旧是研究热点。实体瘤由于血管微环境异常造成血液供氧不足或PI3K/Akt信号通路活化,导致缺氧诱导因子-1α(hypoxia inducible factor 1-alpha,HIF-1α)在肿瘤组织中高表达[5]。HIF-1α能够招募特定的转录共激活因子并与HIF-1β形成有功能的转录复合体,与其效应元件结合,调节与癌细胞增殖、血管生成、侵袭和转移等有关的基因表达[6]。文献报道,在结肠癌细胞中降低HIF-1α表达可促进结肠癌细胞凋亡,减少上皮细胞-间充质转化(EMT)过程[7]。Evo抑制结肠癌细胞的增殖作用是否与抑制HIF-1α表达有关,目前尚不清楚。本研究检测Evo对LoVo细胞增殖和凋亡的影响,并分 析这种作用与HIF-1α的关系,为将Evo作为抗肿瘤药物或辅助抗肿瘤药物治疗结肠癌提供实验与理论基础。
1 材料与方法 1.1 试剂及细胞培养吴茱萸碱购自西安昊轩生物科技有限公司(纯度≥99%),二甲基亚砜(DMSO)购自北京索莱宝科技有限公司,胎牛血清购自美国HyClone公司,Western blot抗体购自Santa Cruz Biotechnology公司,Lipofectamine购自Invitrogen公司。HIF-1α荧光素酶报告质粒(pHIF-Luc,由芝加哥大学何通川教授惠赠),人结肠癌LoVo细胞株购自ATCC(American Type Culture Collection)。细胞培养使用含10%胎牛血清的DMEM培养基(含105 U/L青霉素,0.1 g/L链霉素,北京索莱宝科技有限公司),培养条件为37 ℃、5%CO2。
1.2 结晶紫染色检测细胞增殖
取对数生长期LoVo细胞接种于24孔板,待细胞 贴壁后加入不同浓度Evo(0.25、0.5、1、2、4 μmol/L)[8],每个浓度设3个平行复孔,并设空白溶剂对照组。药物作用24、48、72 h后,弃培养基,用PBS清洗孔板,每孔加结晶紫饱和溶液200 μL,室温孵育20 min。移去结晶紫工作液,用PBS清洗3次,室温下将孔板晾干后扫描。
1.3 Annexin V-EGFP双染法检测细胞凋亡取对数生长期LoVo细胞接种于6孔板,待细胞贴壁后加入不同浓度Evo(0.5、1、2 μmol/L),24 h后丢弃培养基,PBS洗涤2次,收集细胞。按Annexin V-EGFP细胞凋亡试剂盒说明进行操作,通过流式细胞仪检测,分析细胞凋亡率。
1.4 荧光素酶报告质粒检测HIF-1α转录活性取对数生长期LoVo细胞接种于T25瓶,细胞贴壁后用Lipofectamine转染HIF-1α报告质粒(p-HIF-Luc)3 μg,4 h换液。12 h后将细胞消化重新种于24孔板,待细胞贴壁后,用Evo(0.5、1、2 μmol/L)处理细胞。24 h后,裂解细胞,收集裂解液,并按照试剂盒操作说明进行荧光素酶活性测定。用BCA法测定裂解液总蛋白浓度(校正荧光素酶活性)。每组实验重复3次,结果取平均值。
1.5 Western blot实验取对数生长期LoVo细胞接种于6孔板,取对数生长期LoVo细胞接种于6孔板,Evo(0、0.5、1 μmol/L)处理细胞后,于相应时间点提取PCNA、Caspase-3总蛋白;Evo(0、0.5、1、2 μmol/L)处理细胞后,于相应时间点提取HIF-1α、Akt1/2 、p-Akt1/2总蛋白,于10%聚丙烯酰胺凝胶进行电泳,实验步骤按照Western blot常规操作方法,ECL试剂盒显影并成像。每组实验重复3次。Evo(0.5、1、2 μmol/L)处理细胞,并于相应时间点提取总蛋白,于10%聚丙烯酰胺凝胶进行电泳,实验步骤按照Western blot常规操作方法,ECL试剂盒显影并成像。每组实验重复3次。
1.6 统计学处理采用SPSS 16.0统计软件,计量资料以x±s表示,组间比较采用t检验和单因素方差分析。
2 结果 2.1 Evo对LoVo细胞增殖的影响结晶紫染色分析显示,不同浓度Evo作用于LoVo细胞24、48、72 h后,与对照组相比均表现出抑制LoVo细胞增殖的作用,且呈浓度及时间依赖性(图 1A)。Western blot检测结果显示,Evo明显抑制增殖细胞核抗原(PCNA)的表达水平(图 1B)。提示Evo具有抑制LoVo细胞增殖的作用。
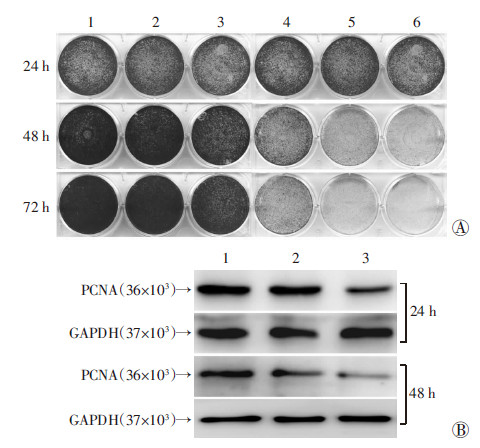 |
| A: 结晶紫染色分析 1:对照组;2~6:分别为0.25、0.5、1、2、4 μmol/L Evo; B:Western blot分析 1:对照组;2、3:分别为0.5、1 μmol/L Evo 图 1 结晶紫染色和Western blot分析Evo对LoVo细胞增殖的影响 |
Annexin V-EGFP双染流式分析显示,LoVo细胞经不同浓度Evo(0.5、1、2 μmol/L)处理24 h后,与对照组相比,凋亡细胞数随浓度增大而增多,呈浓度依赖性(图 2A)。Western blot检测显示,与对照组相比,Evo处理后各组Caspase-3蛋白水平表达明显升高,呈浓度依赖性(图 2B)。表明Evo能明显诱导LoVo细胞凋亡。
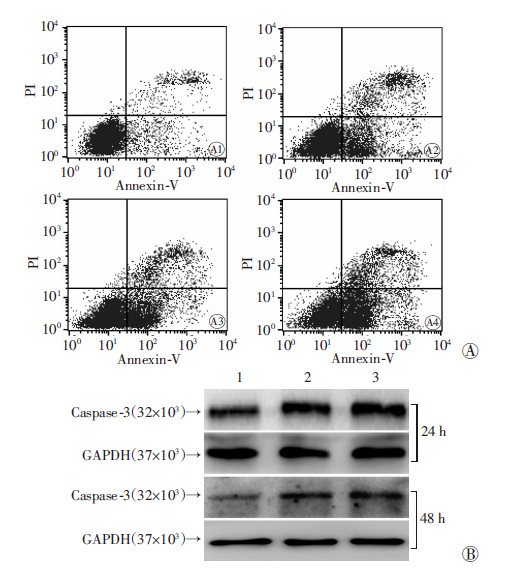 |
| A: 流式分析 A1:对照组;A2: 0.5 μmol/L Evo;A3:1 μmol/L Evo;A4:2 μmol/L Evo;B:Western blot分析 1:对照组;2、3:分别为0.5、1 μmol/L Evo 图 2 流式细胞术和Western blot分析Evo对LoVo细胞凋亡的影响 |
荧光素酶报告质粒分析显示,与对照组相比,Evo对HIF-1α报告质粒的转录活性有明显抑制作用(图 3A),且呈浓度依赖性增强。Western blot检测显示,与对照组相比,Evo处理后LoVo细胞的HIF-1α蛋白水平表达明显降低,且呈现浓度依赖性(图 3B)。提示Evo对LoVo细胞中HIF-1α的表达具有抑制作用。
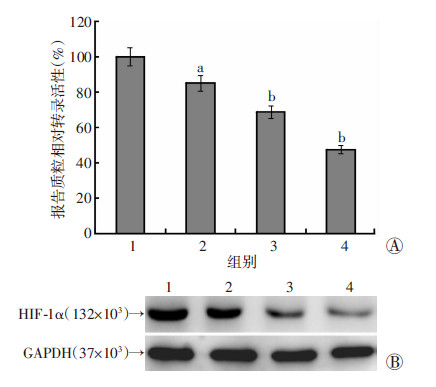 |
| A: 荧光素酶报告质粒分析 a: P<0.05,b: P<0.01,与对照组比较;B:Western blot分析 1:对照组;2~4:分别为0.5、1、2 μmol/L Evo 图 3 荧光素酶报告质粒和Western blot分析Evo对LoVo细胞中HIF-1α表达的影响 |
Western blot检测显示,与对照组相比,Evo处理组LoVo细胞中Akt1/2蛋白水平无明显变化;但Akt1/2磷酸化水平明显降低,且呈现浓度依赖性(图 4)。提示Evo对PI3K/Akt信号转导具有明显抑制作用。
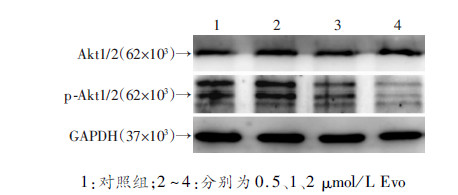 |
| 1:对照组;2~4:分别为0.5、1、2 μmol/L Evo 图 4 Western blot分析Evo对LoVo细胞中PI3K/Akt信号的影响 |
结肠癌的高发病率和死亡率使其成为严重威胁我国居民健康的恶性肿瘤之一。我国拥有丰富的中药资源,从中药分离提取有效单体是寻找抗癌新药物的有效途径之一。
Evo是吴茱萸果实中分离出的生物碱。文献报道Evo对多种肿瘤细胞具有明显的增殖抑制作用,因而成为研究新型抗癌药物的热点,但其具体机制仍不十分清楚。本研究发现,Evo能够明显抑制LoVo细胞的增殖及PCNA表达水平,提示Evo能抑制结肠癌细胞增殖。Annexin Ⅴ是一类广泛分布于真核细胞细胞质内钙离子依赖的磷脂结合蛋白。在细胞发生凋亡的早期,磷脂酰丝氨酸会外翻到细胞膜外侧,而Annexin Ⅴ可与磷脂酰丝氨酸特异性结合。因此,Annexin Ⅴ可作为检测细胞早期凋亡的灵敏指标之一。Caspase-3作为凋亡家族的执行者,其蛋白水平表达能反映细胞凋亡状态。本实验发现,Evo能明显增加Caspase-3蛋白水平;流式分析结果也表明Evo处理后,Annexin Ⅴ结合细胞比例明显增加。以上结果充分证实Evo能明显抑制LoVo细胞增殖,促进细胞凋亡。
HIF-1α调控多种靶基因,在癌细胞增殖、能量代谢、血管生成、侵袭、转移和耐药等方面起着重要作用。因此本实验利用HIF-1α荧光素酶报告质粒(pHIF-Luc)分析Evo对HIF-1α转录活性的影响。实验结果显示,Evo能明显抑制HIF-1α报告质粒的转录活性。进一步研究发现,Evo能明显降低HIF-1α在LoVo细胞的蛋白水平。PI3K/Akt信号通路异常活化是结肠癌发生的分子机制之一。缺氧或胰岛素生长因子可通过激活PI3K/Akt信号通路,进而增强HIF-1α蛋白稳定性及蛋白聚集[9]。为进一步探索Evo对HIF-1α调控的具体机制,本研究检测了Evo对LoVo细胞中Akt1/2和磷酸化Akt1/2蛋白水平的影响。结果显示,Evo对Akt1/2蛋白表达水平无明显影响,但能显著降低Akt1/2的磷酸化水平,且呈浓度依赖性。
目前研究认为,Evo抑制癌细胞增殖和促进其凋亡的主要机制与影响线粒体功能和调控Caspase和Bcl-2蛋白家族的表达等有关,但其他可能的分子机制仍不十分清楚[3, 10]。本研究结果表明,Evo能抑制结肠癌LoVo细胞增殖,这种作用与下调HIF-1α蛋白表达有关;Evo对HIF-1α表达的影响可能通过抑制PI3K/Akt信号转导实现。但是,Evo抑制PI3K/Akt信号转导的机制还有待进一步研究。
| [1] | Jiang J, Hu C. Evodiamine: a novel anti-cancer alkaloid from Evodia rutaecarpa[J]. Molecules, 2009, 14(5): 1852-1859. DOI:10.3390/molecules14051852 |
| [2] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. DOI:10.1002/ijc.29210 |
| [3] | Zhang C, Fan X, Xu X, et al. Evodiamine induces caspase-dependent apoptosis and S phase arrest in human colon lovo cells[J]. Anticancer Drugs, 2010, 21(8) : 766-776. DOI:10.1097/CAD.0b013e32833d26a9 |
| [4] | Merika E, Saif M W, Katz A, et al. Review. Colon cancer vaccines: an update[J]. In Vivo, 2010, 24(5): 607-628. |
| [5] | Zhong H, Chiles K, Feldser D, et al. Modulation of hypoxia-inducible factor 1alpha expression by the epidermal growth factor/phosphatidylinositol 3-kinase /PTEN/AKT/FRAP pathway in human prostate cancer cells: implications for tumor angiogenesis and therapeutics[J]. Cancer Res, 2000, 60(6) : 1541-1545. |
| [6] | Hu C J, Wang L Y, Chodosh L A, et al. Differential roles of hypoxia-inducible factor 1 alpha (HIF-1alpha) and HIF-2alpha in hypoxic gene regulation[J]. Mol Cell Biol, 2003, 23(24): 9361-9374. |
| [7] | Chen H, Shen A, Zhang Y, et al. Pien Tze Huang inhibits hypoxia-induced epithelial-mesenchymal transition in human colon carcinoma cells through suppression of the HIF-1 pathway[J]. Exp Ther Med, 2014, 7(5): 1237-1242. DOI:10.3892/etm.2014.1549 |
| [8] | 杨秋珺, 周龙洋, 刘映孜, 等. 小檗碱抑制HCT116细胞生长与Wnt/β-catenin信号的关系研究[J]. 中国药理学通报, 2012, 28(9): 1234-1238. DOI:10.3969/j.issn.1001-1978.2012.09.012 |
| [9] | Dekanty A, Lavista-Llanos S, Irisarri M, et al. The insulin-PI3K/TOR pathway induces a HIF-dependent transcriptional response in Drosophila by promoting nuclear localization of HIF-alpha/Sima[J]. J Cell Sci, 2005, 118(Pt 23): 5431-5441. DOI:10.1242/jcs.02648 |
| [10] | Fang C, Zhang J, Qi D, et al. Evodiamine induces G2/M arrest and apoptosis via mitochondrial and endoplasmic reticulum pathways in H446 and H1688 human small-cell lung cancer cells[J]. PLoS One, 2014, 9(12): e115204. DOI: 10.1371/journal.pone.0115204 |



