骨肉瘤是间叶组织来源的具有形成骨质或肿瘤样类骨质能力的恶性骨肿瘤。好发于青少年,多数为原发性,少数为继发性,具有恶性程度高,侵袭性强,发生转移早,预后差,易发生肺转移的特点[1]。目前骨肉瘤的治疗主要以手术联合放化疗为主,5年生存率在未发生转移的患儿约65%[2],在发生转移的患儿仅5%~20%[3],远低于其他实体肿瘤的治疗现状。因此,探寻新思路,揭示骨肉瘤的发生发展规律,提高其疗效已成为迫切的需要。
分化抑制因子(inhibitor of differentiation,Id)又名DNA结合抑制因子(inhibitor of DNA binding,Id),其主要的生理功能有抑制细胞分化,促进细胞增殖,调节细胞周期,延迟细胞衰老等。后来研究证实其不但参与了肿瘤的发生、发展,还与肿瘤的侵袭及转移灶的形成密切相关[4, 5],而且其表达情况与肿瘤的分化程度呈显著负相关[6]。Id在骨肉瘤组织中的高表达亦有报道[7],但是对于Id与人骨肉瘤的关系尚不明确。本研究通过重组腺病毒技术调控Id基因最主要的亚型Id1在人骨肉瘤细胞MG63中的表达水平,检测MG63细胞的增殖能力、迁移能力、侵袭能力等恶性生物学行为的变化以及细胞周期、正常成骨分化早期指标ALP的变化,以期揭示Id1在骨肉瘤发生、发展中的作用,为骨肉瘤的治疗提供新的思路和方法。
1 材料与方法 1.1 实验材料和试剂骨肉瘤细胞株MG63、HEK293、重组腺病毒AdGFP由本实验室保存,重组腺病毒AdsiId1及AdId1由美国芝加哥大学分子肿瘤实验室TC-HE惠赠。DMEM高糖培养基和胎牛血清购于Gibco公司,胰蛋白酶、CCK-8试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、SDS-PAGE蛋白上样缓冲液、SDS-PAGE电泳液以及Western转膜液购于上海碧云天生物技术有限公司,TRIzol购于Invitrogen公司,全蛋白提取试剂盒和超敏型ECL检测试剂盒购于凯基生物,碱性磷酸酶(ALP)测定试剂盒购于南京建成生物工程研究所,兔源Id1抗体购于Santa Cruz公司,鼠源β-actin抗体购于北京四正柏生物科技有限公司,HRP标记的山羊抗兔、山羊抗小鼠二抗购于北京中杉金桥生物技术有限公司,逆转录试剂盒购于TaKaRa公司,Taq PCR Mastermix以及DNA marker购于天根生化科技有限公司,基质胶和Transwell小室购于BD公司,PVDF膜购于Millipore公司。Primer 6.0软件设计引物,由华大基因公司合成。
1.2 细胞培养HEK293、MG63细胞均用添加10%胎牛血清的DMEM 高糖培养基在37 ℃、5% CO2孵箱中培养,待贴壁生长至80%~90%的融合度时传代培养。
1.3 重组腺病毒扩增及最佳感染浓度测定在状态良好的HEK293细胞的对数增长期(铺满T25瓶底70%时)分别加入适量AdId1、AdsiId1、AdGFP病毒原液进行腺病毒扩增,待细胞变圆呈串珠样,约60%漂浮后收集细胞,液氮冷冻15 min-37 ℃水浴融解-震荡1 min,如此反复冻融3次,离心5 min(4 ℃,8 000 r/min),取上清液(含病毒)加入HEK293细胞反复乒乓感染,获得高滴度的AdId1、AdsiId1、AdGFP重组腺病毒;将对数生长期的MG63细胞接种于24孔培养板中,待细胞贴壁长至50%融合度时,按0.1、0.3、0.5、0.7、0.9、1.1 μL加入重组腺病毒,每组设复孔4个,分别在1、2、3 d观察记录荧光表达情况及细胞生长状态,以感染率>70%且不影响细胞状态为最佳感染浓度。剩余病毒分装,-80 ℃保存备用。
1.4 重组腺病毒处理MG63细胞实验设3个组,分别为AdId1处理组(Id1基因过表达组)、AdsiId1处理组(Id1基因沉默组)、AdGFP处理组(空白腺病毒对照组)。MG63细胞传代培养,达50%~60%融合度时,分别加入相应最佳感染浓度的腺病毒,24 h后观察记录各组荧光表达情况。
1.5 Total RNA提取及RT-PCR检测用TRizol分别提取各组细胞的Total RNA(步骤按说明书),逆转录为cDNA,以cDNA为模板对Id1基因进行PCR扩增,以β-actin为内参,引物Id1:上游5′-CAGCCAGTCGCCAAGAAT-3′,下游 5′-ACAGACAGC-GCACCACCT-3′;β-actin:上游5′-AGACCTGTACGCC-AACACAG-3′,下游5′-GTACTTGCGCTCAGGAGGAG-3′ 。Touch down RT-PCR法,反应程序为:94 ℃ 3 min,94 ℃ 30 s,68~54 ℃ 30 s,72 ℃ 1 min,每循环降低1 ℃,共15个循环;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,20个循环;72 ℃ 5 min,12 ℃ ∞。PCR扩增产物用2%琼脂糖80V电泳30 min,凝胶成像仪上观察拍照。
1.6 细胞全蛋白提取及Western blot检测用全蛋白提取试剂盒提取各组细胞蛋白(操作步骤按说明书),BCA法测定蛋白浓度,5%浓缩胶、12%分离胶进行60 V电泳,250 mA定流湿法转膜60 min,5%脱脂牛奶封闭2 h,一抗(1 ∶500)稀释于1%脱脂牛奶,4 ℃孵育过夜,TBST洗膜3次,15 min/次,二抗(1 ∶2 000)稀释于1%脱脂牛奶,室温孵育2 h,TBST洗膜3次,15 min/次,ECL发光试剂发光显影拍照。
1.7 CCK-8法检测细胞增殖取对数生长期的MG63细胞按1×104/孔接种于96孔板,待细胞贴壁后分AdId1处理组、AdsiId1处理组、AdGFP处理组感染重组腺病毒,在感染重组腺病毒10 h后,补培养液至100 μL/孔,按10 μL/孔加入 CCK-8,37 ℃孵箱孵育,分别在感染腺病毒12、24、36、48 h用酶标仪检测450 nm波长处各孔的光密度值[D(450)]。
1.8 划痕实验检测细胞迁移能力不同处理组细胞在感染重组腺病毒4 d后,分别加胰蛋白酶消化后收集细胞,以1×106/孔接种于提前画好标记线的6孔培养板,待细胞贴壁后用10 μL的Tip头垂直标记线均匀用力划痕(每组划痕宽度一致),PBS洗2遍,加入基础培养基2 mL/孔,在6、12、24、48、72 h后镜下观察细胞划痕愈合情况,选0 h和72 h 测量不同部位划痕宽度计算划痕愈合。
愈合率=(0 h划痕宽度-72 h划痕宽度)/0 h划痕宽度×100%
1.9 Transwell实验检测侵袭能力基质胶与基础培养液按1 ∶2混合稀释后,均匀加入上室(60 μL/孔),37 ℃孵箱2 h待胶凝固,吸去多余水分及未凝胶,加入基础培养液(50 μL/孔)水化基底膜1 h,吸去孔内液体,将不同处理组的MG63细胞消化离心后PBS洗2遍,用基础培养液重悬(调整细胞密度为1×105/100 μL),100 μL/孔加入上室,含20% FBS培养基(300 μL/孔)加入下室,每组设3个复孔,72 h后取出小室,吸去上室培养液,用棉签拭去上室残余基质胶及细胞,结晶紫室温染色10 min,PBS洗2遍,显微镜下观察拍照。
1.10 流式细胞术检测细胞周期不同处理组细胞感染腺病毒72 h后,用胰蛋白酶消化收集细胞,用预冷PBS洗涤3遍,500 μL PBS重悬细胞(细胞尽可能吹散成单个),将细胞悬浮液加入到5 mL的70%冰乙醇中混匀,4 ℃冰箱固定过夜。检测时,离心收集细胞弃乙醇,PBS洗1遍,重悬细胞于1 mL PBS,吹打细胞团成单个,加入10 mg/mL的RNase 5 μL,37 ℃放置1 h,加入100 μg/mL的PI染液,室温避光染色30 min,计数10 000个细胞,流式细胞仪检测细胞周期。
1.11 ALP酶标仪读数法检测ALP活性不同处理组细胞感染重组腺病毒7 d,吸去培养液,PBS洗2遍,100 μL/孔加入1%的Triton-100裂解细胞1 h,按照说明书测定ALP,BCA法测各组裂解液蛋白浓度,根据公式计算细胞中ALP活力。
ALP活力(金氏单位/g)=(测定光密度值-空白光密度值)/(标准光密度值-空白光密度值)×酚标准品浓度(0.02 mg/mL)/待测样本蛋白浓度(g/mL)
1.12 统计学分析数据以x±s表示,采用SPSS19.0统计软件进行单因素方差分析和方差同质性检验,方差齐采用LSD检验,方差不齐采用Tamhane's T2检验。
2 结果 2.1 RT-PCR及Western blot 检测感染重组腺病毒 3 d 的MG63细胞中Id1的表达在感染重组腺病毒3 d的MG63细胞中Id1的mRNA (图 1)和蛋白(图 2)的表达,Id1处理组的Id1表达水平明显高于GFP组,siId1处理组Id1表达水平明显低于GFP组(P<0.05)。
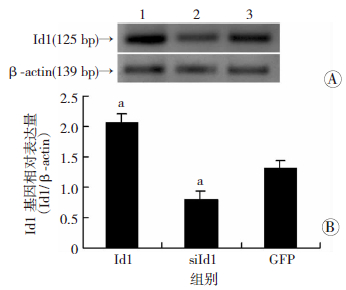 |
| A:RT-PCR检测结果 1:Id1处理组;2:siId1处理组;3:GFP处理组;B:半定量分析结果 a:P<0.05,与GFP处理组比较 图 1 RT-PCR检测MG63细胞感染重组腺病毒3 d后Id1 mRNA的表达 |
 |
| A:Western blot检测结果 1:Id1处理组;2:siId1处理组;3:GFP处理组;B:半定量分析结果 a:P<0.05,与GFP处理组比较 图 2 Western blot检测MG63细胞感染重组腺病毒3 d后Id1蛋白的表达 |
CCK-8实验结果显示:与GFP处理组相比,Id1处理组细胞增殖明显被促进,siId1处理组细胞增殖明显被抑制,感染腺病毒48 h,Id1组D(450)值为2.07±0.06,siId1组D(450)值为1.53±0.07,GFP组D(450)值为1.77±0.09,差异有统计学意义(P<0.05,图 3)。
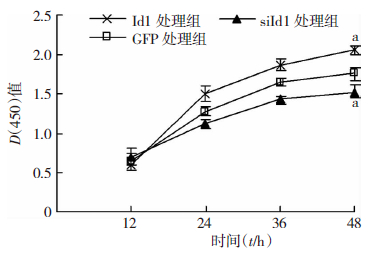 |
| a:P<0.05,与GFP处理组比较 图 3 CCK-8实验检测感染重组腺病毒后MG63细胞的增殖 |
划痕72 h后结果见图 4,Id1处理组划痕愈合率为(83.64±9.50)%,明显高于GFP处理组(51.25±6.37)%(P<0.05),siId1处理组愈合率(24.29±9.87)% 明显低于GFP处理组(P<0.05)。
 |
| 图 4 划痕实验检测感染重组腺病毒3 d的MG63细胞迁移能力 |
细胞接种于Transwell小室72 h后结果见图 5,Id1 处理组穿膜细胞数为(188±12),siId1处理组穿膜细胞数为(70±8),GFP处理组穿膜细胞数为(112±4),Id1处理组MG63细胞侵袭能力明显高于GFP处理组(P<0.05),siId1处理组MG63细胞侵袭能力明显低于GFP处理组(P<0.05)。
 |
| A:Id1处理组;B:siId1处理组;C:GFP处理组 图 5 Transwell实验检测感染重组腺病毒3 d的MG63细胞侵袭能力 (×100) |
结果见图 6,Id1处理组G1期细胞占细胞总数的(47.13±1.65)%,明显低于GFP处理组(67.76±2.25)%(P<0.05),S期占细胞总数的(36.24±1.35)%,明显高于GFP处理组(9.51±0.49)%(P<0.05);siId1处理组G1期细胞占细胞总数的(80.37±2.03)%,高于GFP处理组(67.76±2.25)%(P<0.05),Id1基因过表达可以促进细胞由G1期进入S期,促进细胞增殖,Id1基因沉默后可以促使G1期阻滞,细胞增殖受到抑制。
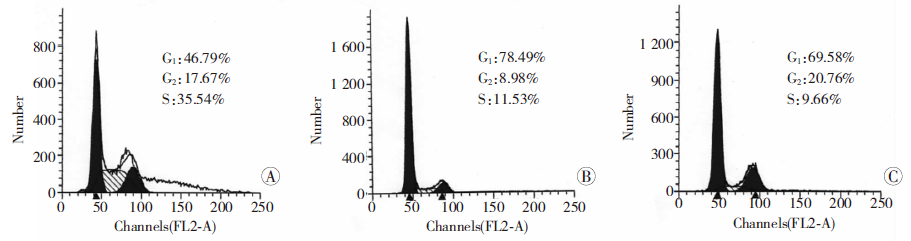 |
| A:Id1处理组;B:siId1处理组;C:GFP处理组 图 6 流式细胞术检测感染重组腺病毒3 d的MG63细胞的细胞周期 |
Id1基因表达抑制后ALP活力明显增高,Id1基因过表达后ALP活力降低。感染重组腺病毒3 d,Id1处理组ALP活力为(1.77±0.10),siId1处理组ALP活力为(4.44±0.08),GFP处理组ALP活力(2.48±0.19),差异有统计学意义(P<0.05)。
3 讨论骨肉瘤好发于青少年,恶性程度高,易于肺转移,疗效不理想,目前关于骨肉瘤发病机制的研究较多,但均无明确结论。有研究认为骨生长过快、染色体异常、抑癌基因异常、转录因子、生长因子、WWOX和miRNAs等在骨肉瘤的发生发展过程中发挥了重要作用[8]。随着医学研究和临床治疗手段的不断进展,其他实体瘤如早期乳腺癌的5年存活率已达90%,而骨肉瘤的疗效近20年均没有明显的改善与提高,由此我们思考骨肉瘤的发病机制和治疗可能不能简单等同于其他组织来源实体瘤,具有其特殊性。本课题组前期研究提示,骨肉瘤是一种“分化病”,类似于急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)的分化性疾病,是骨髓间充质干细胞正常成骨分化异常中断形成的恶性增生物,并且这种异常中断发生越早,形成的骨肉瘤恶性程度越高[9]。这种正常成骨分化的异常中断必然与一系列的基因和信号传导通路表达的紊乱有关。因此,本研究通过基因芯片技术比较了人骨髓间充质干细胞、成骨细胞以及不同分化程度的骨肉瘤细胞间的基因表达差异,发现Id1基因的表达差异明显,提示在骨肉瘤的发生过程中,Id1基因发挥了极其重要的作用,但是对于Id1基因与人骨肉瘤发生发展的关系仍未见明确报道。
分化抑制因子(Id)最早从鼠红白血病细胞cDNA文库中克隆的[10],在哺乳动物体内有Id1-4共4种亚型。生理状态下的Id蛋白多分布于胚胎及分化不成熟的组织细胞中,并且Id蛋白的表达量具有随着组织细胞分化的不断成熟而逐渐降低的特点。研究发现多部位的肿瘤中也存在Id的高表达[11, 12],并证实其不但参与了肿瘤的发生和发展,还与肿瘤的侵袭以及转移灶的形成高度相关,而且其表达情况与肿瘤的分化程度呈高度负相关,进一步提出并证实了Id蛋白的高表达预示肿瘤的预后不良[13]。
本研究选取骨肉瘤研究中应用比较成熟的并且Id1表达量相对较高的骨肉瘤细胞株MG63作为研究对象,以重组腺病毒为目的基因载体,成功实现了Id1在MG63细胞中的过表达,并应用siRNA成功抑制了MG63细胞中的Id1基因的内源性表达,通过此途径调控Id1基因在MG63细胞里的表达量后研究MG63细胞的恶性生物学行为变化。结果显示Id1表达量上调后,MG63细胞的增殖、迁移、侵袭能力均明显增强,并且可以促进细胞由G1期进入S期;Id1表达量下调后MG63细胞的主要恶性生物学行为表现为增殖、迁移、侵袭均受到抑制并且可以促使细胞发生G1期阻滞。说明Id1基因对骨肉瘤的恶性生物学行为具有重要的影响,抑制Id1基因表达可以促使骨肉瘤的恶性生物学行为发生逆转。同时,Id1表达下调后,正常成骨分化早期指标碱性磷酸酶(ALP)表达量明显增高,提示抑制骨肉瘤Id1基因可以逆转肿瘤恶性生物学表型的同时,使其异常中断的成骨分化重新发生。
骨肉瘤是正常成骨分化异常中断导致的疾病,好发于成骨生长活跃的青少年,本研究提示可以通过干预逆转其恶性表型诱导其正常分化。骨髓间充质干细胞正常成骨分化过程的异常中断必然是由一系列基因的异常表达和信号通路的紊乱调节导致的,并且在正常成骨分化过程异常中断后必然还伴随着一系列基因和信号通路的异常表达,进一步造成了骨肉瘤的恶性发展,那么纠正这些基因和信号通路的异常表达和异常调控则有可能阻断骨肉瘤发展,实现骨肉瘤的恶性逆转并促其向正常成骨分化方向转化,达到治疗骨肉瘤的目的。目前已有报道的与骨肉瘤发生发展相关的信号传导通路有Notch信号通路[14]、Wnt/β-catenin信号通路[15, 16]、MAPK信号通路等[17, 18],以及BMP这一经典的骨髓间充质干细胞成骨分化信号通路[19, 20, 21],这些信号传导通路在成骨或成骨肉瘤过程中或多或少与Id有关,但尚无明确的针对骨肉瘤分化调控的报道,Id1与骨肉瘤发生发展的关系亦无明确报道。在本研究中我们初步揭示了BMP信号通路下游的关键蛋白Id1对骨肉瘤恶性生物学行为的影响,并初步探究了通过调控Id1的内源性表达诱导骨肉瘤细胞向正常成骨细胞方向分化的可行性,提示我们靶向调控Id1等关键基因或通路的表达可以实现人骨肉瘤细胞恶性逆转并向正常成骨分化。下一步我们将通过体内实验深入探究Id1基因对人骨肉瘤细胞恶性逆转的调控机制,以及Id1信号传导通路促进骨肉瘤细胞中晚期成骨分化的可行性以及作用机制,以期通过此研究进一步丰富和完善骨肉瘤的发生发展机理,为骨肉瘤的治疗提供新的思路和方法。
| [1] | Osborne T S, Khanna C. A review of the association between osteosarcoma metastasis and protein translation[J]. J Comp Pathol, 2012, 146(2/3): 132-142.DOI:10.1016/j.jcpa.2011.12.007 |
| [2] | Ruden C. Principles and practices of health risk assessment under current EU regulations[J]. Regul Toxicol Pharmacol, 2006, 44(1): 14-23.DOI:10.1016/j.yrtph.2005.04.009 |
| [3] | Wu P K, Chen W M, Chen C F,et al. Primary osteogenic sarcoma with pulmonary metastasis: clinical results and prognostic factors in 91 patients[J]. Jpn J Clin Oncol, 2009, 39(8): 514-522.DOI:10.1093/jjco/hyp057 |
| [4] | Perk J, Iavarone A, Benezra R. Id family of helix-loop-helix proteins in cancer[J]. Nat Rev Cancer, 2005, 5(8): 603-614.DOI:10.1038/nrc1673 |
| [5] | Lasorella A, Uo T, Iavarone A. Id proteins at the cross-road of development and cancer[J]. Oncogene, 2001, 20(58): 8326-8333.DOI:10.1038/sj.onc.1205093 |
| [6] | Dong Z, Liu S, Zhou C, et al. Overexpression of Id-1 is associated with tumor angiogenesis and poor clinical outcome in oral squamous cell carcinoma[J]. Oral Oncol, 2010, 46(3): 154-157.DOI:10.1016/j.oraloncology.2009.11.005 |
| [7] | 谯波, 罗小辑, 姜蓉, 等. 分化抑制因子id1在骨肉瘤中的表达与肺转移、两年生存率的关系[J]. 激光杂志, 2012, 33(2): 67-68.DOI:10.3969/j.issn.0253-2743.2012.02.029. |
| [8] | 赵亚恒, 冯和林, 郑丽华, 等. 骨肉瘤发病机制的研究进展[J]. 肿瘤防治研究, 2014, 41(3): 283-286.DOI:10.3971/j.issn.1000-8578.2014.03.019 |
| [9] | Tang N, Song W X, Luo J, et al. Osteosarcoma development and stem cell differentiation[J]. Clin Orthop Relat Res, 2008, 466(9): 2114-2130.DOI:10.1007/s11999-008-0335-z |
| [10] | Benezra R, Davis R L, Lockshon D, et al. The protein Id: a negative regulator of helix-loop-helix DNA binding proteins[J]. Cell, 1990, 61(1): 49-59. |
| [11] | Han S, Gou C, Hong L, et al. Expression and significances of Id1 helix-loop-helix protein overexpression in gastric cancer[J]. Cancer Lett, 2004, 216(1): 63-71. |
| [12] | Fong S, Debs R J, Desprez P Y. Id genes and proteins as promising targets in cancer therapy[J]. Trends Mol Med, 2004, 10(8): 387-392.DOI:10.1016/j.molmed.2004.06.008 |
| [13] | Wang Q, Tsao S W, Fu S, et al. Overexpression of Id-1 in gastric adenocarcinoma: implication for a novel diagnostic marker[J]. Anticancer Res, 2004, 24(2B): 881-886. |
| [14] | Mu X, Isaac C, Greco N, et al. Notch signaling is associated with ALDH activity and an aggressive metastatic phenotype in murine osteosarcoma cells[J]. Front Oncol, 2013, 3: 143. DOI:10.3389/fonc.2013.00143 |
| [15] | Cai Y, Mohseny A B, Karperien M, et al. Inactive Wnt/beta-catenin pathway in conventional high-grade osteosarcoma[J]. J Pathol, 2010, 220(1): 24-33. DOI:10.1002/path.2628 |
| [16] | Li C, Shi X, Zhou G, et al. The canonical Wnt-beta-catenin pathway in development and chemotherapy of osteosarcoma[J]. Front Biosci (Landmark Ed), 2013, 18: 1384-1391. |
| [17] | Zhang Y, Tang Y J, Li Z H, et al. KiSS1 inhibits growth and invasion of osteosarcoma cells through inhibition of the MAPK pathway[J]. Eur J Histochem, 2013, 57(4): e30. |
| [18] | Tingting R, Wei G, Changliang P, et al. Arsenic trioxide inhibits osteosarcoma cell invasiveness via MAPK signaling pathway[J]. Cancer Biol Ther, 2010, 10(3): 251-257. |
| [19] | Lv Z, Yang D, Li J, et al. Bone morphogenetic protein 9 overexpression reduces osteosarcoma cell migration and invasion[J]. Mol Cells, 2013, 36(2): 119-126. DOI:10.1007/s10059-013-0043-8 |
| [20] | Geller D S, Singh M Y, Zhang W, et al. Development of a Model System to Evaluate Local Recurrence in Osteosarcoma and Assessment of the Effects of Bone Morphogenetic Protein-2[J]. Clin Cancer Res, 2015, 21(13): 3003-3012. DOI:10.1158/1078-0432.CCR-14-0986 |
| [21] | Mortus J R, Zhang Y, Hughes D P. Developmental pathways hijacked by osteosarcoma[J]. Adv Exp Med Biol, 2014, 804: 93-118. DOI:10.1007/978-3-319-04843-7_5 |



