放射治疗是晚期肿瘤主要的治疗手段,但放疗抵抗的现象普遍存在。APE1/Ref-1,DNA损伤修复和氧化还原(redox)双功能基因,作为提高放射治疗敏感性的靶点已经被广泛证实,但具体机制还在探索中[1]。APE1是一个多功能蛋白,具有氧化还原一些转录因子(如p53、AP-1、PTEN、NF-κb等)和DNA 碱基损伤修复的功能。乙酰化、磷酸化、泛素化都是APE1翻译后修饰的方式,但APE1乙酰化修饰尤为重要。APE1的N末端有多个位点能被乙酰化转移酶修饰[2],尤其K6/K7位点的乙酰化修饰与APE1多种活性密切相关,如与nCaRE序列、YB-1介导的MDR1基因激活和BER功能密切相关[3]。自噬是细胞的一种适应性反应,应激刺激时细胞自我吞噬和降解细胞内的长寿蛋白和细胞器,从而维持细胞存活。细胞自噬与肿瘤的发生、发展、治疗存在密切的关系。为了探索APE1乙酰化与电离辐射(ionizing radiation,IR)诱导的细胞自噬之间的关系,本研究采用IR处理,观察HeLa细胞APE1乙酰化水平、细胞自噬水平的变化及可能的机制,为APE1作为放射治疗的靶点提供进一步的理论依据。
1 材料与方法 1.1 主要材料与试剂人宫颈癌HeLa 细胞、APE1WT和APE1K6R/K7R细胞由第三军医大学大坪医院野战外科研究所胸外科实验室惠赠,大坪医院肿瘤中心实验室传代保存。免疫兔血清IgG、免疫小鼠血清IgG购自Sigma 公司,protein A/G-agaroseresin购自Beyotime 公司,自噬检测染色试剂盒购自ENZO 公司,ECL 检测试剂盒、HRP 标记羊抗小鼠IgG 抗体、HRP 标记羊抗兔IgG 抗体购自Santa Cruz 公司,兔抗人LC3、p62和AC-APE1(APE1乙酰化 APE1 acetylation AC-APE1)多克隆抗体,兔抗人APE1 多克隆抗体、鼠抗人APE1单克隆抗体购自Abcom公司。
1.2 细胞培养和电离辐射用含10% 胎牛血清,100 μg/mL青、链霉素的DMEM培养基,37℃、5%CO2,常规传代培养HeLa 细胞、APE1WT和APE1K6R/K7R细胞,用1 μg/mL doxycycline(DOX)的α-MEM培养基诱导APE1WT和APE1K6R/K7R细胞。培养细胞贴壁密度约80%,用Elekta pricise直线加速器(Elekta,瑞典)照射细胞。
1.3 流式细胞术检测细胞周期接种处于对数生长期HeLa细胞,给予0、2、4 Gy剂量的IR,用ENZO 自噬检测试剂盒染色后流式细胞仪检测。重复实验3次。
1.4 Western blot 检测蛋白表达用上样缓冲液稀释蛋白样品,电泳165 V在聚丙烯酰胺凝胶分离蛋白,用NC膜湿法400 mA 转印,分别与单克隆抗体及HRP偶联二抗孵育,用Super Signal West Pico Chem I luminescent Substrate 试剂盒化学发光,胶片显影。重复实验3 次。
1.5 免疫共沉淀(Co-IP)用IP 细胞裂解液冰上裂解细胞,测定蛋白浓度。取蛋白样品和种属相同的IgG 与重悬的protein A+G agarose,4℃摇动30 min,上清加入一抗,4℃过夜,次日吸取protein A+ G agarose上清。上样缓冲液重悬,100℃蛋白变性。重复实验3 次。
1.6 免疫荧光标记结合激光共聚焦显微镜观察接种APE1WT和APE1K6R/K7R细胞,固定,打孔,漂洗,封闭;附LC3 抗体,4℃过夜;FITC 绿光标记,37℃孵育1 h,含有DAPI的封片剂封片,第三军医大学中心实验室激光共聚焦室照相。重复实验3 次。
1.7 统计学分析采用SPSS 17.0统计软件,IR后A549细胞内AC-APE1、LC3、p62蛋白表达水平以x±s表示,采用单因素方差分析比较多组间均数。
2 结果 2.1 电离辐射促进HeLa细胞APE1乙酰化修饰为了探索电离辐射与APE1乙酰化修饰之间的关系,以2 Gy剂量照射HeLa细胞后 0、6、12、24 h和0、2、4 Gy剂量照射2 h后,发现HeLa细胞AC-APE1随着照射后时间的推移和照射剂量的增加而逐渐上调,各时间段与0 h比较,各剂量与0 Gy剂量比较,差异均有统计学意义(P<0.01),呈现出时间依赖性和剂量依赖性。见图 1。
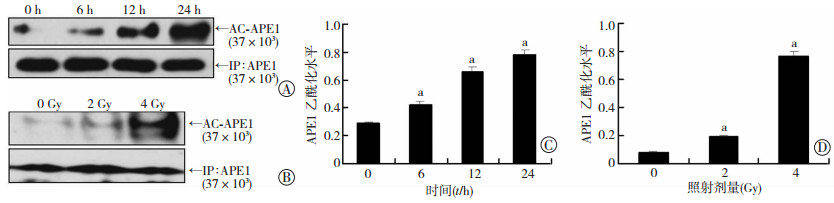 |
| A:2 Gy剂量照射处理HeLa细胞0、6、12、24 h后Co-IP检测APE1乙酰化水平;B:0、2、4 Gy剂量照射HeLa细胞2 h后Co-IP检测APE1乙酰化水平;C:不同时间APE1乙酰 化水平半定量分析;a:P<0.01,与0 h比较;D:不同剂量APE1乙酰化水平半定量分析;a:P<0.01,与0 Gy剂量比较图 1 电离辐射促进HeLa细胞APE1乙酰化修饰 |
照射HeLa细胞0、2、4 Gy剂量2 h后,LC3Ⅱ的表达与照射剂量呈正相关,而p62与LC3Ⅱ趋势相反,与0 Gy剂量比较,差异有统计学意义(P<0.01)(图 2A~D),流式细胞仪检测结果显示,0、2、4 Gy剂量相应的自噬诱导百分数:1.4%、3.5%、8.4%(图 2E),与Western blot 的结果相吻合。 免疫荧光激光共聚焦证实电离辐射后,LC3的聚集(绿色)明显增加(图 3)。这些结果显示电离辐射诱导细胞自噬,具有剂量依赖性。
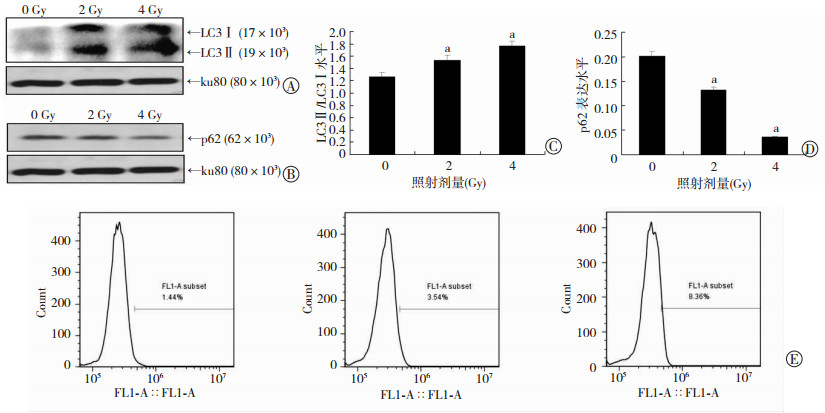 |
| A、B:0、2、4 Gy剂量照射HeLa细胞2 h后Western blot 检测LC3和p62的表达;C:LC3Ⅱ/LC3Ⅰ半定量分析 a:P<0.01,与0 Gy 剂量比较;D:p62表达半定量分析 a:P<0.01,与0 Gy剂量比较;E:0、2、4 Gy剂量照射HeLa细胞24 h后流式细胞仪检测细胞自噬水平图 2 电离辐射促进HeLa细胞自噬 |
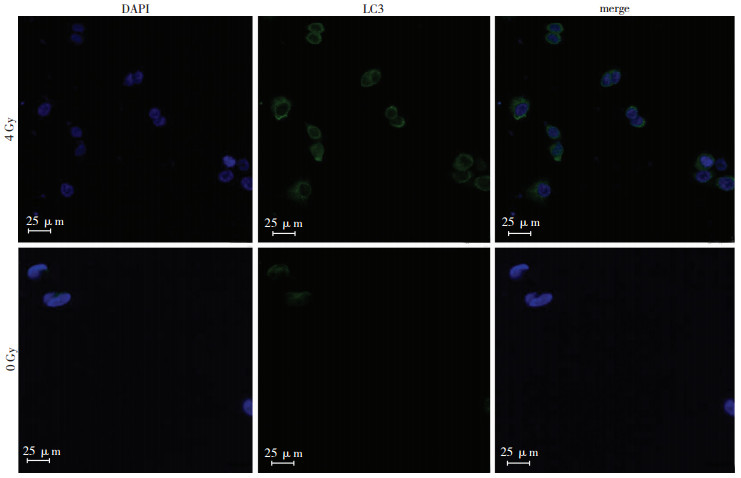 |
| 利用LC3抗体和FITC-Green-标记的二抗检测LC3的聚集(绿色),DAPI作为细胞核染料(蓝色),merge为融合图图 3 0、4 Gy剂量照射HeLa细胞2 h后激光共聚焦显微镜观察LC3的聚集 |
为了证明APE1乙酰化调节电离辐射诱导的细胞自噬,利用APE1 内源性敲低组(CL3)和对照组(SCR)的HeLa细胞,并在此基础上构建HeLa 子系细胞,K6/K7 位点突变的APE1K6R/K7R和对照组APE1WT,APE1K6R/K7R乙酰化水平明显低于APE1WT组。APE1K6R/K7R 细胞LC3Ⅱ 表达水平低于对照组,与APE1WT组比较,差异有统计学意义(P<0.01);电离辐射后,LC3Ⅱ表达上调;而p62 的表达始终与LC3Ⅱ呈负相关,与照射后的APE1WT组比较,差异有统计学意义(P<0.01)。同上述处理,CO-IP结果显示,APE1K6R/K7R 细胞促进Beclin1/Bcl2的相互结合,电离辐射抑制Beclin1/Bcl2的结合。见图 4。
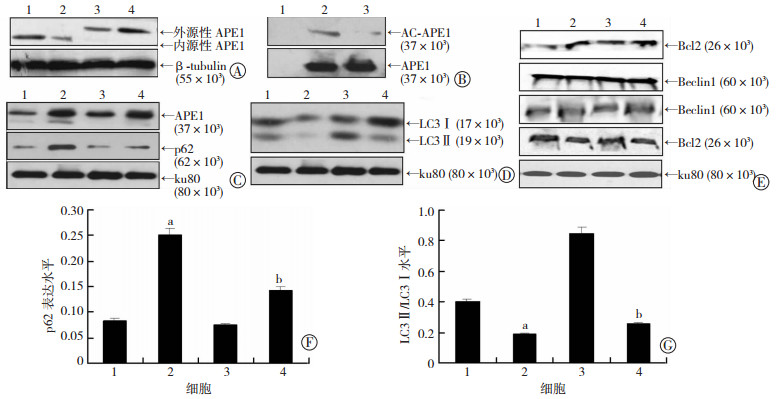 |
| A:Western blot检测APE1表达 1:APE1敲低(CL3)细胞;2:对照(SCR)细胞;3:APE1K6R/K7R 细胞;4:对照APE1WT细胞;B:CO-IP 检测AC-APE1水平 1:IGg;2:APE1WT 细胞;3:APE1K6R/K7R 细胞;C、D: Western blot检测APE1、LC3和p62表达;E:CO-IP检测Beclin1/Bcl2的相互作用;F:p62表达半定量;G:LC3Ⅱ/LC3Ⅰ蛋白半定量 1:APE1WT细胞;2:APE1K6R/K7R 细胞;3:4 Gy剂量照 射APE1WT细胞;4:4 Gy剂 量照射APE1K6R/K7R 细胞;a:P<0.01,与APE1WT细胞比较;b:P<0.01,与4 Gy剂量照射APE1WT细胞比较图 4 APE1乙酰化修饰调控HeLa细胞自噬水平 |
APE1是小鼠胚胎存活不可或缺的基因,APE1的表达水平与肿瘤放化疗抵 抗之间存在密切的联系,如抑制APE1氧化还原功能增强细胞对氧化应激的敏感性[4],而APE1又是碱基切除修饰(base excision repair,BER)的限速酶,APE1的高表达抵抗肿瘤治疗诱导的DNA损伤[2]。APE1乙酰化修饰是APE1最重
要的翻译后修饰形式,与APE1氧化还原和碱基切除修复功能密切相关[5]。APE1-K6/K7 位点的乙酰化调节APE1 蛋白的AP 内切酶活性,并通过改变APE1 与BER相关蛋白(如XRCC1)的相互作用调节细胞BER 活性[6]。最近的研究提出,氧化应激和DNA损伤反应诱导细胞自噬[7],但APE1乙酰化与细胞自噬之间的关系还不清楚。
本实验首先通过Co-IP的方法检测APE1乙酰化,发现APE1乙酰化水平随着电离辐射剂量的增加和照射后时间的延长而增加(图 1)。Lirussi等[8]认为,基因毒性应激促进APE1乙酰化,并参与调节BER活性。接着,本实验通过观察LC3Ⅱ/LC3Ⅰ和p62的表达检测自噬活性,发现随着电离辐射剂量的增加LC3Ⅱ/LC3Ⅰ不断增加,而p62表达下调,然后通过流式细胞仪和免疫荧光的方法进一步证实,电离辐射促进细胞自噬水平(图 2、3)。电离辐射后释放大量活性氧(reactive oxygen species,ROS)对细胞造成广泛和持久的DNA 氧化性损伤,从而激活细胞自噬。Liang等[9]在多种细胞中报道了相同的结果。最后,本实验通过APE1-K6/K7 位点突变的APE1K6R/K7R细胞调控APE1乙酰化,发现APE1K6R/K7R细胞自噬活性明显抑制,电离辐射后,APE1K6R/K7R细胞自噬活性明显低于对照组(图 4)。APE1-K6/K7 位点突变抑制BER活性,促进DNA损伤,为了维持DNA合成、稳定,BER活性在自噬的启动上发挥关键的作用[10]。但Shan等[11]报道了APE1主要乙酰化位点突变明显的增加细胞ROS水平,在饥饿诱导的细胞自噬中ROS是最佳的诱导剂。然而APE1K6R/K7R细胞自噬水平却低于对照组,可能因为APE1乙酰化主要通过调控DNA损伤反应调控细胞自噬。本实验发现APE1K6R/K7R细胞促进Bcl2/Beclin1的相互作用(图 4),Bcl2/Beclin1的结合是自噬主要的负向调控途径。Zhao等[12]报道APE1/Bcl2通过BH位点相互作用抑制BER活性,进一步验证了APE1乙酰化通过调节BER活性,改变DNA损伤反应诱导的细胞自噬。本研究结果显示,电离辐射促进APE1乙酰化,通过抑制BER活性促进DNA损伤诱导的细胞自噬。以上结果表明,APE1-K6/K7 位点突变通过促进Bcl2/Beclin1的结合抑制细胞自噬。
总之,本研究结果提示电离辐射促进APE1 乙酰化修饰,并提高细胞自噬水平。应用APE1乙酰化关键位点的突变可以抑制电离辐射诱导的细胞自噬水平。今后,APE1乙酰化调节细胞自噬的机制需要进一步深入研究。
| [1] | Raffoul J J, Banerjee S, Singh-Gupta V, et al. Down-regulation of apurinic/apyrimidinic endonuclease 1/redox factor-1 expression by soy isoflavones enhances prostate cancer radiotherapy in vitro and in vivo[J]. Cancer Res, 2007, 67(5): 2141-2149. DOI:10.1158/0008-5472.CAN-06-2147 |
| [2] | Robertson K A, Bullock H A, Xu Y, et al. Altered expression of Ape1/ref-1 in germ cell tumors and overexpression in NT2 cells confers resistance to bleomycin and radiation[J]. Cancer Res, 2001, 61(5): 2220-2225. |
| [3] | Poletto M, Di-Loreto C, Marasco D, et al. Acetylation on critical lysine residues of Apurinic/apyrimidinic endonuclease 1 (APE1) in triple negative breast cancers[J]. Biochem Biophys Res Commun, 2012, 424(1): 34-39. DOI:10.1016/j.bbrc.2012.06.039 |
| [4] | Wang Y T, Tzeng D W, Wang C Y, et al. APE1/Ref-1 prevents oxidative inactivation of ERK for G1-to-S progression following lead acetate exposure[J]. Toxicology, 2013, 305: 120-129. DOI:10.1016/j.tox.2013.01.010 |
| [5] | Yamamori T, DeRicco J, Naqvi A, et al. SIRT1 deacetylates APE1 and regulates cellular base excision repair[J]. Nucleic Acids Res, 2010, 38(3): 832-845. DOI:10.1093/nar/gkp1039 |
| [6] | Bhakat K K, Izumi T, Yang S H, et al. Role of acetylated human AP-endonuclease (APE1/Ref-1) in regulation of the parathyroid hormone gene[J]. EMBO J, 2003, 22(23): 6299-6309. DOI:10.1093/emboj/cdg595 |
| [7] | Munoz-Gamez J A, Rodriguez-Vargas J M, Quiles-Perez R, et al. PARP-1 is involved in autophagy induced by DNA damage[J]. Autophagy, 2009, 5(1): 61-74. |
| [8] | Lirussi L, Antoniali G, Vascotto C, et al. Nucleolar accumulation of APE1 depends on charged lysine residues that undergo acetylation upon genotoxic stress and modulate its BER activity in cells[J]. Mol Biology Cell, 2012, 23(20): 4079-4096. DOI:10.1091/mbc.E12-04-0299 |
| [9] | Liang N, Jia L, Liu Y, et al. ATM pathway is essential for ionizing radiation-induced autophagy[J]. Cell Signal, 2013, 25(12): 2530-2539. DOI:10.1016/j.cellsig.2013.08.010 |
| [10] | Pan Y Z, Wang X, Bai H, et al. Autophagy in drug resistance of the multiple myeloma cell line RPMI8226 to doxorubicin[J]. Genet Mol Res, 2015, 14(2): 5621-5629. DOI:10.4238/2015.May.25.14 |
| [11] | Shan J L, He H T, Li M X, et al. APE1 promotes antioxidant capacity by regulating Nrf-2 function through a redox-dependent mechanism[J]. Free Radic Biol Med, 2015, 78: 11-22. DOI:10.1016/j.freeradbiomed.2014.10.007 |
| [12] | Zhao J, Gao F, Zhang Y, et al. Bcl2 inhibits abasic site repair by down-regulating APE1 endonuclease activity[J]. J Biol Chem, 2008, 283(15): 9925-9932. DOI:10.1074/jbc.M708345200 |



