2. 063000 河北 唐山,华北理工大学附属医院口腔科;
3. 610041 成都,四川大学华西口腔医学院口腔疾病研究国家重点实验室
2. Department of Stomatology, Affiliated Hospital of North China University of Science and Technology, Tangshan, Hebei Province, 063000;
3. State Key Laboratory of Oral Diseases, West China Stomatological College, Sichuan University, Chengdu, Sichuan Province, 610041, China
口腔鳞癌(oral squamous cell carcinoma,OSCC)是头颈部最常见的恶性肿瘤。目前,化疗仍是肿瘤治疗的主要手段之一,但是化疗过程中药物诱导肿瘤组织多药耐药的形成严重影响肿瘤治疗的效果,肿瘤耐药性一旦形成很难被逆转,并意味着治疗的失败[1]。传统对标记物检测手段是单一的,而代谢组学可以提供多个新的生物标记物,相比传统的方法具有更广的预测性。Goldsmith等[2]对代谢组学的未来做了展望,他认为代谢组学在临床疾病诊断有重要的作用,通过对疾病的分析得到具体的指纹图谱有助于评估疾病的进程和追踪治疗。目前将代谢组学方法运用到肿瘤细胞耐药性的监测还鲜见报道。因此,本实验以口腔鳞癌Tca8113细胞系以及前期实验中构建的耐药细胞Tca8113/CBP为实验对象,运用基于氢谱核磁共振(1H nuclear magnetic resonance,1H NMR)的代谢组学方法[3]分析亲本细胞和耐药细胞胞外代谢产物的变化,寻找差异代谢物,为今后临床研究提供实验依据。
1 材料与方法 1.1 细胞株、主要仪器与试剂人口腔鳞癌Tca813细胞株(四川大学华西口腔医学院口腔疾病研究国家重点实验室提供)。耐化疗药物卡铂(carboplatin,CBP)的Tca8113细胞株 (Tca8113/CBP)(课题组前期实验),重水(D2O,99.8%,Norell Inc.,USA,Cat.014100.2040),直径5 mm核磁管(Landisville,NJ,USA),-80 ℃低温冰箱(Heto Ultra公司,美国),DRX600核磁共振仪(Bruker Biospin Rheinstetten公司,德国)。
1.2 胞外代谢产物样本的制备2个细胞株Tca813和Tca8113/CBP在无药培养基中正常生长和传代后,待细胞铺满培养瓶底80% 左右进行消化,分别制成单细胞悬液。调整为 2×104/mL 的单细胞悬液,接种到6 cm平皿,每个平皿1 mL培养基。培养72 h后,吸取培养液,低温高速离心,4 ℃,15 000 r/min,离心10 min。取上清1 mL加入1/2体积的0.2 mol/L磷酸盐缓冲液,混匀后静置10 min。再次以4 ℃,15 000 r/min,离心10 min,取上清500 μL,加入重水250 μL,混匀后取500 μL移入已 灭菌的直径为5 mm的核磁管,密封管口,置于-80 ℃ 低温冰箱保存。测试前取出,解冻并保持在0 ℃左右。
1.3 核磁共振数据采集和处理本实验采用600 MHz氢谱核磁共振(1H NMR)对样品进行检测,在600 MHz核磁共振波谱仪上调用cpmgpr1d脉冲序列,设置参数为:谱宽12 335.526 Hz,采样点数32 K,叠加次数为64次,饱和频率和中心频率均在水峰位置。样本扫描温度为300 K,每个样本经扫描均收集到65 536个数据点,最终经检测得到所测样本的原始自由感应衰减信号(free induction decay,FID)。然后运用MestReC v4.8.8.1软件(Mestrelab Research公司,西班牙)对这些FID数据进行傅立叶转换(fourier transform,FT)得到原始的核磁共振图谱,再进行相位调整和基线校正,并参照乳酸(lactic acid)甲基双重信号峰值的化学位移定为δ 1.33,以此对化学位移进行定标,获得相位满意、对称性较好的1H-NMR图谱。调用软件工具中的Bucketing Integration对NMR图谱以δ 0.04 为一个积分区间进行分段积分,积分区域选定在δ 0.0~10.0,移除水峰所在的δ 4.5~4.8,得到242个对应的积分值。将32个样本的1H-NMR图谱都进行同样的分段积分,最后生成1个32×242的数据矩阵。将这些数据导入到Excel文件中保存。
1.4 数据分析通常以核磁共振为测量手段获得的数据具有多元性和复杂性,很难直接分析,需要采用模式识别的方法进行数据降维,然后再进行聚类分析和生物标志物的寻找。无监督的主成分分析(principal components analysis,PCA)和有监督的偏最小二乘判别分析(PLS-DA)是模式识别中两种常用的方法[4]。虽然运用PCA有一定的分类效果,但往往有较多重叠,而且在组内聚 集和组间离散方面分析效果明显弱于PLS-DA。因此,本实验采用有监督的模式识别方法PLS-DA,一方面能对高维数据进行简化和降维,另一方面又可放大组间差异,在代谢组学相关研究的数据分析中尤为多见[5]。
在建立PLS-DA监督性的统计模型时,因事先需要对样本分组,所以需应用响应置换检验(response permutation test)来判断模型是否发生过度拟合现象,以避免监督性模型所获得分类结果的偶然性。通常将验证后得到的R2和Q2回归直线与Y轴的截距作为衡量所建模型是否发生了过度拟合现象,一般要求Q2的截距应小于0。而且R2和Q2的数值越趋近1说明所建立的模型越稳定可靠,一般来说该数值大于0.5就可以说明模型较好。
本实验运用SIMCA-P v11.0软件(Umea公司,瑞典)对存有所有积分值的整个Excel文件进行偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)。结合权系图(coefficient)和变量权重重要性数值(variable importance in projection,VIP),筛选出对组间区分贡献相对较大的差异性变量[6],运用网上代谢物分析工具(www.metaboanalyst.ca)对这些变量的浓度采用非配对Student’t-test进行单维P检验。只有同时满足VIP>1.0和单维统计P < 0.05的代谢物才是最终差异代谢物。
2 结果 2.1 核磁共振图谱结果实验中对所有样本中水峰进行压制,处理后获得了待测样本的核磁图谱(图 1)。通过观察发现比较明显的化学信号集中在δ 1.20~5.40区间内,将耐药细胞和非耐药细胞的代谢图谱进行比较可见:每个1H NMR图谱都有一个残留水峰信号(δ 4.70),δ 3.20~3.90这段区间主要为糖基类化合物;亲本Tca8113的醋酸盐(δ 1.90)波峰相对于乳酸(δ 1.33)的波峰要低,而耐药细胞Tca8113/CBP的代谢图谱则出现 了相反的情况。另外,Tca8113/CBP的代谢图谱在δ 3.20~ 3.90区间内的波峰也有明显的变化,说明耐药细胞和亲本细胞之间在代谢上存在差异。
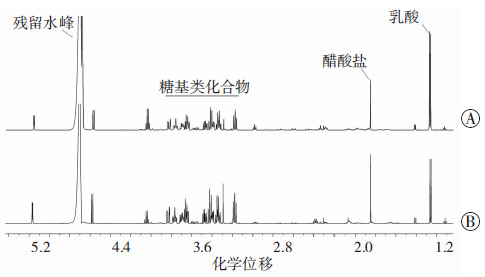 |
| A:亲本Tca8113细胞;B:耐药细胞Tca8113/CBP 图 1 1H-NMR图谱 |
在进行数据分析时,R2X,R2Y和Q2Y作为评价模型质量好坏的参数,其中R2X和R2Y分别代表模型对X和Y矩阵的解释程度,而Q2Y代表模型的累积预测能力,Q2Y越接近1表明模型越有效。本实验采用PLS-DA的多维统计分析方法对亲本和耐药细胞的1H NMR代谢图谱进行分析,其中R2X=0.662,R2Y=0.959,Q2Y=0.916,说明所建立模型效果很好。图 2A是PLS-DA中预测成分1 (PLS1)对预测成分2(PLS2)所作的得分图,从中可以清楚地区分Tca8113和Tca8113/CBP,虽然耐药细胞Tca8113/CBP较为分散,但是Tca8113和Tca8113/CBP之间并无明显的交叉与重叠。
 |
| A:得分图;B:响应置换检验图;C:变量权重重要性图;D:权系图 图 2 偏最小二乘判别分析中的相关图 |
图 2B是经过100次响应置换检验后所得,其中R2=0.959,Q2=0.916,并且Q2回归直线与Y轴的截距为-0.417,说明模型稳定、可靠。从图 2C可以得到具体的变量权重重要性数值(variable importance in projection,VIP),这些数值反映了各变量对组间区分的相对贡献大小。图 2D是权系图,评价了VIP 的可靠度,本实验结合1H-NMR图谱中比较明显的变化,同时选取对组间判别的贡献率(VIP>1.0)及可信性值均较高的变量8个,这些变量是多维统计分析得到的有差异的代谢物,其所在的化学位移及VIP值见表 1。为了验证多维统计结果,运用网上代谢物分析工具对这些变量的浓度采用非配对Student’t检验进行单维P检验,结果显示丙氨酸、缬氨酸和乳酸3个代谢物浓度变化差异没有统计学意义(P>0.05); 而醋酸盐 (VIP=2.99),牛磺酸(VIP=2.00),丝氨酸(VIP=1.35),葡萄糖(VIP=2.01)和亮氨酸(VIP=2.20)这些代谢物浓度差异有统计学意义(P < 0.05)。
| 代谢物 | 化学位移 | 耐药细胞与亲本细胞比较 | ||
| 变量权重值 | P值 | 含量变化 | ||
| 醋酸盐 | δ 1.91 | 2.99 | <0.000 1 | -2.235 5 |
| 牛磺酸 | δ 3.43 | 2.00 | <0.000 1 | 1.869 |
| 丝氨酸 | δ 3.95 | 1.35 | <0.000 1 | 1.749 1 |
| 葡萄糖 | δ 3.83 | 2.01 | <0.000 1 | 1.370 4 |
| 亮氨酸 | δ 1.71 | 2.20 | <0.05 | -1.017 |
| 丙氨酸 | δ 1.46 | 1.93 | >0.05 | -0.613 26 |
| 缬氨酸 | δ 1.04 | 1.70 | >0.05 | -0.239 97 |
| 乳酸 | δ 1.33 | 1.07 | >0.05 | -0.102 98 |
另外,还得到了这些代谢物在Tca8113和 Tca8113/CBP之间的倍数变化(fold change,FC),往往差异代谢物的选取一般设置至少2个阈值,经常使用的筛选阈值是表达量变化超过2倍,即|log2(FC)|>log2(2)=1。表 1中的含量变化指的是具体的log2(FC)值,从中可以看到醋酸盐、牛磺酸、丝氨酸、葡萄糖和亮氨酸的|log2(FC)|均大于1,和我们设定的VIP>1.0和单维统计P < 0.05得到的结果是一致的。
图 3显示了亲本细胞Tca8113 和耐药细胞Tca8113/CBP中差异代谢物的浓度变化,发现在Tca8113/CBP的胞外代谢物中醋酸盐和亮氨酸的浓度升高了,而牛磺酸、丝氨酸和葡萄糖浓度都有一定的降低。
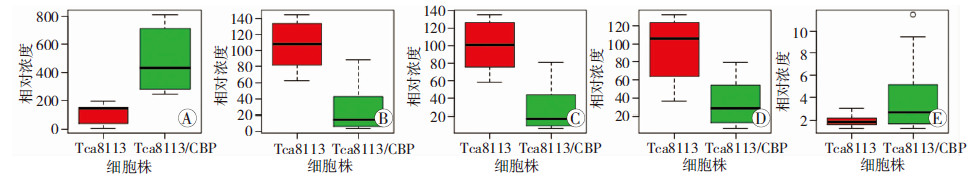 |
| A:醋酸盐浓度变化;B:牛磺酸浓度变化;C:丝氨酸浓度变化;D:葡萄糖浓度变化;E:亮氨酸浓度变化 图 3 亲本Tca8113 细胞和耐药细胞Tca8113/CBP之间差异代谢物的浓度变化盒形图 |
代谢组学是一门通过组群指标分析,进行高通量检测和数据处理,研究生物体整体或组织细胞系统的动态代谢变化,特别是对内源代谢、遗传变异、环境变化乃至各种物质进入代谢系统的特征和影响的学科。和其他被定义的三大“组学”技术一样,代谢组学已经成为系统生物学的一个重要组成部分。它的优点是可以更全面地解释实验数据[7],进一步完善了系统生物学的技术平台,而且它与其他组学的结合对阐明生命的奥妙具有重要的意义。
本实验运用基于氢谱核磁共振(1H-nuclear magnetic resonance,1H-NMR)的代谢组学方法分析亲本Tca8113细胞和诱导后的耐药细胞Tca8113/CBP胞外代谢产物的变化,将同时满足VIP>1.0和单维统计P < 0.05的代谢物认定为最终的差异代谢物,主要是醋酸盐、牛磺酸、丝氨酸、葡萄糖和亮氨酸,涉及到了蛋白质代谢、糖代谢和三羧酸循环。肿瘤细胞具有无限制增殖能力,而耐药的肿瘤细胞是克服了某些不利因素形成的,这个过程中涉及了某些基因和蛋白的异常表达,因此相比肿瘤细胞具有更强的增殖能力。本实验中发现耐药细胞Tca8113/CBP的胞外代谢物中醋酸盐增加,而葡萄糖下降,可能是Tca8113/CBP比亲本Tca8113更多地摄取了葡萄糖来维持自身的能量需要,从糖酵解的角度来讲,Tca8113/CBP应该生成更多的乳酸,而我们发现二者的乳酸代谢水平没有统计学差异,这很有可能是醋酸盐引起的,耐药肿瘤细胞通过代谢产生了过多的醋酸盐,而醋酸盐会转化为碳酸氢盐,进而中和过多的酸,使得细胞免受过高浓度的酸造成的毒性影响。
氨基酸是生命活动中最基本的物质,是生命代谢的物质基础,与正常组织或细胞一样,肿瘤细胞生长也需要充足的糖类和蛋白质等能源物质。肿瘤细胞对氨基酸的需求远大于正常组织,现已证实肿瘤细胞摄取利用氨基酸的速度明显快于正常细胞,使宿主某些氨基酸的含量降低[8]。牛磺酸是调节机体正常生理活动的活性物质,具有维持机体渗透压平衡、提高机体免疫能力、增强细胞膜抗氧化能力、保护心肌细胞等广泛的生物学作用[9]。丝氨酸是多种生物合成通路的中间体,对于生物体生理和代谢过程具有不可替代的作用[10]。本研究结果发现在Tca8113/CBP的胞外代谢物中牛磺酸和丝氨酸的浓度降低,可能由于耐药细胞比亲本Tca8113细胞发生了更加明显的代谢异常,造成细胞过多地摄取这些氨基酸来满足它们的生命活动。Lee等[11]对肝癌细胞的研究发现细胞对牛磺酸、精氨酸等氨基酸的消耗明显增加。同时,本研究还发现Tca8113/CBP的胞外代谢物中亮氨酸的浓度也有一定浓度的增加,但是总体水平都比较偏低。现已知道亮氨酸是一种人体所必需的支链氨基酸,它可以调控蛋白质、糖类和脂肪三大营养物质的代谢,尤其重要的是它可以调控机体的蛋白质周转[12]。
在后基因组时代,代谢组学正在显示出其强劲的应用潜力,它可以适用于生物技术的各个领域。然而,至今国内外对于真核细胞的代谢组学研究还不是很多,因此,后续研究还将继续分析胞内代谢物的变化来综合评价肿瘤细胞产生耐药性前后的差异。总之,肿瘤细胞的恶性发展与其代谢动力学改变是分不开的。希望本研究中所发现的这些代谢物的变化对于肿瘤治疗能起到一定的指导意义。一些在代谢中消耗比较多的氨基酸无论是将氨基酸引入抗肿瘤药物分子中,还是制成氨基酸衍生药物都可以提高其对肿瘤细胞的选择性,进而达到杀死肿瘤细胞的目的;或者同时结合几种升高或降低的代谢物综合分析来达到对耐药肿瘤细胞及时监测和诊断,为今后临床研究提供实验依据。
| [1] | Chen J, Lu L, Feng Y, et al. PKD2 mediates multi-drug resistance in breast cancer cells through modulation of P-glycoprotein expression. Cancer Lett, 2011, 300(1): 48-56. DOI:10.1016/j.canlet.2010.09.005 |
| [2] | Goldsmith P, Fenton H, Morris-Stiff G, et al. Metabonomics: a useful tool for the future surgeon. J Surg Res, 2010, 160(1): 122-132. DOI:10.1016/j.jss.2009.03.003 |
| [3] | Zhang A H, Sun H, Qiu S, et al. NMR-based metabolomics coupled with pattern recognition methods in biomarker discovery and disease diagnosis. Magn Reson Chem, 2013, 51(9): 549-556. DOI:10.1002/mrc.3985 |
| [4] | Xu W, Wang H, Chen G, et al. (1)H NMR-based metabonomics study on the toxicity alleviation effect of other traditional Chinese medicines in Niuhuang Jiedu tablet to realgar (As2S2) . J Ethnopharmacol, 2013, 148(1): 88-98. DOI:10.1016/j.jep.2013.03.073 |
| [5] | 贾伟. 医学代谢组学. 上海:上海科学技术出版社, 2011: 193-218. |
| [6] | Kong X, Yang X, Zhou J, et al. Analysis of plasma metabolic biomarkers in the development of 4-nitroquinoline-1-oxide-induced oral carcinogenesis in rats. Oncol Lett, 2015, 9(1): 283-289. DOI:10.3892/ol.2014.2619 |
| [7] | Aurich M K, Paglia G, Rolfsson O, et al. Prediction of intracellular metabolic states from extracellular metabolomic data. Metabolomics, 2015, 11(3): 603-619. DOI:10.1007/s11306-014-0721-3 |
| [8] | Qiu F, Huang J, Sui M. Targeting arginine metabolism pathway to treat arginine-dependent cancers. Cancer Lett, 2015, 364(1): 1-7. DOI:10.1016/j.canlet.2015.04.020 |
| [9] | 李大庆, 吴明均, 胡晓华, 等. 牛磺酸研究进展. 现代生物医学进展, 2011, 11(2): 390-392. |
| [10] | Furuya S. An essential role for de novo biosynthesis of L-serine in CNS development. Asia Pac J Clin Nutr, 2008, 17(Suppl 1): 312-315. |
| [11] | Lee J C, Chen M J, Chang C H, et al. Plasma amino acid levels in patients with colorectal cancers and liver cirrhosis with hepatocellular carcinoma. Hepatogastroenterology, 2003, 50(53): 1269-1273. |
| [12] | 吕子全, 郭非凡. 内源性代谢分子——亮氨酸调节机体生理功能. 生理科学进展, 2012, 43(5): 337-340. DOI:10.3969/j.issn.0559-7765.2012.05.005 |



