2. 附属儿童医院胃肠新生儿外科
2. Department of Gastrointestinal Neonatal Surgery, Children’s Hospital of Chongqing Medical University, Chongqing, 400016, China
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,其发病率及病死率均位居恶性肿瘤的前列[1]。流行病学调查提示:HCC是一种与炎症密切相关的恶性肿瘤,炎症在HCC的发生和转移过程中具有促进作用,然而炎症引起HCC的分子和细胞机制尚未完全明确[2]。近年研究发现,肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs) 是肿瘤微环境中浸润的主要细胞,可以对肿瘤的增殖、血管形成以及迁移、侵袭等多种生物学行为产生影响[3]。研究表明miRNAs通过调控免疫相关基因的表达影响免疫系统的发育和功能,进而参与诸如自身免疫性疾病炎症及肿瘤等相关疾病的发生、发展[4]。有关miR-148b的研究提示其在炎症反应中具有重要的作用,其与恶性肿瘤的发病关系近年来引起许多学者的重视[5, 6, 7]。以往研究表明miR-148b与肝癌的发生、发展、预后密切相关[8],但其如何参与巨噬细胞调控肝癌发生的作用及分子机制尚不清楚。本研究通过体外分离培养外周血单核细胞诱导生成M1和M2型巨噬细胞,证实miR-148b调节巨噬细胞分泌的细胞因子参与肝癌细胞生长、侵袭和转移,通过HCC临床组织样本分析巨噬细胞标志物与肝癌患者临床病理特征的关系,旨在为肝癌的发病机制提供新的理论依据。
1 材料与方法 1.1 材料本实验采用的人肝癌细胞株HepG2和Huh7细胞 冻存于液氮中,于37 ℃水浴快速解冻复苏后,1 000×g 离心5 min,分别培养在适宜各自生长的培养基中。肝癌组织和相应癌旁组织标本(40例)由重庆医科大学附属第一医院生物样本库提供。本研究经重庆医科大学附属第一医院伦理学委员会批准。
1.2 巨噬细胞分离和培养采用全自动磁珠提取纯化系统分离外周血单核细胞(peripheral blood mononuclear cells,PBMC),用含10%胎牛血清的RPMI1640培养基调整细胞数为3×106/mL,置于6孔板中培养。37 ℃、5% CO2孵箱培养3 h后,用预温的培养基洗去未黏附细胞,加入含10%胎牛血清的RPMI1640培养基2 mL及粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)和巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF),终浓度为1 000 U/mL。隔2 d半量换液,培养7 d,成贴壁细胞。
1.3 细胞瞬时转染细胞转染按照LipofectamineTM 2000(Invitrogen公司)试剂说明书的要求,分别混匀脂质体、无血清的 培养基和质粒,或miRNA模拟物,或miRNA抑制剂,或各自的阴性对照,培养4~6 h后换为含血清的培养基。miRNA及其对照序列转染的终浓度为50 nmol/L。miR-148b模拟物(miRNA mimics)和阴性对照,miR-148b抑制剂(miRNA inhibitor)和阴性对照,DUSP1-shRNA及阴性对照购自上海 GenePharma 公司。
1.4 实时荧光定量PCR使用TRIzol试剂(Invitrogen公司)提取总RNA。 使用M-MLV逆转录试剂盒(Promega,USA)进行第1链 cDNA的合成,以U6 RNA作为miRNA的内参基因,以β-actin 作为其他内参基因。使用ABI 7500实时荧光定量PCR仪及SYBR Green 试剂(Fermentas,USA)进行基因检测。miR-148b成熟体和U6引物由广州Ribobio 公司合成。CD68基因上游:5′-GCTACATGGCGGTGGAGTACAA-3′,下游:5′-ATGATGAGAGGC-AGCAAGATGG-3′; CD206上游:5′-TTCGGACACCCATC-GGAATTT-3′,下游:5′-CACAAGCGCTGCGTGGAT-3′;β-actin上游:5′-TCCTGTGGCATCCACGAAACT-3′,下游:5′-GAAGCATTTGCGGTGGACGAT-3′。
1.5 双荧光素酶载体构建利用PCR方法,根据DUSP1 (human) 3′-UTR序列信息设计其扩增引物,设计扩增引物如下。DUSP1-3′UTR上游:5′-GCGGCGATCGCAAGGCCACGGGAGG-TGAG-3′,下游:5′-AATGCGGCCGCGAGAGGGATTGG-GTGTGGTTG-3′; DUSP1-mut上游:5′-TGTTTTCACGTGACTTGGAAAATACCAGTGTTG-3′,下游:5′-ATTTTCCAAGTCACGTGAAAACAAACCTGCTTA-3′;以293T基因组DNA为模板PCR扩增DUSP1基因的3′-UTR序列,将其克隆到pmiR-RB-REPORTTM(Ribobio)双荧光素酶报告载体中,所用载体的报告荧光为hRluc,校正荧光为hluc(做内参校正)。
1.6 双荧光素酶检测分析HepG2细胞培养至对数生长期,按4×103/孔接种于96孔板中,每孔总体积100 μL,37 ℃培养箱中培养24 h,采用LipofectamineTM 2000试剂转染,将miRNA mimics、N control 与靶基因3′-UTR报告基因载体及突变载体共转入HepG2细胞,转染终浓度为50 nmol/L,转染48 h后采用Luciferase Reporter Assay System (Promega)检测荧光值。
1.7 Western blot检测蛋白表达提取细胞的总蛋白,BCA蛋白浓度测定试剂盒测定蛋白浓度,Western blot检测按我们前期研究[9]的方法进行,分别用DUSP1 (Santa Cruz Biotechnology,CA)、anti-β-actin(Abcam),经化学发光法检测各蛋白的表达情况。采用Image-Pro Plus分析条带光密度,以目的蛋白与β-actin光密度比值作为蛋白的相对表达量。
1.8 CCK8实验在96孔板中配置100 μL的细胞悬液。将培养板在培养箱预培养24 h(37 ℃,5% CO2),向培养板加入10 μL不同浓度的待测物质,将培养板在培养箱孵育一段适当的时间(6、12、24、48 h),向每孔加入10 μL CCK溶液(注意不要在孔中生成气泡),将培养板在培养箱内孵育1~4 h,用酶标仪测定在波长450 nm处的光密度值[D(450)],若暂时不测定光密度值,可以向每孔中加入10 μL 0.1 mol/L的HCl溶液或者1% SDS溶液,并遮盖培养板避光保存在室温条件下。24 h 内测定,光密度不会发生变化。
1.9 侵袭转移实验所有细胞培养试剂和Transwell小室置37 ℃温育;待测细胞培养至对数生长期,消化细胞,用PBS和无血清培养基先后洗涤1次,用无血清培养基悬浮细胞,计数,调整细胞数为2×105/mL;在下室(即24孔板底部)加入600~800 μL含10%血清的培养基,上室加入100~150 μL细胞悬液,继续在孵箱培养24 h;用镊子小心取出小室,吸干上室液体,移到预先加入约800 μL甲醇的孔中,室温固定30 min;取出小室,吸干上室固定液,移到预先加入约800 μL Giemsa染液的孔中,室温染色15~30 min;轻轻用清水冲洗浸泡数次,取出小室,吸去上室液体,用湿棉棒小心擦去上室底部膜表面上的细胞;用小镊子小心揭下膜,底面朝上晾干,移至载玻片上用中性树胶封片;显微镜下取9个随机视野计数,统计结果。
1.10 统计学处理实验至少重复3次,数据以x±s表示,采用SPSS 16.0统计软件行χ2检验。
2 结果 2.1 M1和M2巨噬细胞的表型鉴定外周血单核细胞经GM-CSF诱导转化为M1型巨噬细胞,细胞体积较大,形态主要为圆形和类圆形;经M-CSF诱导转化为M2 型巨噬细胞,形态主要为扁长型 (图 1)。RT-PCR检测M1巨噬细胞标志物CD68及M2巨噬细胞标志物CD206的表达(P < 0.05),LPS刺激巨噬细胞模拟肿瘤微环境,ELISA检测巨噬细胞分泌的细胞因子CD206,结果显示,LPS可明显增加细胞因子CD206分泌水平,且M2型巨噬细胞分泌的CD206明显高于M1型巨噬细胞。
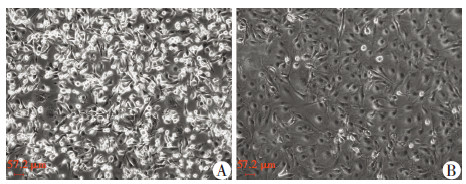 |
| A:M1型; B:M2型 图 1 倒置显微镜观察M1和M2型巨噬细胞形态 |
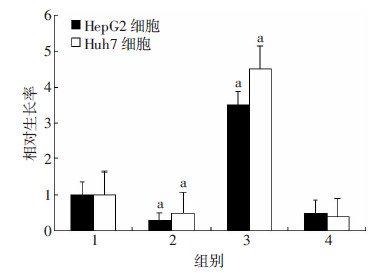
M1和M2型巨噬细胞分别与人肝癌细胞株HepG2细胞和Huh7细胞中共培养48 h,CCK-8实验结果显示,M2型巨噬细胞能明显促进肝癌细胞的生长(P < 0.05,图 2)。为了检测巨噬细胞否对肝癌细 胞的侵袭转移产生影响,Transwell实验发现M2型细胞也可以促进肝癌细胞的侵袭与转移(P < 0.05,图 3)。
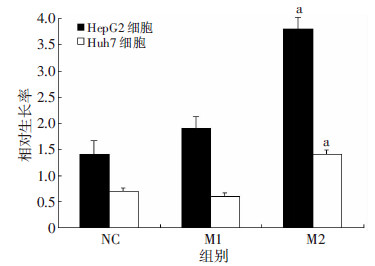 |
| a: P < 0.05,与NC和M1组比较 图 2 CCK-8实验检测与巨噬细胞共培养对HepG2细胞和 Huh7细胞生长的影响 |
 |
| 图 3 Transwell实验检测与巨噬细胞共培养对肝癌细胞侵袭、转移的影响 (×400) |
HepG2细胞分别转染miR-148b mimics、inhibitor以及各自的阴性对照,Western blot检测结果显示,增加增强miR-148b表达可以使DUSP1的蛋白水平发生下调,而抑制miR-148b的表达可以使DUSP1的蛋白水平发生上调,初步证实miR-148b可以调节DUSP1在肝癌的发生发展中产生作用(图 4A、B)。为了进一步证实DUSP1确实是miR-148b的靶基因,通过双荧光素酶报告基因系统检测,结果显示miR-148b确实可以与DUSP1的3′-UTR特异性结合(图 4C、D)。
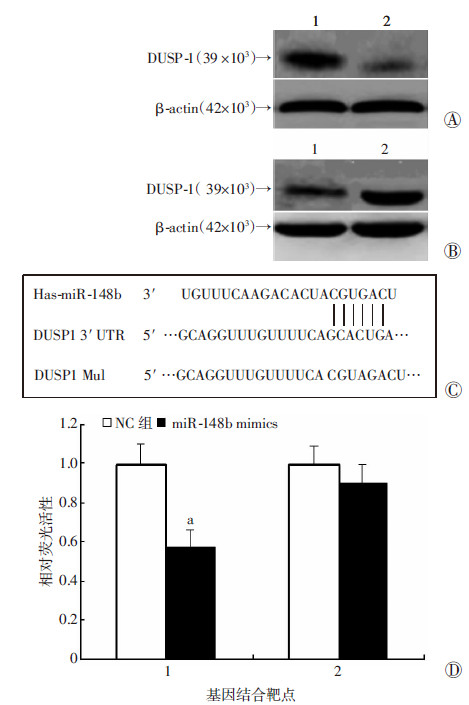 |
| A: Western blot检测转染miR-148b mimics的肝癌细胞 DUSP1的蛋白表达 1:Control dsRNA;2:miR-148b mimics; B: Western blot检测转染miR-148b inhibitor的肝癌细胞DUSP1的蛋白表达 1:Control dsRNA;2:miR-148b inhibitor;C:miR-148b与DUSP1基因3′-UTR预测结合靶点;D:双荧光素酶报告基因系统验证miR-148b与DUSP1基因3′-UTR预测结合靶点 1:DUSP1基因3′-UTR(WT);2:DUSP1基因3′-UTR(MT);a:P < 0.01,与NC组比较 图 4 miR-148b与DUSP1基因3′-UTR结合并调控其表达 |
虽然通过靶向验证确定DUSP1为miR-148b的下游靶基因,为了进一步探讨该信号通路是否在巨噬细胞促进肝癌细胞生长和侵袭转移中发挥作用。首先在M2型巨噬细胞中转染DUSP1-shRNA抑制其表达(图 5),转染miR-148b mimics的M2巨噬细胞经LPS处理后,其分泌的细胞因子CD206的表达水平较对照组明显增加(P < 0.05),而转染miR-148b inhibitor的M2巨噬细胞经LPS处理后,CD206的表达量明显下调 (P < 0.05),共转染miR-148b inhibitor和DUSP1-shRNA后,CD206分泌量上调,初步证实该信号通路可调节细胞因子CD206的分泌;CCK-8实验结果显示,转染miR-148b inhibitor可以抑制肝癌细胞HepG2和Huh7的生长(P < 0.05),而共转染miR-148b inhibitor和DUSP1-shRNA后,分泌量增加的CD206可以促进细胞生长(P < 0.05,图 6); Transwell实验结果显示,转染miR-148b inhibitor的肝癌细胞HepG2和Huh7的侵袭转移能力明显降低(P < 0.05),而共转染miR-148b inhibitor 和DUSP1-shRNA的肝癌侵袭转移能力明显增加(P < 0.05,图 7)。
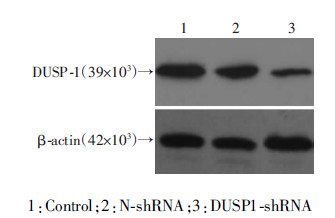 |
| 1:Control;2:N-shRNA;3:DUSP1-shRNA 图 5 M2巨噬细胞中转染DUSP1-shRNA抑制其表达 |
 |
|
1:mock;2:miR-148b inhibitor;3:miR-148b inhibitor+DUSP1-shRNA;4:miR-148b inhibitor+N1-shRNA a: P < 0.05, 与mock比较 图 6 CCK-8实验检测肝癌细胞HepG2和Huh7的生长情况 |
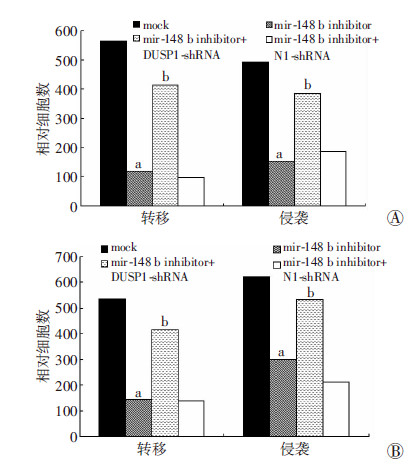 |
| a: P < 0.05, 与mock比较; b: P < 0.05, 与miR-148b inhibitor比较 图 7 Transwell实验检测肝癌细胞HepG2(A)和Huh7(B)的 侵袭转移情况 |
为了研究HCC组织标本中的CD206的表达水平是否临床病理特征存在一定的相关性,检测40例HCC组织标本中CD206 mRNA的表达CD206水平,发现CD206的表达与ALT、AST、肝癌的TNM分期明显相关(P < 0.05,表 1)。
| 临床特征 | 例数( n=40) | 血清CD206浓度 (pg/mL) | P值 | |
| <100 | ≥100 | |||
| 年龄(岁) | ||||
| <40 | 13 | 8 | 5 | 0.890 |
| ≥40 | 27 | 16 | 11 | |
| 性别 | ||||
| 男性 | 14 | 10 | 4 | 0.297 |
| 女性 | 26 | 14 | 12 | |
| AFP(μg/L) | ||||
| <400 | 15 | 10 | 5 | 0.505 |
| ≥400 | 25 | 14 | 11 | |
| ALT(U/L) | ||||
| <40 | 10 | 2 | 8 | 0.003 |
| ≥40 | 30 | 22 | 8 | |
| AST(U/L) | ||||
| <40 | 15 | 9 | 6 | 0.008 |
| ≥40 | 25 | 11 | 14 | |
| TNM 分期 | ||||
| Ⅰ | 17 | 5 | 12 | |
| Ⅱ | 5 | 4 | 1 | 0.036 |
| Ⅲ | 15 | 12 | 3 | |
炎症是导致肿瘤发生或促进肿瘤发展的最主要因素之一,约20%的恶性肿瘤由炎症诱发或促进。炎症与肝癌的发生发展同样有着密切联系[10]。TAMs是炎性细胞的主要成分,通过表达多种细胞因子、生长因子、趋化因子介导免疫反应参与肿瘤发展的多个环节相关,包括肿瘤细胞形成、增殖、浸润、血管生成及转 移[11, 12, 13]。肿瘤相关巨噬细胞与肝癌的不良预后也存在相关性[14],但其与肝癌发生的分子机制仍然不清楚。
异常表达的miR-148b频繁出现在多种肿瘤中,对肿瘤细胞的增殖、血管生成、侵袭转移等病理过程都有着调控作用[15, 16]。Zhang等[17]研究发现肝癌中miR-148b表达显著下调,可将肝癌细胞阻滞于G0/G1期而抑制肿瘤细胞的增殖,miR-148b还可以通过调节WNT1基因的表达来发挥抑制肝癌细胞的侵袭与转移的作用,进一步构建动物模型研究发现,miR-148b 能够在动物体内减慢肿瘤细胞生长。同时,有学者报道肝癌中miR-148b的表达降低与患者的生存期存在相关性[8]。由此可见,miR-148b确实在肝癌的发生过程中起着至关重要的作用。但其在TAMs对肝癌发生的作用及其分子机制尚未完全阐明。
在细胞的炎症反应中,MAPK的激活处于核心地位。DUSP1在细胞内主要催化已活化的MAPK家族成员(p38、JNK、ERK)特异性基序TxY中磷酸基团的水解,抑制其活性,从而减轻炎症反应[18]。DUSP1在多种肿瘤中存在异常的表达,近来的研究表明 DUSP1 在肝癌的发生发展及其预后中有着重要的作用[19]。同时,有学者报道miRNA可以调控巨噬细胞中的DUSP1的表达水平参与肿瘤的发生、发展[20]。
为了探讨在肝癌中是否存在着异常表达的能调控DUSP1的miRNAs参与了TAMs对肝癌的发生过程影响,本研究首先提取外周血单核细胞并诱导生成M1型和M2型巨噬细胞,经LPS处理后的M2型巨噬细胞分泌的细胞因子CD206显著增加,并且 M2型巨噬细胞能够明显促进肝癌细胞的生长和侵袭转移;我们进一步的研究证实,DUSP1是miR-148b的靶基因,转染miR-148b mimics的M2巨噬细胞经LPS处理后,CD206的表达水平明显增加,而转染miR-148b inhibitor的M2型巨噬细胞经LPS处理后,CD206的表达量明显下调,共转染miR-148b inhibitor和DUSP1-shRNA后,CD206分泌量上调;转染miR-148b inhibitor可以抑制肝癌细胞HepG2和Huh7的生长和侵袭转移,而共转染miR-148b inhibitor和DUSP1-shRNA后,分泌量增加的CD206可以促进细胞生长和侵袭转移;同时,CD206的表达与肝癌的TNM分期明显相关。因此,提示在巨噬细胞中miR-148b可以通过靶向调控DUSP1的表达水平参与调控肝癌的发生、发展过程。
总之,本研究发现了miR-148b调节DUSP1影响细胞因子CD206的分泌参与了肝癌的发生过程,初步探讨了miR-148b/DUSP1这一信号通路抑制肝癌细胞生长、侵袭和转移的机制,将可能为肝癌的分子靶向的治疗提供新的治疗策略。
| [1] | Jemal A, Bray F, Center M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. DOI: 10.3322/caac.20107 |
| [2] | Pikarsky E, Porat R M, Stein I, et al. NF-kappaB functions as a tumour promoter in inflammation-associated cancer[J]. Nature, 2004, 431(7007): 461-466. DOI: 10.1038/nature02924 |
| [3] | Solinas G, Germano G, Mantovani A, et al. Tumor-associated macrophages (TAM) as major players of the cancer-related inflammation[J].J Leukoc Biol, 2009, 86(5): 1065-1073.DOI: 10.1189/jlb.0609385 |
| [4] | Okada H, Kohanbash G, Lotze M T. MicroRNAs in immune regulation—opportunities for cancer immunotherapy [J]. Int J Biochem Cell Biol, 2010, 42(8): 1256-1261. DOI: 10.1016/j.biocel.2010.02.002 |
| [5] | Song Y, Xu Y, Wang Z, et al. MicroRNA-148b suppresses cell growth by targeting cholecystokinin-2 receptor in colorectal cancer[J]. Int J Cancer, 2012, 131(5): 1042-1051. DOI: 10.1002/ijc.26485 |
| [6] | Zhao G, Zhang J G, Liu Y, et al. miR-148b functions as a tumor suppressor in pancreatic cancer by targeting AMPKα1[J]. Mol Cancer Ther, 2013, 12(1): 83-93. DOI: 10.1158/1535-7163.MCT-12-0534-T |
| [7] | Wang G, Cao X, Lai S, et al. Altered p53 regulation of miR-148b and p55PIK contributes to tumor progression in colorectal cancer[J]. Oncogene, 2015, 34(7): 912-921. DOI: 10.1038/onc.2014.30 |
| [8] | Zhang Z, Zheng W, Hai J. MicroRNA-148b expression is decreased in hepatocellular carcinoma and associated with prognosis[J]. Med Oncol, 2014, 31(6): 984. |
| [9] | Ding G, Huang G, Liu H D, et al. MiR-199a suppresses the hypoxia-induced proliferation of non-small cell lung cancer cells through targeting HIF1α[J]. Mol Cell Biochem, 2013, 384(1/2): 173-180. DOI: 10.1007/s11010-013-1795-3 |
| [10] | Marx J. Cancer research. Inflammation and cancer: the link grows stronger[J]. Science, 2004, 306(5698): 966-968. DOI: 10.1126/science.306.5698.966 |
| [11] | Xia L, Huang W, Tian D, et al. Forkhead box Q1 promotes hepatocellular carcinoma metastasis by transactivating ZEB2 and VersicanV1 expression[J]. Hepatology, 2014, 59(3): 958- 973. DOI: 10.1002/hep.26735 |
| [12] | Fan Q M, Jing Y Y, Yu G F, et al. Tumor-associated macrophages promote cancer stem cell-like properties via transforming growth factor-beta1-induced epithelial-mesenchymal transition in hepatocellular carcinoma[J]. Cancer Lett, 2014, 352(2): 160-168. DOI: 10.1016/j.canlet.2014.05.008 |
| [13] | Wang S, Zhao E, Kryczek I, et al. Tumor-associated macrophages produce interleukin 6 and signal via STAT3 to promote expansion of human hepatocellular carcinoma stem cells[J]. Gastroenterology, 2014, 147(6): 1393-1404. DOI: 10.1053/j.gastro.2014.08.039 |
| [14] | Shirabe K, Mano Y, Muto J, et al. Role of tumor-associated macrophages in the progression of hepatocellular carcinoma[J]. Surg Today, 2012, 42(1): 1-7. DOI: 10.1007/s00595-011-0058-8 |
| [15] | Chang H, Zhou X, Wang Z N, et al. Increased expression of miR-148b in ovarian carcinoma and its clinical significance[J]. Mol Med Rep, 2012, 5(5): 1277-1280. DOI: 10.3892/mmr.2012.794 |
| [16] | Shen J, Hu Q, Schrauder M, et al. Circulating miR-148b and miR-133a as biomarkers for breast cancer detection[J]. Oncotarget, 2014, 5(14): 5284-5294. |
| [17] | Zhang J G, Shi Y, Hong D F, et al. miR-148b suppresses cell proliferation and invasion in hepatocellular carcinoma by targeting WNT1/β-catenin pathway[J]. Sci Rep, 2015, 5: 8087. DOI: 10.1038/srep08087 |
| [18] | Lei Y Y, Wang W J, Mei J H, et al. Mitogen-activated protein kinase signal transduction in solid tumors[J]. Asian Pac J Cancer Prev, 2014, 15(20): 8539-8548. |
| [19] | Frau M, Feo F, Pascale R M. Pleiotropic effects of methionine adenosyltransferases deregulation as determinants of liver cancer progression and prognosis[J]. J Hepatol, 2013, 59(4): 830-841. |
| [20] | Wang Q, Shi S, He W, et al. Retaining MKP1 expression and attenuating JNK-mediated apoptosis by RIP1 for cisplatin resistance through miR-940 inhibition[J]. Oncotarget, 2014, 5(5): 1304-1314. DOI: 10.7314/APJCP.2014.15.20.8539 |



