2. 400042 重庆,第三军医大学大坪医院野战外科研究所妇产科
2. Department of Obstetrics and Gynecology, Institute of Surgery Research, Daping Hospital, Third Military Medical University, Chongqing, 400042, China
宫颈癌是妇科中最常见的恶性肿瘤,作为威胁女性生命的第二大恶性疾病[1],近年来有年轻化发展的趋势。目前结合化疗与放疗的综合治疗是治疗晚期宫颈癌的常用方法,其中治疗抵抗是影响疗效的关键因素。
盐酸吡柔比星(pirarubicin,THP)是一类蒽环类抗肿瘤药物。因盐酸吡柔比星具有抗肿瘤活性强,副作用低等优点,在临床有良好的应用前景[2]。前期研究表明,盐酸吡柔比星对妇科肿瘤如乳腺癌、卵巢癌、宫颈癌等具有较好的疗效[3, 4]。但研究表明,部分宫颈癌患者对吡柔比星的化疗极不敏感,治疗抵抗是影响盐酸吡柔比星有效杀伤癌细胞的重要因素[5],相关机制值得深入探讨。
细胞自噬是真核生物中进化保守的对细胞内物质进行回收利用的重要过程,细胞内一些损坏的蛋白或细胞器可通过自噬过程进行降解并得以循环利用。近年来研究显示,自噬在肿瘤治疗过程中有不可忽视的作用,肿瘤细胞通过增强自身自噬水平回收利用治疗中受损的蛋白及细胞器等,降低肿瘤对化疗药物的敏感性,从而起到保护肿瘤细胞的效果[6, 7]。研究表明,在膀胱癌细胞中,盐酸吡柔比星诱导癌细胞发生自噬而导致化疗抵抗[8],但盐酸吡柔比星在宫颈癌HeLa细胞中能否增强细胞自噬以及自噬在治疗中的作用尚不清楚。
本研究探讨盐酸吡柔比星对宫颈癌HeLa细胞的杀伤效应、对自噬的诱导作用及可能机制与意义,旨在为增强盐酸吡柔比星对宫颈癌的临床治疗效果提供理论依据。
1 材料与方法 1.1 材料人宫颈癌细胞系HeLa细胞由基础部生物化学与分子生物学教研室保存。胎牛血清和高糖DMEM培养基购自美国HyClone公司;氯喹购自美国Sigma公司;CCK-8试剂盒购自日本Dojindo Laboraories;细胞裂解液RIPA、BCA蛋白定量试剂盒、蛋白酶抑制剂PMSF及Tublin抗体均购自江苏碧云天生物技术公司;ATG4B抗体购自美国Affinity公司,LC3抗体购自美国Sigma公司,山羊抗兔及山羊抗小鼠HRP标记二抗购自北京中杉金桥公司。检测mRNA表达水平用引物由上海英骏生物技术有限公司广州合成部合成,TRIzol裂解液购自北京康为世纪生物科技有限公司,反转录试剂盒M-MLV及SYBR购自宝生物工程(大连)有限公司,转染试剂Lipofectamine2000购自Invitrogen公司,靶向ATG4B的小干扰RNA购自上海吉玛公司。
1.2 方法 1.2.1 细胞培养HeLa 细胞置于含10%胎牛血清的DMEM高糖培养基中,于37 ℃、5% CO2细胞培养箱中培养。
1.2.2 CCK-8实验 1.2.2.1 剂量依赖实验以每孔5×103个细胞接种于96孔板中,设置对照组和实验组(5个浓度梯度),每组设置3个复孔,于37 ℃、5% CO2细胞培养箱中培养过夜后处理细胞。处理方式如下:实验组加入盐酸吡柔比星,浓度分别为50、100、200、400及800 ng/mL,对照组加入等体积PBS,处理24 h后每孔加入10 μL CCK-8试剂,37 ℃避光孵育10 min后使用全波长酶标仪于456 nm处测量每孔的光密度值[D(456)]。
1.2.2.2 盐酸吡柔比星联合氯喹实验以每孔 5×103个细胞接种于96孔板中,设置对照组、盐酸吡柔比星组(100 ng/mL)、盐酸吡柔比星(100 ng/mL)与氯喹联用组(40 μmol/L),每组设置3个复孔,于37 ℃、5% CO2细胞培养箱中培养过夜后,按照上述方式处理 24 h 后,每孔加入10 μL CCK-8试剂,37 ℃避光孵育10 min后使用全波长酶标仪于456 nm处测量每孔的光密度值。
1.2.2.3 盐酸吡柔比星联合ATG4B shRNA实验HeLa细胞接种于96孔板,设置对照组、盐酸吡柔比星组、盐酸吡柔比星与ATG4B干扰联用组,每组设置3个复孔待细胞密度汇合至50%时,转染靶向ATG4B的shRNA(转染用量按照吉玛公司推荐用量)24 h后,加入盐酸吡柔比星100 ng/mL,24 h后,每孔加入10 μL CCK-8试剂,37℃避光孵育10 min后使用全波长酶标仪于456 nm处测量每孔的光密度值。
细胞存活率=(加药孔光密度值-空白孔光密度值)/(对照组光密度值-空白孔光密度值)×100%
1.2.3 台盼蓝染色实验经处理后的细胞按 9 ∶1体积比加入0.4%的台盼蓝染液,混匀后染色3 min。用血细胞计数板在显微镜下分别计数活细胞与死细胞个数,死细胞在镜下成蓝色,而活细胞由于细胞膜通透性完整台盼蓝不能进入细胞中而不能被染成蓝色。
细胞死亡率=死细胞数/(活细胞数+死细胞数)× 100%
1.2.4 细胞中自噬小体的观察6孔板中HeLa细胞汇合至80%时,转染质粒GFP-LC3,转染24 h后,加入浓度分别为0、100、200 ng/mL的盐酸吡柔比星,处理24 h后,于荧光显微镜下采集图像。
1.2.5 Western blot分析HeLa细胞经处理24 h后(处理方法同CCK-8)吸弃培养基,PBS漂洗细胞表面两次,吸净PBS,每孔加入80μL含1 mmol/L PMSF的RIPA裂解液,用细胞刮收集裂解液于1.5 mL EP管中,置于冰上裂解20 min。4 ℃,12 000 r/min,离心10 min,收集上清于新EP管中,并使用BCA法进行蛋白定量及标准化。将定量后蛋白样品以每孔40 μg上样,在12%丙烯酰胺凝胶中进行电泳分离,电泳结束后采用半干转方法将凝胶中蛋白转移至PVDF膜上,用含5%脱脂奶粉的PBST室温封闭1 h,其后用兔多克抗体LC3(1 ∶1 000稀释)、ATG4B(1 ∶1 000稀释)及鼠多克隆抗体Tublin(1 ∶5 000稀释)4℃孵育过夜,次日用PBST洗膜3次、每次10 min后,分别用山羊抗兔二抗(1 ∶10 000稀释)、山羊抗小鼠二抗(1 ∶10 000稀释)室温孵育1 h,PBST洗膜后用化学发光底物法置于化学发光仪中显影曝光。
1.2.6 RNA提取及Real-time PCR检测HeLa细胞经盐酸吡柔比星处理24 h后吸弃培养基,每孔加入1 mL TRIzol 裂解液裂解细胞。经氯仿抽提、异丙醇沉淀、75%乙醇漂洗后提取总RNA,用DEPC水溶解沉淀。采用TaKaRa反转录试剂盒M-MLV反转录为cDNA,作为模板用于Real-time PCR检测ATG4B mRNA表达水平变化。Real-time PCR用试剂盒采用TaKARa公司生产的SYBR,数据分析采用ΔΔCt法分析后作图。
1.3 统计学分析数据以 x±s表示,采用SPSS 13.0 统计软件进行组间t检验。
2 结果 2.1 盐酸吡柔比星对HeLa 细胞的增殖抑制和存活促进具有剂量依赖效应为明确盐酸吡柔比星对HeLa细胞的杀伤作用,本实验采用不同浓度的盐酸吡柔比星作用HeLa细胞24 h后,用CCK-8检测与台盼蓝排斥实验检测盐酸吡柔比星对HeLa 细胞增殖和存活的影响。结果见图 1,与对照组相比,盐酸吡柔比星能够剂量依赖性地抑制 HeLa细胞的增殖并促进HeLa细胞的死亡(P<0.05)。
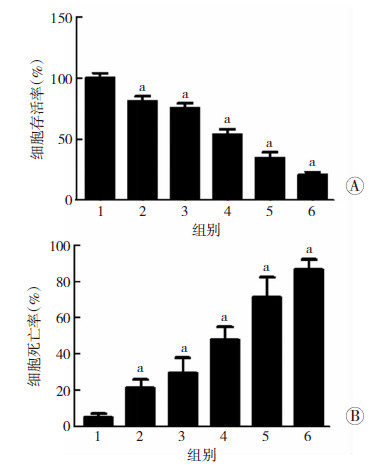 |
| 1:对照组;2~6:50、100、200、400、800 ng/mL盐酸吡柔比星处理组 A:CCK-8测定盐酸吡柔比星对HeLa细胞增殖的抑制作用; B:台盼蓝染色法测定盐酸吡柔比星促进HeLa细胞死亡的效应 a:P<0.05,与第1组比较 图 1 不同浓度盐酸吡柔比星对HeLa细胞增殖和存活的影响 |
为证明盐酸吡柔比星对HeLa细胞中自噬水平的影响,分别用不同浓度的盐酸吡柔比星处理HeLa 细胞24 h后,Western blot 检测发现自噬标志性蛋白Ⅱ型微管相关蛋白轻链3(microtuble-associated protein light chain 3-Ⅱ,LC3-Ⅱ)表达显著上调(图 2),且盐酸吡柔比星对HeLa细胞中自噬水平的上调作用具有一定的剂量依赖效应。在此基础上,用100 ng/mL和200 ng/mL 的盐酸吡柔比星处理转染GFP-LC3的HeLa细胞24 h后,荧光显微镜观察发现细胞中自噬小体数量明显增加(图 3),进一步证明盐酸吡柔比星对HeLa细胞中自噬的增强作用。
 |
| 1:对照组;2~6: 50、100、200、400、800 ng/mL盐酸吡柔比星处理组 图 2 Western blot检测盐酸吡柔比星对HeLa细胞自噬水平的增强作用 |
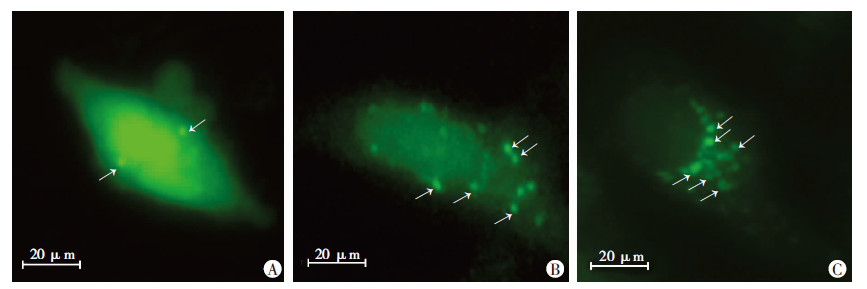 |
| A:对照组;B、C:100、200 ng/mL 吡柔比星组 图 3 盐酸吡柔比星处理后HeLa细胞中GFP-LC3荧光蛋白变化情况 |
为证明自噬在盐酸吡柔比星杀伤HeLa细胞中的作用,本实验使用自噬抑制剂氯喹(chloroquine,CQ)阻断自噬后,采用CCK-8实验及台盼蓝染色实验观察盐酸吡柔比星对细胞存活率及死亡率的影响。结果见图 4,与盐酸吡柔比星单独使用相比,自噬抑制剂CQ和盐酸吡柔比星联用能显著增强盐酸吡柔比星对HeLa细胞的抗增殖效应(P<0.05,图 4A),并明显促进盐酸吡柔比星的杀细胞效应(P<0.05,图 4B)。
 |
| 1:对照组;2:100 ng/mL盐酸吡柔比星处理组;3:100 ng/mL盐酸吡柔比星+40 μmol/L CQ处理组 a: P<0.05,与100 ng/mL盐酸吡柔比星处理组比较; A:CCK-8法测定 盐酸吡柔比星对HeLa细胞增殖的抑制作用; B:台盼蓝染色法测定盐酸吡柔比星促进HeLa细胞死亡的效应 a:P<0.05,与第2组比较 图 5 自噬抑制剂CQ对盐酸吡柔比星抗肿瘤效应的影响 |
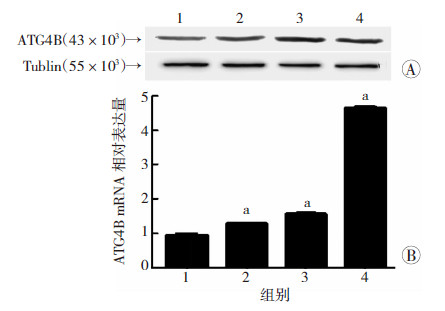
为进一步探讨盐酸吡柔比星增强HeLa细胞中自噬水平的相关机制,本研究分别采用Real-time PCR及Western blot检测了盐酸吡柔比星处理前后HeLa细胞中自噬相关蛋白4B(autophapy related 4B,ATG4B)的表达变化。结果表明,与对照组相比,盐酸吡柔比星可以剂量依赖性增强HeLa细胞中ATG4B的表达水平,体现为ATG4B的mRNA水平(P<0.05,图 5A)及蛋白水平(图 5B)在盐酸吡柔比星处理后均呈剂量依赖性上调。
 |
| 1:对照组;2~4: 50、100、200 ng/mL盐酸吡柔比星处理组;a: P<0.05,与第1组比较 A:Western blot 检测盐酸吡柔比星对HeLa细胞中ATG4B 蛋白水平的影响; B: Real-time PCR检测盐酸吡柔比星对HeLa细胞中ATG4B mRNA水平的影响 图 5 不同浓度盐酸吡柔比星对HeLa细胞ATG4B mRNA及蛋白表达水平的影响 |
为进一步证明ATG4B表达上调在盐酸吡柔比星增强HeLa细胞自噬及杀细胞效应中的作用,本研究使用shRNA下调HeLa细胞中的ATG4B后再用盐酸吡柔比星处理HeLa细胞。结果表明,与shNC组相比,所使用的靶向ATG4B的shRNA可有效抑制HeLa细胞中ATG4B的表达(图 6A);与shNC、THP联用相比,shATG4B、THP联用可显著抑制盐酸吡柔比星对HeLa细胞自噬的增强作用(图 6B),并且显著增强盐酸吡柔比星对HeLa细胞的杀伤效果(P<0.05,图 6C)。
 |
| A: Western blot检测ATG4B干扰效果 1:pGPU6-shNC组;2:pGPU6-shATG4B-1205组;3:pGPU6-shATG4B-2589组; B: Western blot 检测干扰ATG4B对盐酸吡柔比星诱导HeLa细胞自噬水平的影响 1:pGPU6-shNC+THP 0 ng/mL处理组;2:pGPU6-shNC+THP 100 ng/mL处理组; 3:pGPU6-shATG4B-2589+THP 0 ng/mL处理组;4:pGPU6-shATG4B-2589+THP 100 ng/mL处理组;C: CCK-8 检测ATG4B下调对盐酸吡柔比星杀伤HeLa细胞的影响 1:pGPU6-shNC+THP 0 ng/mL处理组;2:pGPU6-shNC+THP100 ng/mL处理组; 3:pGPU6-shATG4B-2589+THP 100 ng/mL处理组 a: P<0.05,与第2组比较 图 6 下调ATG4B抑制盐酸吡柔比星诱导的保护性自噬并增强其杀细胞效应 |
盐酸吡柔比星为1979年半合成的蒽环类抗肿瘤药物,由多柔比星在4′位添加1个四氢吡喃改造而成,在体内代谢和排泄较多柔比星快,在治疗过程中引起的心脏毒性、脱发率等副作用显著低于多柔比星[9]。对膀胱癌、乳腺癌、卵巢癌、宫颈癌等多种实体肿瘤具有良好的治疗效果。前期临床试验表明,90%宫颈癌患者对顺铂与丝裂霉素C、5氟尿嘧啶联用敏感,而顺铂与吡柔比星联用可达到同样效果[10];在HPV18感染的宫颈癌患者治疗过程中,吡柔比星与环磷酰胺联用1个月后,患者外阴未见子宫出血及渗透性肿瘤[11],表明吡柔比星对宫颈癌患者具有良好的治疗效果。但Kato等[5]在吡柔比星对妇科癌症的Ⅱ期临床实验中发现,宫颈癌患者对盐酸吡柔比星的敏感率较低,仅占13.3%,而本研究的实验结果也进一步验证了这一点,即药物剂量为100 ng/mL时,细胞杀伤效果不足25%;药物剂量为200 ng/mL时,细胞杀伤效果仍不足50%,使用剂量为800 ng/mL时细胞杀伤率达到80%,但这一剂量远超过吡柔比星的临床使用剂量(60 mg,血药浓度约170 ng/mL),将引起严重的药物副作用[5]。类似的结果也在宫颈癌的其他细胞系C33A、SiHa中得到验证。因此,增加宫颈癌细胞对低剂量吡柔比星的敏感性是比较符合临床实际的治疗策略。
细胞自噬是真核细胞特有的高度保守的代谢过程,参与细胞内容物的降解和再循环。细胞通过形成双层膜包裹的自噬小体将胞内受损的蛋白质、细胞器等借助溶酶体途径进行降解,从而为处在压力状态下的细胞提供能量供应[12],起到促进细胞存活的作用。因此,细胞自噬已成为化疗过程中肿瘤细胞逃逸的重要机制[13],前期研究表明:紫杉醇可以增强子宫内膜癌细胞的自噬水平,而通过使用自噬抑制剂氯喹或干扰自噬相关分子Beclin1可以增加癌细胞对紫杉醇的敏感性,从而增强紫杉醇的杀细胞效果[14];多柔比星在诱导淋巴瘤Raji细胞凋亡过程中可增强其自噬水平,采用自噬抑制剂3-MA或NH4Cl抑制自噬后可显著增强多柔比星的杀细胞效果[15],而在急性髓细胞性白血病细胞HL-60中,多柔比星激活了包括自噬在内的溶酶体降解途径,导致了HL-60细胞对多柔比星的不敏感[16];在乳腺癌MCF-7细胞中,表柔比星也诱导了一个保护性细胞自噬反应[17];Kong 等[18]研究表明,细胞自噬在卵巢癌对吡柔比星治疗抵抗过程中起到重要作用。上述研究都表明了,无论在治疗敏感的白血病细胞还是在治疗较不敏感的乳腺癌、卵巢癌细胞中,吡柔比星及其前体药物均诱导了保护性细胞自噬反应,同时我们的实验结果也证实,在宫颈癌C33A、SiHa细胞中盐酸吡柔比星也可以诱导保护性细胞自噬反应(未发表),提示自噬是引起肿瘤细胞对吡柔比星抵抗的普遍机制,而联用自噬抑制剂是增敏吡柔比星有效措施。本研究中所采用的自噬抑制剂氯喹(CQ)通过抑制自噬小体与溶酶体的融合[19],一方面可以抑制自噬小体内容物的降解,使处在压力状态下的细胞减少能量来源[20, 21],另一方面清除受损的线粒体,减少ROS的积累从而起到保护细胞的作用[22, 23]。本实验证实了盐酸吡柔比星在杀伤宫颈癌HeLa细胞同时,还明显增强了HeLa细胞的自噬水平,在低浓度下(100 ng/mL)联用自噬抑制剂CQ抑制自噬后,细胞存活率从76%降低至44%,可以明显增强盐酸吡柔比星对宫颈癌HeLa细胞的杀伤效应。
在哺乳动物自噬发生过程中,LC3对自噬小体的形成起到重要作用:细胞中游离的LC3分子经剪切后露出半胱氨酸残基,经泛素化作用后锚定于自噬小泡双层膜,待双层膜延长并完全包裹内容物后,处于自噬小体外膜的LC3又被重新剪切回收,在这一过程中对LC3起剪切作用的分子为半胱氨酸蛋白酶ATG4B(又称自噬蛋白酶-1,autophagin-1) [24]。有研究表明,ATG4B上调可提高细胞内自噬水平,如:ATG4B可被转录因子C/EBPβ转录激活,从而提高小鼠成纤维细胞3T3中的自噬水平,促进脂质生成[25]。化合物BBP通过上调ATG4B提高乳腺癌MCF-7细胞的自噬水平[26]。作为在自噬过程中调节自噬小体形成并维持其数量的关键分子ATG4B,也有报道表明其在肿瘤细胞化疗抵抗过程中发挥了重要的作用: Rothe等[27]研究表明,在慢性粒细胞白血病细胞中ATG4B呈高表达状态,而干扰ATG4B可减弱细胞的自噬水平,增强其对伊马替尼的敏感性;在骨肉瘤细胞中,ATG4B抑制剂NSC185058可抑制细胞自噬,促进细胞死亡[28];Tran等[29]研究表明过表达ATG4B可促进前列腺癌PC-3细胞及C4-2细胞对多柔比星的抵抗效果。上述研究提示,自噬发生过程的关键蛋白ATG4B可能在盐酸吡柔比星诱导的宫颈癌HeLa细胞保护性自噬过程中起到重要作用。本研究通过荧光定量PCR及免疫印迹实验证实,盐酸吡柔比星可剂量依赖性上调ATG4B的表达水平,而干扰ATG4B后,盐酸吡柔比星诱导的自噬水平明显减弱,从而说明ATG4B的表达上调是盐酸吡柔比星诱导细胞自噬反应的重要机制。
综上所述,盐酸吡柔比星可剂量依赖性地抑制宫颈癌HeLa细胞增殖,促进细胞死亡。在此过程中,盐酸吡柔比星通过上调自噬相关分子ATG4B增强HeLa细胞中的自噬水平,而抑制自噬后,细胞死亡率增加。本研究为盐酸吡柔比星更好地应用于宫颈癌的治疗提供了理论与实验依据。
| [1] | Ferlay J, Shin H R, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer, 2010, 127(12): 2893-2917. DOI:10.1002/ijc.25516 |
| [2] | Chauvergne J, Fumoleau P, Cappelaere P, et al. Phase II study of pirarubicin (THP) in patients with cervical, endometrial and ovarian cancer: study of the Clinical Screening Group of the European Organization for Research and Treatment of Cancer (EORTC). Eur J Cancer, 1993, 29A(3): 350-354. |
| [3] | 李席如, 王建东, 张艳君, 等. 多西他赛联合表柔比星/比柔比星新辅助治疗乳腺癌临床分析. 中华医学杂志, 2009, 89(2): 87-90. |
| [4] | Untch M, Sevin B U, Perras J P, et al. Chemosensitivity to the new anthracycline pirarubicin and other chemotherapeutic agents in primary and recurrent ovarian tumors in vitro. Gynecol Oncol, 1992, 47(2): 172-178. |
| [5] | Kato T, Nishimura H, Umezu J, et al. Phase II study of 4′-O-tetrahydropyranyl-adriamycin (THP-ADM) in patients with gynecological cancer. Gan To Kagaku Ryoho, 1985, 12(10): 1962-1967. |
| [6] | Guo X L, Li D, Hu F, et al. Targeting autophagy potentiates chemotherapy-induced apoptosis and proliferation inhibition in hepatocarcinoma cells. Cancer Lett, 2012, 320(2): 171-179. DOI:10.1016/j.canlet.2012.03.002 |
| [7] | Xu Y, Yu H, Qin H, et al. Inhibition of autophagy enhances cisplatin cytotoxicity through endoplasmic reticulum stress in human cervical cancer cells. Cancer Lett, 2012, 314(2): 232-243. DOI:10.1016/j.canlet.2011.09.034 |
| [8] | Li K, Chen X, Liu C, et al. Pirarubicin induces an autophagic cytoprotective response through suppression of the mammalian target of rapamycin signaling pathway in human bladder cancer cells. Biochem Biophys Res Commun, 2015, 460(2): 380-385. DOI:10.1016/j.bbrc.2015.03.042 |
| [9] | Tsukagoshi S. Pirarubicin (THP-adriamycin). Gan To Kagaku Ryoho, 1988, 15(9): 2819-2827. |
| [10] | Kaku S, Takahashi K, Murakami Y, et al. Neoadjuvant intraarterial chemotherapy for stage IIB-IIIB cervical cancer in Japanese women. Exp Ther Med, 2010, 1(4): 651-655. |
| [11] | Guo Y, Song L, Liu H. Cervical clear cell adenocarcinoma infected with human papillomavirus type 18 in an adolescent. J Pediatr Adolesc Gynecol, 2014, 27(1): e1-e3. DOI:10.1016/j.jpag.2013.04.007 |
| [12] | Yang Z, Klionsky D J. Eaten alive: a history of macroautophagy. Nat Cell Biol, 2010, 12(9): 814-822. |
| [13] | Yen C Y, Chiang W F, Liu S Y, et al. Long-term stimulation of areca nut components results in increased chemoresistance through elevated autophagic activity. J Oral Pathol Med, 2014, 43(2): 91-96. DOI:10.1111/jop.12102 |
| [14] | Liu S, Li X. Autophagy inhibition enhances sensitivity of endometrial carcinoma cells to paclitaxel. Int J Oncol, 2015, 46(6): 2399-2408. DOI:10.3892/ijo.2015.2937 |
| [15] | 范佳君, 曾贤, 李玉彬, 等. 细胞自噬在多柔比星诱导淋巴瘤细胞凋亡中的作用. 第二军医大学学报, 2012, 33(6):595-598. DOI:10.3724/SP.J.1008.2012.00595 |
| [16] | Fernandes A, Azevedo M M, Pereira O, et al. Proteolytic systems and AMP-activated protein kinase are critical targets of acute myeloid leukemia therapeutic approaches. Oncotarget, 2015, 6(31): 31428-31440. DOI:10.18632/oncotarget.2947 |
| [17] | Sun W L, Chen J, Wang Y P, et al. Autophagy protects breast cancer cells from epirubicin-induced apoptosis and facilitates epirubicin-resistance development. Autophagy, 2011, 7(9): 1035-1044. |
| [18] | Kong D, Ma S, Liang B, et al. The different regulatory effects of p53 status on multidrug resistance are determined by autophagy in ovarian cancer cells. Biomed Pharmacother, 2012, 66(4): 271-278. DOI:10.1016/j.biopha.2011.12.002 |
| [19] | Cheng P, Ni Z, Dai X, et al. The novel BH-3 mimetic apogossypolone induces Beclin-1- and ROS-mediated autophagy in human hepatocellular carcinoma cells. Cell Death Dis, 2013, 4:e489. |
| [20] | Jiang X, Overholtzer M, Thompson C B. Autophagy in cellular metabolism and cancer. J Clin Invest, 2015, 125(1): 47-54. DOI:10.1172/JCI73942 |
| [21] | Mathew R, Karantza-Wadsworth V, White E. Role of autophagy in cancer. Nat Rev Cancer, 2007, 7(12): 961-967. |
| [22] | Dewaele M, Maes H, Agostinis P. ROS-mediated mechanisms of autophagy stimulation and their relevance in cancer therapy. Autophagy, 2010, 6(7): 838-854. |
| [23] | Ni Z, Wang B, Dai X, et al. HCC cells with high levels of Bcl-2 are resistant to ABT-737 via activation of the ROS-JNK-autophagy pathway. Free Radic Biol Med, 2014, 70: 194-203. DOI:10.1016/j.freeradbiomed.2014.02.012 |
| [24] | Till A, Subramani S. A balancing act for autophagin. J Clin Invest, 2010, 120(7): 2273-2276. DOI:10.1172/JCI43238 |
| [25] | Guo L, Huang J X, Liu Y, et al. Transactivation of Atg4b by C/EBPβ promotes autophagy to facilitate adipogenesis. Mol Cell Biol, 2013, 33(16): 3180-3190. DOI:10.1128/MCB.00193-13 |
| [26] | Li Y, Luo Q, Yuan L, et al. JNK-dependent Atg4 upregulation mediates asperphenamate derivative BBP-induced autophagy in MCF-7 cells. Toxicol Appl Pharmacol, 2012, 263(1): 21-31. DOI:10.1016/j.taap.2012.05.018 |
| [27] | Rothe K, Lin H, Lin K B, et al. The core autophagy protein ATG4B is a potential biomarker and therapeutic target in CML stem/progenitor cells. Blood, 2014, 123(23): 3622-3634. DOI:10.1182/blood-2013-07-516807 |
| [28] | Akin D, Wang S K, Habibzadegah-Tari P, et al. A novel ATG4B antagonist inhibits autophagy and has a negative impact on osteosarcoma tumors. Autophagy, 2014, 10(11): 2021-2035. |
| [29] | Tran E, Chow A, Goda T, et al. Context-dependent role of ATG4B as target for autophagy inhibition in prostate cancer therapy. Biochem Biophys Res Commun, 2013, 441(4): 726-731. DOI:10.1016/j.bbrc.2013.10.117 |



