2.550007 贵阳,贵州省骨科医院检验科;
3.430030 武汉,华中科技大学同济医学院免疫学研究所
2.Department of Clinical Laboratory, Guizhou Provincial Orthopaedic Hospital, Guiyang, Guizhou Province, 550007;
3.Institute of Immunology, Tongji Medical College, Huazhong University of Science and Technology, Wuhan, Hubei Province, 430030, China
肿瘤坏死因子-α(tumor necrosis factor,TNF-α)以两种生物学形式存在,即相对分子质量为17×103的分泌型TNF-α(secreted TNF-α,sTNF-α)和26×103的跨膜型TNF-α(transmebrane TNF-α,tmTNF-α)[1] 。tmTNF-α生物学功能不同于sTNF-α,sTNF-α主要和TNF受体1(TNF receptor 1,TNFR1)结合发挥生物学作用,跨膜型TNF-α既可以结合TNFR1也可以结合TNFR2发挥生物学效应,但主要以结合TNFR2为主[2, 3] 。目前更多的研究注重sTNF-α在肿瘤发生中的作用,而tmTNF-α的作用关注较少[4],文献[5]报道肿瘤微环境中Treg募集增多,但tmTNF-α对Treg免疫功能的影响尚少见报道。本研究观察tmTNF-α/ TNFR2 信号轴对H22荷瘤鼠肿瘤生长影响及tmTNF-α 对Treg免疫抑制功能的影响,旨在为tmTNF-α在肝癌发生中的作用提供实验依据,从而为肿瘤的治疗提供新的靶点。
1 材料与方法 1.1 实验动物与材料 1.1.1 主要仪器CO2细胞培养箱(德国Heraeus),流式细胞分析仪(BD LSR Ⅱ),酶联免疫分析仪(上海科学仪器厂),凝胶图像分析系统(BD公司)。 1.1.2 主要试剂
RPMI1640(Gibco公司),小牛血清(杭州四季青生物工程公司),TGF-β、IL-10试剂盒(Biolegend),FITC-CD4以及PE-CD25荧光抗体(BD公司),肝癌H22细胞株(ATCC)。 1.1.3 实验动物
6~8周龄野生型和TNFR2基因敲除的雄性BALB/c小鼠各10只(由华中科技大学同济医学院李卓娅教授惠赠),体质量约20 g。
1.2 方法 1.2.1 细胞培养肝癌H22细胞悬浮于10%胎牛血清的RPMI1640培养基,同时加入双抗生素(青霉素和链霉素各100 U/mL),置于37 ℃、5 % CO2的培养箱中培养。常规换液和传代,待H22细胞状态最佳时,用1640培养基调整细胞密度1×106/100 μL,在BALB/c小鼠右侧腋皮下接种H22细胞株(每只1×106/100 μL)。 1.2.2 肿瘤直径测量
小鼠接种H22细胞株后每隔3 d测量肿瘤直径,肿瘤体积的计算公式为:V=a×b2,其中a为肿瘤组织的长径(cm),b为肿瘤组织的短径(cm)。
1.2.3 肿瘤组织细胞悬液的制备颈椎脱臼法处死小鼠,取出小鼠的肿瘤组织,称量约0.2 mg,剪碎,加入1~2 mL胶原酶Ⅱ、Ⅳ(0.163 U/mL),透明质酸酶和DNase Ⅰ(2 μg/mL),置于37 ℃水浴箱消化2~3 h,用400目的尼龙膜过滤,1 500 r/min离心10 min后弃去上清,用RPMI1640培养基悬浮,计数。
1.2.4 脾细胞单个核细胞悬液制备颈椎脱臼法处死小鼠,95%酒精浸泡5 min消毒,打开腹腔,取出完整的脾脏,将其浸泡于加有RPMI1640培养基的EP管中。用无菌载玻片在培养皿中碾磨脾脏组织,待研磨好后,用200目的尼龙膜过滤,1 500 r/min离心10 min,弃上清。视细胞密度加入2~3 mL红细胞裂解液,用吸管轻轻地吹打,直至混匀,静置2 min后加入含有10%胎牛血清的RPMI1640培养基5 mL,混匀终止反应,然后用200目尼龙膜过滤,1 500 r/min离心10 min后弃去上清。用1 mL含有10%胎牛血清RPMI1640培养基将脾细胞悬浮,然后加入9 mL 10%胎牛血清RPMI1640培养基混匀,1 500 r/min离心5 min,弃上清,并调细胞密度。
1.2.5 肿瘤组织细胞悬液和脾细胞悬液分选CD4 + CD25 + Treg用小鼠CD4+T 淋巴细胞磁珠分离试剂盒、LD 分离柱、MS分离柱、MidiMAC 分选器,加压洗脱,收集细胞。先阴性选择去除非CD4 +T 淋巴细胞而获得CD4+T淋巴细胞;加入FITC-CD25单克隆抗体,再加入磁珠标记抗FITC 后分选细胞,阳性选择获得CD4 + CD25 + Treg。
1.2.6 流式细胞仪检测Treg调整要检测的肿瘤细胞数为1×106/管,加入FITC-CD4和PE-CD25,用流式细胞仪检测。 1.2.7 tmTNF-α的制备
收集对数生长期的RAW264.7细胞,1 000 r/min 离心5 min,洗涤3次,用无血清的DMEM细胞培养基重悬,加入LPS至终浓度100 ng/mL ,置于37 ℃,5%CO2培养箱温育2 h后,用4%多聚甲醛重悬,固定细胞,室温15 min,用1×PBS洗涤3次,调整细胞数为2×107/mL(RAW264.7 tmTNF-α 表达为40%~50%)。
1.2.8 tmTNF-α刺激Treg细胞取经磁珠分选获得的荷瘤鼠Treg细胞用无血清DMEM细胞培养基调整细胞浓度铺于24孔板,2×106/孔,分别用sTNF-α (终浓度300 ng/mL)和tmTNF-α(效靶比10 ∶1) 刺激,同时设Treg不加刺激剂作为对照。培养16 h后,收集上清,提取Treg细胞全蛋白。 1.2.9 ELISA检测上清IL-10和TGF-β
用tmTNF-α 刺激Treg细胞,收集上清,根据试剂盒说明用双抗体夹心法检测上清中IL-10和TGF-β 的含量
1.2.10 Western blot检测Treg细胞TNFR的表达收集荷瘤小鼠肿瘤微环境中Treg细胞和野生型小鼠脾脏Treg细胞,提取全蛋白后定量,上样量约80 μg蛋白,进行SDS-PAGE,检测Treg细胞TNFR1和TNFR2 的表达。
1.3 统计学的分析采用Graphpad 5统计软件,数据以x±s表示,数据间比较用Student’s t检验。
2 结果 2.1 荷瘤小鼠微环境中Treg 细胞TNFR2的表达变化荷瘤小鼠肿瘤微环境中Treg细胞TNFR2的表达水平明显高于野生型小鼠脾脏Treg细胞,而TNFR1表达水平无明显变化(图 1)。
 |
| 1:野生型鼠;2:荷瘤鼠 图 1 Western blot检测荷瘤小鼠Treg细胞TNFR 蛋白的表达 |
在野生型和TNFR2基因敲除的BALB/c小鼠皮下接种等量的H22肝癌细胞株,肝癌瘤体的体积伴随着接种时间的延长而增加,但在接种21 d后,TNFR2基因敲除鼠体内癌瘤体体积均低于野生型小鼠(P<0.05,图 2)。
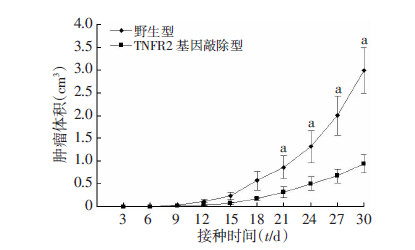 |
| a:P<0.05,与TNFR2基因敲除型比较 图 2 野生型与TNFR2基因敲除鼠皮下肝癌瘤体体积比较 |
TNFR2基因敲除型的BALB/c小鼠在皮下接种H22肝癌细胞株第4、5周,癌组织微环境Treg细胞的数量明显低于野生型小鼠(P<0.01,图 3、4)。
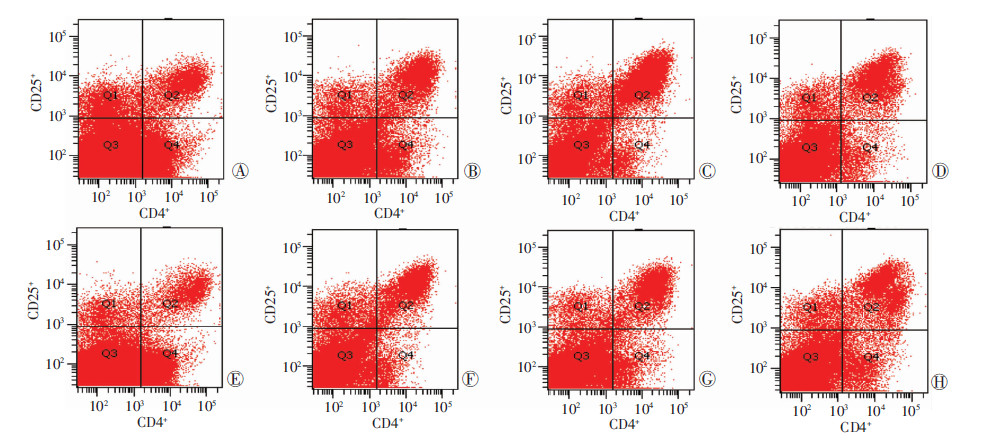 |
| A~D:野生型;E~H:TNFR2基因敲除型;A、E:第2周;B、F:第3周;C、G:第4周;D、H:第5周 图 3 流式细胞仪检测野生型鼠与TNFR2基因敲除型鼠第2、3、4、5周肿瘤组织微环境中Treg细胞数量 |
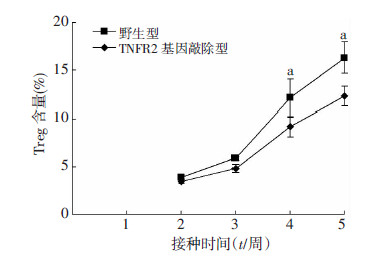 |
| a:P<0.05,与TNFR2基因敲除型比较 图 4 野生型与TNFR2基因敲除型鼠肿瘤组织中Treg的 含量变化趋势 |
tmTNF-α可明显促进Treg细胞分泌IL-10和TGF-β (P<0.01),而sTNF-α仅能刺激Treg分泌TGF-β,对Treg细胞分泌IL-10无影响(P>0.05,图 5)。
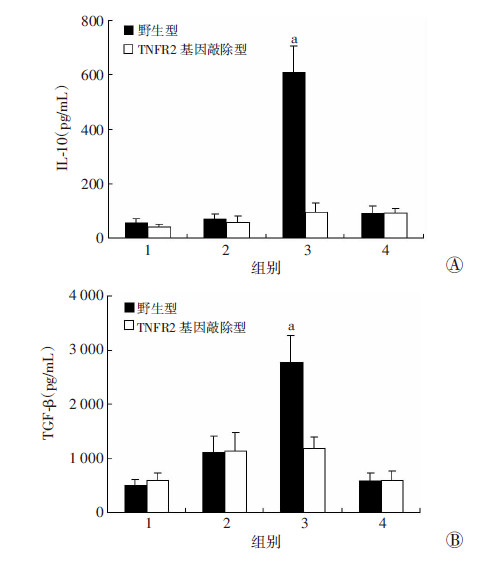 |
| 1:对照组;2:sTNF-α组;3:tmTNF-α组;4:tmTNF-α+抗体组 a:P<0.05,与对照组比较 图 5 ELISA检测tmTNF-α对Treg细胞分泌IL-10(A)和 TGF-β(B)的影响 |
tmTNF-α是分泌型TNF-α的前体,首先表达在细胞膜上,经TNF转化酶水解,释放其胞外段而成为sTNF-α,两型TNF-α均通过TNFR结合发挥效应[5, 6] 。目前认为,sTNF-α主要和TNFR1结合发挥作用,tmTNF-α 既可以结合TNFR1也可以结合TNFR2发挥 生物学效应,但主要以结合TNFR2为主,并且tmTNF-α 生物学效应不同于sTNF-α[7, 8] 。文献[9]报道显示肿瘤特异性T细胞和肿瘤相关巨噬细胞等可组成性表达TNF-α,并且在肿瘤发生、肿瘤增殖、肿瘤血管生成及转移等方面发挥重要作用,普遍认为TNF-α主要发挥的是肿瘤的杀伤作用。但最近的研究发现,TNF-α也可促进肿瘤的生长,文献[11, 12, 13]表明,用TNF-α治疗小鼠胰腺癌原位移植模型,结果却促进了肿瘤的生长和转移,报道发现肿瘤微环境中一定量的TNF-α还能够促进动物胸腔、皮肤和肠道肿瘤的生长和扩散,测定前列腺癌患者和正常人血清中TNF-α水平,发现转移性前列腺癌患者血清中TNF-α的水平明显高于局限性前列腺癌患者。这些研究更加注重sTNF-α在肿瘤发生中的作用,对tmTNF-α关注较少。本研究在BALB/c鼠皮下接种H22肝癌细胞建立的荷瘤鼠模型中发现,肿瘤微环境中Treg细胞TNFR2表达明显高于野生型小鼠脾脏Treg细胞,结果提示tmTNF-α/TNFR2 信号轴介导的生物学效应可能在肿瘤发生中扮演着重要作用。
为了验证tmTNF-α/TNFR2信号轴在肿瘤发生中的作用,我们在TNFR2基因敲除BALB/c鼠皮下接种H22肝癌细胞,同时以在野生BALB/c鼠皮下接种H22肝癌细胞为对照,结果显示TNFR2基因敲除荷瘤鼠肿块体积明显低于野生型小鼠,尤其在接种30 d肿块 体积缩小更为显著。这些结果进一步提示tmTNF-α/ TNFR2信号与肿瘤发生密切相关。目前认为,肿瘤衍生的细胞因子能够诱导多种抑制性细胞,抵抗机体抗肿瘤的天然免疫和适应性免疫,文献[15, 16]结果显示,CD4+CD25+T细胞(Treg)与肿瘤免疫功能密切相关,Treg细胞可以通过不同的机制抑制一系列免疫反应,包括抑制NK细胞的增殖、细胞因子分泌和细胞毒作用,以及对单核/巨噬细胞、树突状细胞、B细胞等免疫活性细胞起抑制或杀伤作用,最终促使肿瘤细胞免疫耐受和逃逸[17, 18] 。本实验结果显示,TNFR2基因敲除荷瘤鼠肿瘤微环境中Treg细胞数量明显低于野生型小鼠,提示tmTNF-α/TNFR2信号轴与肿瘤微环境中Treg含量有关,但是阻断tmTNF-α/TNFR2信号轴后为何会导致肿瘤微环境中Treg减少,从本实验尚得不出结论。为进一步研究可能的机制,本研究还可从阻断tmTNF-α/TNFR2信号轴后是因为Treg细胞募集减少了,还是因为导致Treg细胞凋亡增多等方面来探讨Treg细胞减少的原因。
TNF-α促进肿瘤生长的机制虽不是很清楚,但也有一些相关发现。如在卵巢癌细胞中,TNF-α 上调炎性细胞因子及趋化因子网络、作用于卵巢癌微环境、影响肿瘤血管发展及癌细胞迁移等,从而促进肿瘤的发展及恶化[19] 。目前认为,Treg细胞可以通过释放抑炎 因子IL-10和TGF-β发挥作用[20] 。为了验证tmTNF-α 是否可以直接诱导Treg细胞释放抑炎因子发挥免疫抑制作用,在体外我们用tmTNF-α直接刺激Treg细胞,同时设sTNF-α刺激组作为对照,结果显示,tmTNF-α 可以显著诱导Treg细胞释放抑炎因子IL-10和TGF-β,与sTNF-α作用相比,sTNF-α仅仅诱导释放TGF-β,且作用强度远低于tmTNF-α,但对Treg细胞分泌IL-10无影响。本实验结果说明tmTNF-α可以促进Treg释放IL-10和TGF-β,从而发挥免疫抑制作用。本实验对象仅在TNFR2基因敲除的小鼠上,为了更好地说明tmTNF-α/TNFR2在肿瘤中的作用,可进一步在TNFR1基因敲除和TNFR1R2双基因敲除的小鼠上验证。
综上所述,tmTNF-α/TNFR2信号在H22荷瘤鼠肿瘤发生中扮演着重要作用,阻断tmTNF-α/TNFR2信号后肿瘤局部微环境中的Treg细胞减少,tmTNF-α/TNFR2信号能够导致Treg细胞抑炎因子IL-10和TGF-β释放增多,增强Treg细胞免疫抑制作用。本研究结果提示,用TNF-α拮抗剂治疗肿瘤时,最好选择性地封闭膜分子,而不要干扰可溶性分子。本研究为tmTNF-α在肿瘤发生中的作用提供了实验依据,同时为选择TNF拮抗剂治疗肿瘤提供了新的视野。
| [1] | Zhou W, Yang P, Liu L, et al. Transmembrane tumor necrosis factor-alpha sensitizes adipocytes to insulin[J]. Mol Cell Endocrinol, 2015, 406: 78-86. DOI:10.1016/j.mce.2015.02.023 |
| [2] | Yan X, Jiang Z, Bi L, et al. Salvianolic acid A attenuates TNF-alpha- and D-GalN-induced ER stress-mediated and mitochondrial-dependent apoptosis by modulating Bax/Bcl-2 ratio and calcium release in hepatocyte LO2 cells[J]. Naunyn Schmiedebergs Arch Pharmacol, 2015, 388(8): 817-830. DOI:10.1007/s00210-015-1116-3 |
| [3] | Meusch U, Klingner M, Baerwald C, et al. Deficient spontaneous in vitro apoptosis and increased tmTNF reverse signaling-induced apoptosis of monocytes predict suboptimal therapeutic response of rheumatoid arthritis to TNF inhibition[J]. Arthritis Res Ther, 2013, 15(6): R219. DOI:10.1186/ar4416 |
| [4] | Nishikawa H, Sakaguchi S. Regulatory T cells in cancer immunotherapy[J]. Curr Opin Immunol, 2014, 27: 1-7. |
| [5] | Cao R, Ji H, Yang Y, et al. Collaborative effects between the TNFalpha-TNFR1-macrophage axis and the VEGF-C-VEGFR3 signaling in lymphangiogenesis and metastasis[J]. Oncoimmunology, 2015, 4(3): e989777. DOI:10.4161/2162402X.2014.989777 |
| [6] | Doss G P, Agoramoorthy G, Chakraborty C. TNF/TNFR: drug target for autoimmune diseases and immune-mediated inflammatory diseases[J]. Front Biosci (Landmark Ed), 2014, 19: 1028-1040. |
| [7] | Muller S, Rihs S, Schneider J M, et al. Soluble TNF-alpha but not transmembrane TNF-alpha sensitizes T cells for enhanced activation-induced cell death[J]. Eur J Immunol, 2009, 39(11): 3171-3180. DOI:10.1002/eji.200939554 |
| [8] | Meroni P L, Valentini G, Ayala F, et al. New strategies to address the pharmacodynamics and pharmacokinects of tumor necrosis factor (TNF) inhibitors: a systematic analysis[J]. Autoimmun Rev, 2015, 14(9): 812-829. DOI:10.1016/j.autrev.2015.05.001 |
| [9] | Shin S Y, Lee J M, Lim Y, et al. Transcriptional regulation of the growth-regulated oncogene alpha gene by early growth response protein-1 in response to tumor necrosis factor alpha stimulation[J]. Biochim Biophys Acta, 2013, 1829(10): 1066-1074. |
| [10] | Stathopoulos G T, Kollintza A, Moschos C, et al. Tumor necrosis factor-alpha promotes malignant pleural effusion[J]. Cancer Res, 2007, 67(20): 9825-9834. DOI:10.1158/0008-5472.CAN-07-1064 |
| [11] | Zins K, Abraham D, Sioud M, et al. Colon cancer cell-derived tumor necrosis factor-alpha mediates the tumor growth-promoting response in macrophages by up-regulating the colony-stimulating factor-1 pathway[J]. Cancer Res, 2007, 67(3): 1038-1045. DOI:10.1158/0008-5472.CAN-06-2295 |
| [12] | Scott K A, Moore R J, Arnott C H, et al. An anti-tumor necrosis factor-alpha antibody inhibits the development of experimental skin tumors[J]. Mol Cancer Ther, 2003, 2(5): 445-451. |
| [13] | Huang Y, Ma C, Zhang Q, et al. CD4+ and CD8+ T cells have opposing roles in breast cancer progression and outcome[J]. Oncotarget, 2015, 6(19): 17462-17478. |
| [14] | Guzman-Flores J M, Portales-Perez D P. Mechanisms of suppression of regulatory T-cells (Treg)[J]. Gac Med Mex, 2013, 149(6): 630-638. |
| [15] | Hardardottir I, Olafsdottir E S, Freysdottir J. Dendritic cells matured in the presence of the lycopodium alkaloid annotine direct T cell responses toward a Th2/Treg phenotype[J]. Phytomedicine, 2015, 22(2): 277-282. |
| [16] | Vinay D S, Ryan E P, Pawelec G, et al. Immune evasion in cancer: Mechanistic basis and therapeutic strategies[J]. Semin Cancer Biol, 2015, . DOI:10.1016/j.semcancer.2015.03.004 |
| [17] | Kulbe H, Thompson R, Wilson J L, et al. The inflammatory cytokine tumor necrosis factor-alpha generates an autocrine tumor-promoting network in epithelial ovarian cancer cells[J]. Cancer Res, 2007, 67(2): 585-592. |
| [18] | Roychoudhuri R, Eil R L, Restifo N P. The interplay of effector and regulatory T cells in cancer[J]. Curr Opin Immunol, 2015, 33: 101-111. DOI:10.1016/j.coi.2015.02.003 |



