2.402260 重庆,重庆市江津区中心医院肿瘤科;
3.646000 四川 泸州,四川医科大学附属第一医院肿瘤科
2.Department of Oncology, Jiangjin Central Hospital, Chongqing, 402260;
3.Department of Oncology, First Affiliated Hospital of Sichuan Medical College, Luzhou Sichuan Province, 646000, China
miRNAs是一类微小的、内源性的、非编码的单链RNA,通过翻译抑制或mRNA降解来调节基因表达[1]。已经证实在较多实体肿瘤中一些miRNAs存在异常水平的表达,展示了其在诊断、治疗、预后判断等方面所起到的重要作用[2, 3, 4]。新近研究发现,miRNAs被识别为能参与调控肿瘤治疗及化疗耐受的关键基因[5]。Zhu等[6]证实了miRNA可通过调控MDR1/P-gp介导的药物外排途经参与多药耐药,随后miRNA参与耐药的一些其他可能机制被相继报道,比如细胞周期分布[7, 8]和细胞凋亡[9]的异常调节。Kovalchuk等[10]发现在乳腺癌MCF-7细胞中miR-451参与调节多药耐药基因1(multidrug resistance gene 1,MDR1)的表达,但目前尚少有在结直肠癌中miR-451能否通过MDR1/P-gp途径参与多药耐药的相关研究报道。因此,本研究检测了miR-451及相关耐药蛋白在结直肠癌临床标本、耐药及敏感细胞中的表达差异,并进一步于体外研究miR-451表达水平与MDR1/P-gp途径介导的多药耐药的调控关系,探索miR-451在结直肠癌中对临床治疗的指导意义,为肿瘤化疗敏感性筛选提供有用的指标,以期为临床克服化疗耐药问题提供新的思路及理论依据。
1 材料与方法 1.1 主要试剂结直肠癌亲本及耐药细胞:HCT116,HCT116/L-OHP;LoVo,LoVo/adr 购于上海博谷生物科技公司,RPMI1640培养基购于Gibco公司,胎牛血清购于浙江天杭生物科技公司,Hairpin-it miRNAs RT-PCR定量试剂盒、Custom qRT-PCR、miR-451模拟物(mimics)均购于上海吉玛公司,引物序列由上海生工生物公司合成,Lipofectamine 2000购于Invitrogen公司,MTT试剂盒购于北京康为世纪公司,鼠抗人P-gp单克隆抗体购于Merck公司,二抗羊抗鼠IgG及β-actin购于Sigma公司,Annexin V-FITC/PI双染细胞凋亡检测试剂盒购于美国BD Biosciences公司。
1.2 组织标本及细胞培养68例结直肠癌及癌旁组织均取自于永川医院胃肠外科患者术中,新鲜冻存于-80 ℃待用(临床标本使用经我院医学伦理委员会审查通过,取得患者知情同意)。所有患者术前未接受过放化疗,术后病理均为结直肠腺癌,癌旁组织为距肿瘤边缘5 cm以上切缘组织,病理证实为非癌组织。亲本细胞HCT116、LoVo及耐药细胞 HCT116/L-OHP、LoVo/adr均使用含10%胎牛血清、100 U/mL 青链霉素的RPMI1640培养液,于37 ℃、5% CO2、90%湿度孵箱中培养,细胞贴壁。HCT116/L-OHP细胞培养基中奥沙利铂浓度从5 000 ng/mL 逐步提高至10 000 ng/mL,LoVo/adr细胞培养 基中阿霉素浓度从100 ng/mL逐步提高至200 ng/mL,以维持细胞耐药性。
1.3 定量PCR检测miR-451、MDR1 mRNA表达采用TRIzol试剂提取样本组织、对数期细胞总RNA,凝胶电泳检验总RNA完整性。使用Hairpin-itTM miRNAs RT-PCR Quanitation Kit检测miR-451表达情况,包括逆转录反应和实时荧光定量PCR两部分。 20 μL 逆转录反应体系主要包括:dNTP 0.375 mmol/L,miRNA-RT primers 60 nmol/L,RNA Sample 2 μg等;反应程序:25 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min。染料法定量PCR 20 μL反应体系主要包括:SYBR 10 μL,miRNA特异引物0.2 μmol/L,DNA拓扑聚合酶1U等;反应程序:95 ℃预变性3 min后,进行95 ℃ 12 s、62 ℃ 40 s共40个循环,以U6 snRNA作为内参,扩增反应在Bio-Rad公司CFX 96 Real-time PCR 检测系统中进行。按照Custom gene qRT-PCR Quantitation Kit试剂盒操作步骤检测目的细胞MDR1 mRNA表达。计算相对表达率采用2-△△Ct法(△Ct=Ct miRNA-Ct U6;△△Ct=△Ct样本-△Ct校正样品)。每个样本设3个复孔,复孔间Ct值差异≤0.5,否则重复该样本实验。引物序列如下:miR-451扩增引物正义链:5′-CGTCATCAAACCGTTACCATTAC-3′,反义链:5′-AAA-GGTTGTTCTCCACTCTCTCTC-3′,产物长度67 bp;U6 snRNA正义链:5′-ATTGGAACGATACAGAGAAGATT-3′,反义链:5′-GGAACGCTTCACGAATTTG-3′,产物长度 70 bp;MDR1正义链:5′-CCCATCATTGCAATAGCAGG-3′,反义链:5′-TGTTCAAACTTCTGCTCCTGA-3′,产物长度136 bp。
1.4 细胞转染参照Lipofectamine 2000试剂盒转染说明,2组耐药细胞胰酶消化后以3.5×105/孔分别接种至6孔板上,待其贴壁生长后每孔更换加入1.5 mL无血清培养基,分别取miR-451模拟物(mimics)及NC RNAs各150 pmol与5 μL脂质体Lipofectamine 2000混匀,最后分别转染HCT116/L与LoVo/adr耐药细胞,于37 ℃、5% CO2、90%湿度孵箱中孵育6 h 后,更换含10%胎牛血清培养基继续培养备用。
1.5 Western blot检测P-gp蛋白的表达采用RIPA裂解液裂解结直肠癌组织或目的细胞,BCA法计算样品蛋白浓度。选择8% SDS-PAGE分离样品蛋白60 μg,转膜至硝酸纤维滤膜,于室温摇床封闭2 h后,置于含鼠抗人P-gp单抗(1 ∶200),鼠抗人β-actin单抗(1 ∶300)封闭液中,4 ℃孵育过夜。将膜置于含辣根过氧化物酶偶联的羊抗鼠IgG二抗中(1 ∶5 000),室温摇床孵育2 h后采用ECL Plus发光试剂显色。采用Image Lab软件分析蛋白条带灰度值,以P-gp/β-actin比值反映P-gp蛋白相对表达水平。每组实验重复3次。
1.6 MTT检测转染细胞增殖情况转染miR-451 mimics(模拟物转染组)及NC RNAs(空白转染组)24 h后的各组耐药细胞以8.0×103/孔的密度接种至96孔板中,每孔200 μL终体积。待细胞贴壁后,按照以下药物浓度梯度,L-OHP:0、10、20、40、80、160、320 μg/mL;Adr:0、0.2、0.4、0.8、1.6、3.2、6.4 μg/mL,向转染后的HCT116/L-OHP,LoVo/adr对应加入L-OHP或Adr,每个浓度设3个复孔。加药后于孵箱中培养48 h,再向各孔中加入20 μL MTT(5 mg/mL),避光37 ℃孵育4 h后,加入150 μL二甲基亚砜(DMSO),避光振荡5 min。自动酶标仪于570 nm 波长处读取每孔的光密度值[D(570)]。细胞存活率=实验组D(570)值/空白组D(570)值×100%。根据各浓度点细胞存活率,BLISS法计算半数抑制浓度IC50,得出逆转指数RI=NC转染组细胞IC50值/mimics转染组IC50值。
1.7 FCM检测细胞凋亡情况接受miR-451 mimics、NC RNAs转染后的2组耐药细胞以3.5×105/孔密度接种于6孔板上,培养24 h。将终浓度为80 μg/mL的L-OHP,1.5 μg/mL的Adr(药物浓度依据IC50值,大于模拟物转染组IC50值,小于空白转染组IC50值)分别加入相应细胞孔内。培养48 h后收集细胞,200 μL缓冲液重悬细胞后加入5 μL Annexin V/FITC和10 μL碘化丙啶,避光孵育15 min 后加入300 μL缓冲液待用。使用BD流式细胞仪分类计数。右上象限及右下象限分别代表晚期与早期凋亡细胞。
1.8 统计学方法使用IBM SPSS 19.0统计软件。实验数据以x±s表示,配对四格表资料关联性分析采用χ2检验或连续校正χ2检验,两组数据间比较使用t检验,两组以上数据比较采用单因素方差分析。
2 结果 2.1 miR-451在结直肠癌与癌旁组织,亲本与耐药细胞中的mRNA差异性表达以U6为内参,荧光定量qPCR检测结果显示,miR-451在结直肠癌组织与癌旁组织中相对表达比率(2-△△Ct)分别为 (0.405±0.237)、(0.712±0.174),与癌旁组织相比,miR-451在结直肠癌组织中呈低表达,平均下调43.12%(t=-8.60,P<0.01)。相较于亲本细胞,miR-451在结直肠癌耐药细胞HCT116/L和LoVo/adr中显著低表达:miR-451在HCT116/L中表达水平较HCT116中降低82%,在LoVo/adr中表达水平较LoVo中降低79%(P<0.01,图 1)。
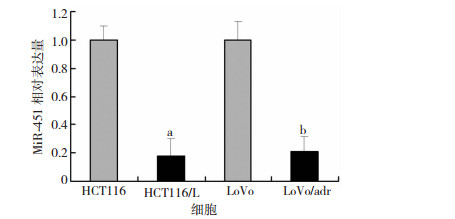 |
| a:P<0.01,与HCT116比较;b: P<0.01,与LoVo比较 图 1 MiR-451在结直肠癌亲本及耐药细胞中的差异表达 |
68例结直肠癌及癌旁组织中,miR-451水平在癌组织中较相对应癌旁组织中降低43.12%以上,即视该例miR-451低表达。统计得出,miR-451低表达与患者性别、年龄、肿瘤分级、淋巴转移或远处转移与否 无统计学差异,但其与临床分期存在相关性(r=-0.285,P=0.029,表 1)。miR-451与P-gp蛋白在68例结直肠癌组织中的表达情况见表 2,统计得出,结直肠癌组织中miR-451低表达与P-gp的阳性表达存在相关性(r=-0.404,P=0.002)。
| 临床特征 | n | miR-451表达水平 | P值 a | ||
| 低表达(例) | 未低表达(例) | ||||
| 性别 | 男 | 38 | 29 | 9 | 0.379 |
| 女 | 30 | 20 | 10 | ||
| 年龄(岁) | ≤57 | 36 | 26 | 10 | 0.975 |
| >57 | 32 | 23 | 9 | ||
| 分级 | G1 | 6 | 2 | 4 | 0.086 |
| G2 | 20 | 15 | 5 | ||
| G3 | 42 | 32 | 10 | ||
| 淋巴转移 | N0 | 8 | 4 | 4 | 0.139 |
| N1 | 60 | 45 | 15 | ||
| 远处转移 | M0 | 46 | 32 | 14 | 0.508 |
| M1 | 22 | 17 | 5 | ||
| 临床分期 | Ⅰ-Ⅱ | 31 | 18 | 13 | 0.029 |
| Ⅲ-Ⅳ | 37 | 31 | 6 | ||
| a:采用行列表方差分析计算P值 | |||||
| (例) | |||
| MiR-451表达情况 | P-gp表达情况 | 合计 | |
| - | ﹢ | ||
| 低表达 | 22 | 27 | 49 |
| 未低表达 | 17 | 2 | 19 |
| 合计 | 39 | 29 | 68 |
| 采用交叉表连续校正方差分析,χ2 =9.374;φ系数=-0.404;Cramer氏系数V=0.404;相关系数r=-0.404, P=0.002 | |||
HCT116/L、LoVo/adr耐药细胞在miR-451 mimics或NC RNAs转染48 h后,实时荧光定量qPCR检测发现,与空白转染组相比,模拟物转染组中两种耐药细胞MDR1 mRNA相对表达水平均下降(图 2A)。在无转染情况下,Western blot检测耐药及亲本细胞中P-gp蛋白的表达(图 2B),在耐药细胞中P-gp高表达,而在亲本细胞中未检测到其表达。耐药细胞转染72 h后,Western blot检测两组细胞P-gp表达见图 2C。在“HCT116/L+mimics”组中P-gp相对表达量为(45±15)%,与空白转染组(85±13)%相比,下降约47% (t=3.85,P=0.018);在“LoVo/adr+mimics”组中P-gp 相对表达量为(51±18)%,与空白转染组(89±7)%相比,下降约43%(t=3.45,P=0.026)。
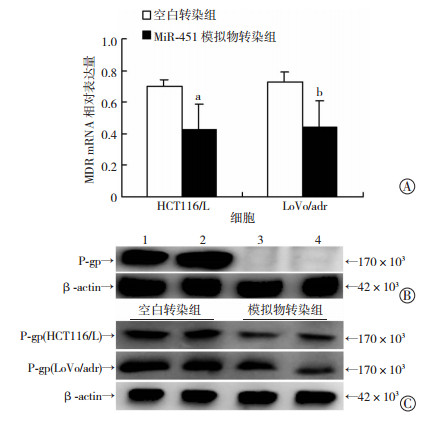 |
| A:MiR-451模拟物及空白转染2组耐药细胞后MDR1的差异表达 a:P=0.048,b:P=0.049,与空白转染组比较;B:P-gp蛋白在耐药与亲本细胞中的表达 1、2:HCT116/L、LoVo/adr; 3、4: HCT116、LoVo;C: 两组耐药细胞转染后P-gp的差异表达 图 2 MiR-451模拟物转染耐药细胞后MDR1与P-gp蛋白的差异性表达 |
MTT检测不同药物浓度时模拟物转染组与空白转染组耐药细胞的存活率,BLISS法得出转染后的半数抑制浓度IC50值。空白转染组L-OHP对HCT116/L的IC50为(138.04±2.21)μg/mL,模拟物转染组为(72.39±1.80)μg/mL (t=39.55,P<0.01);Adr对LoVo/adr的半数抑制浓度在空白转染组及模拟物转染组分别为(2.09±0.14)与(1.36±0.19) (t=5.38,P=0.006)。计算得出逆转指数RI分别为:1.91(138.04/ 72.39)与1.54(2.09/1.36)。同时,HCT116/L、LoVo/adr细胞转染后,分别在L-OHP:80 μg/mL,Adr:1.5 μg/mL 条件下培养48 h后行流式细胞术比较凋亡情况(图 3)。空白转染组及模拟物转染组HCT116/L细胞凋亡率分别为 (38.81±5.27)%、(70.38±7.43)% (t=-6.0,P=0.004);LoVo/adr细胞凋亡率分别为 (40.80±4.49)%,(67.88±5.53)%(t=-6.58,P=0.003)。
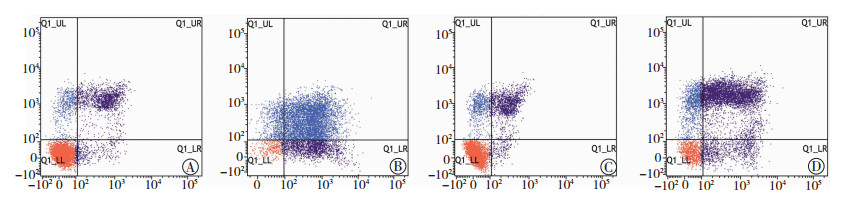 |
| A:HCT116/L空白转染组;B:HCT116/L MiR-451模拟物转染组;C:LoVo/adr空白转染组;D:LoVo/adr MiR-451模拟物转染组;右上象限及右下象限分别代表晚期与早期凋亡细胞 图 3 FCM检测耐药细胞在空白及miR-451模拟物转染后凋亡率变化 |
miR-451的异常表达在结直肠癌细胞的增殖、侵袭等生物学行为方面发挥重要作用[11],但是,其在MDR1/P-gp途径介导的多药耐药中的作用尚未知。因此,本研究从临床结直肠癌组织切入,以探寻在结直肠癌组织中miR-451表达情况与患者临床因素、耐药蛋白表达之间联系,并进一步研究在结直肠癌耐药细胞株中,人为提高miR-451表达水平,观察能否影响MDR1/P-gp表达而逆转耐药。
国外学者Bitarte等[12]在研究结直肠癌干细胞(CSCs)中的miRNA表达谱情况时发现,与亲代细胞相比,克隆细胞系中miR-451表达明显下降。miR-451表达增加能抑制细胞自我更新、肿瘤形成及对伊立替康的化疗耐受,他们识别出COX-2(环氧化酶-2)是miR-451的间接靶点,COX-2使Wnt信号通路活化,而Wnt是CSCs增长至关重要的因素,此外,提高miR-451表达能抑制耐药相关基因ABCB1的表达,进而使伊立替康化疗敏感。在本研究中,首先通过检测68例结直肠癌及癌旁组织中miR-451相对表达水平,证实了miR-451在结直肠癌组织中呈相对低水平表达。Wang等[13]研究发现在实体肿瘤非小细胞肺癌组织中,miR-451出现了下调,杨再林等[14]在慢性髓细胞白血病患者中也检测到了miR-451的下调。通过进一步检测在结直肠癌组织中P-gp是否表达,发现了在miR-451相对表达下降的样本中,更易检测到P-gp的阳性表达,统计得出其相关系数(r=-0.404)。当然,miR-451低表达与P-gp阳性表达相关程度并不是很高(r=-0.404),且检测的组织样本量有限(n=68)。因此,还需进一步更大组织样本量的观察研究,同时也将继续观察该68例患者对化疗的敏感性及总生存期等。
与此同时,检测并证实了在两组结直肠癌耐药细胞株(HCT16/L,LoVo/adr)中,miR-451相对表达水平相对于亲本细胞降低了约80%,这在其他一些实体肿瘤耐药细胞中也有类似的发现[15, 16, 17]。以上在结直肠癌组织及细胞中miR-451表达水平差异的发现,推测miR-451在结直肠癌耐药细胞中可参与到MDR1/P-gp途径介导的多药耐药。在进一步研究中发现,miR-451 mimics转染HCT116/L、LoVo/adr两组耐药细胞以人为提高miR-451水平后,经检测,与NC RNAs转染组相比,其MDR1 mRNA与P-gp蛋白水平明显降低。同时检测比较细胞增殖、凋亡情况发现,转染miR-451 mimics的两组耐药细胞IC50值降低,凋亡率增高,即对化疗药物敏感性增加,达到了部分逆转耐药,逆转指数 RI分别为1.91和1.54。这一研究结果与Kovalchuk[10] 在乳腺癌MCF-7细胞中发现miR-451参与调节MDR1基因一致。由此可证明,miR-451在结直肠癌耐药细胞中,通过负性调控MDR1/P-gp途径影响耐药,当细胞中miR-451水平降低,这种负性调节作用减弱或消失,MDR1/P-gp表达增强,而提高miR-451水平,负性调控增强,MDR1/P-gp表达减弱,肿瘤细胞化疗敏感性增加。
综上所述,本研究证实了在结直肠癌组织中miR-451低表达与临床分期及P-gp阳性表达存在相关性。此外,在结直肠癌耐药细胞中miR-451部分逆转MDR1/P-gp途径介导的多药耐药。提示miR-451对预测患者化疗敏感性及评估预后方面有着重要的意义,其可能成为结直肠癌化疗中新的潜在治疗靶点,以克服多次化疗后出现的耐药问题。当然,导致多药耐药的机制不止MDR1/P-gp途径一种,miRNA与耐药的发生、发展机制尚需进一步研究明确。
| [1] | Bartel D P. Micrornas: genomics, biogenesis, mechanism, and function. Cell, 2004, 116(2): 281-297. |
| [2] | Tricoli J V, Jacobson J W. MicroRNA: Potential for Cancer Detection, Diagnosis, and Prognosis. Cancer Res, 2007, 67(10): 4553-4555. DOI:10.1158/0008-5472.CAN-07-0563 |
| [3] | Blenkiron C, Miska E A. miRNAs in cancer: approaches, aetiology, diagnostics and therapy. Hum Mol Genet, 2007, 16(Spec 1): R106-R113. DOI:10.1093/hmg/ddm056 |
| [4] | 韩超,王健东.非编码微小RNA在胆囊癌中的表达及功能.中华消化外科杂志,2015,14(10):877-880. DOI:10.3760/cma.j.issn.1673-9752.2015.10.021 |
| [5] | Allen K E, Weiss G J. Resistance may not be futile: microRNA biomarkers for chemoresistance and potential therapeutics. Mol Cancer Ther, 2010, 9(12): 3126-3136. DOI:10.1158/1535-7163.MCT-10-0397 |
| [6] | Zhu H, Wu H, Liu X, et al. Role of MicroRNA miR-27a and miR-451 in the regulation of MDR1/P-glycoprotein expression in human cancer cells. Biochem Pharmacol, 2008, 76(5): 582-588. |
| [7] | Yamamura S, Saini S, Majid S, et al. MicroRNA-34a modulates c-Myc transcriptional complexes to suppress malignancy in human prostate cancer cells. PLoS One, 2012, 7(1): e29722. DOI:10.1371/journal.pone.0029722 |
| [8] | Yamanaka S, Campbell N R, An F, et al. Coordinated effects of microRNA-494 induce G2/M arrest in human cholangiocarcinoma. Cell Cycle, 2012, 11(14): 2729- 2738. |
| [9] | Xie Y, Tobin L A, Camps J, et al. MicroRNA-24 regulates XIAP to reduce the apoptosis threshold in cancer cells. Oncogene, 2013, 32(19): 2442-2451. DOI:10.1038/onc.2012.258 |
| [10] | Kovalchuk O, Filkowski J, Meservy J, et al. Involvement of microRNA-451 in resistance of the MCF-7 breast cancer cells to chemotherapeutic drug doxorubicin. Mol Cancer Ther, 2008, 7(7): 2152- 2159. |
| [11] | 吴春蓉, 罗治彬, 陈伟. miR-451对结肠癌细胞系SW620生物学行为的影响. 解放军医学杂志, 2011, 36(5):478-482. |
| [12] | Bitarte N, Bandres E, Boni V, et al. MicroRNA-451 is involved in the self-renewal, tumorigenicity, and chemoresistance of colorectal cancer stem cells. Stem Cells, 2011, 29(11): 1661-1671. DOI:10.1002/stem.741 |
| [13] | Wang X C, Tian L L, Jiang X Y, et al. The expression and function of miRNA-451 in non-small cell lung cancer.Cancer Lett, 2011, 311(2): 203-209. DOI:10.1016/j.canlet.2011.07.026 |
| [14] | 杨再林, 叶枫, 但国蓉, 等. 慢性髓细胞白血病患者骨髓单个核细胞miR-203、miR-451、miR-17表达及其临床意义. 第三军医大学学报, 2014, 36(22): 2296-2300. |
| [15] | Wang R, Wang Z X, Yang J S, et al. MicroRNA-451 functions as a tumor suppressor in human non-small cell lung cancer by targeting ras-related protein 14 (RAB14). Oncogene, 2011, 30(23): 2644-2658. DOI:10.1038/onc.2010.642 |
| [16] | Bandres E, Bitarte N, Arias F, et al. microRNA-451 regulates macrophage migration inhibitory factor production and proliferation of gastrointestinal cancer cells. Clin Cancer Res, 2009, 15(7): 2281-2290. DOI:10.1158/1078-0432.CCR-08-1818 |
| [17] | Nan Y, Han L, Zhang A, et al. MiRNA-451 plays a role as tumor suppressor in human glioma cells. Brain Res, 2010, 1359: 14-21. DOI:10.1016/j.brainres.2010.08.074 |



