心血管疾病是慢性肾脏病(chronic kidney disease,CKD)患者最常见的并发症和首位死亡原因,而血管钙化(vascular calcification,VC) 与CKD患者心血管疾病的发生和发展密切相关[1]。众所周知,高磷血症是血管钙化重要的诱导因素,同时也是CKD患者常见的临床特征之一[2],降低血磷水平可减轻CKD患者血管钙化[3]。然而,高磷如何促进CKD患者血管钙化,其具体机制尚未明确。因此,探索CKD状态下高磷血症诱导血管钙化的发生机制和干预措施显得尤为重要。
已有研究认为高磷可促进CKD患者血管钙化尤其是中膜钙化,而血管平滑肌细胞作为血管中膜最重要的细胞成分,其向成骨细胞分化是血管钙化发生和发展的关键环节[4]。新近研究表明,过氧化物酶体增殖物激活受体γ(peroxisome proliferators activated receptor γ,PPARγ)与细胞钙磷代谢及血管钙化有着密切的关系,并对心血管系统有着重要的保护作用,且其保护作用不通过调节血糖而实现[5],其是否在高磷诱导的血管平滑肌细胞钙化中扮演重要角色尚待阐明。本研究拟明确PPARγ在高磷诱导的血管平滑肌细胞钙化中的关键作用,并进一步观察上调PPARγ表达是否可以抑制高磷诱导的VSMCs钙化。
1 材料与方法 1.1 主要材料与试剂VSMCs细胞株购于美国ATCC细胞库,DMEM高糖培养基、胰酶购自美国HyClone公司;胎牛血清购自浙江天杭生物科技有限公司;罗格列酮(购自美国Sigma公司) 以二甲基亚砜稀释,储备浓度为10 mmol/L,-20 ℃保存,使用时用含血清培养基稀释; PPARγ、SM22α、BMP2、Runx2抗体均购自Abcam公司;β-actin抗体购自北京碧云天生物技术研究所。
1.2 VSMCs细胞培养与分组复苏冻存的VSMCs细胞株,用含10%胎牛血清 的DMEM培养基,置于37 ℃,5% CO2的恒温培养箱中培养,当细胞贴壁融合至80%以上时用0.25%胰酶进行消化和传代。实验先分为两组:①正常对照组(NP):正常培养基;②高磷组(HP):培养基含2.6 mmol/L Na2HPO4/NaH2PO4; 再分为4组,采用罗格列酮作为PPARγ激动剂,观察激动PPARγ对高磷诱导VSMCs钙化的影响:①正常对照组(NP):正常培养基(含10%胎牛血清的DMEM高糖培养基);②高磷组(HP):培养基含 2.6 mmol/L Na2HPO4/NaH2PO4;③罗格 列酮组(RGL):培养基含10 μmol/L罗格列酮(Rosiglitazone);④高磷+罗格列酮组(HP+RGL):培养基含2.6 mmol/L Na2HPO4/NaH2PO4和10 μmol/L罗格列酮。
1.3 细胞爬片茜素红S染色及钙含量测定细胞爬片的制备及染色:①细胞爬片用玻片的处理:将盖玻片清洗干净并在冰醋酸中浸泡12 h后取出,用自来水冲洗干净,再用双蒸水冲洗3遍,将盖玻片擦拭干净后,放入75%酒精2 h后于紫外灯下自然晾干待用;②细胞爬片的制备:把玻片置于细胞培养板的孔中,将用胰酶消化收集到的处于对数生长期的VSMCs浓度调到1×105~2×105/mL,用移液器将细胞悬液滴至玻片上,每孔1 mL,放置于CO2培养箱VSMCs中培养24~48 h;③VSMCs茜素红S染色:细胞爬片用预冷的4%多聚甲醛固定15 min,用预冷的 PBS冲洗3遍,1%茜素红S(pH 4.3),室温染色30 min 后,用预冷的PBS漂洗3遍后于倒置显微镜下观察可见钙化灶呈深红色,观察完毕,吸弃PBS,加入含10%氯化十六烷基吡啶溶液溶解固定的钙化灶,于540 nm波长处测定样本吸光度,同时测定1组未加茜素红S的细胞上清吸光度作为空白对照,每个样本重复3次,计算平均值及标准差。
1.4 Western blot检测VSMCs细胞株按1×104~1×105个/mL浓度接种于6孔板中,按上述分组条件培养5 d后收集细胞,加入细胞裂解液在冰上裂解30 min,12 000×g离心15 min收集上清,BCA法进行蛋白定量,加入蛋白上样Loading Buffer后99 ℃变性10 min。 10%的聚丙烯酰胺凝胶按每孔50 μg上样,浓缩胶80 V,分离胶120 V 电泳,湿电转膜仪90V转膜90min。转印好的PVDF膜用5%脱脂奶粉室温封闭1h,分别加入用5%脱脂奶粉稀释的PPARγ(1 ∶400)、SM22α(1 ∶1 000)、Runx2(1 ∶500)、BMP2(1 ∶500)和标准内参β-actin(1 ∶1 000)抗体,4 ℃孵育过夜。一抗孵育后用PBST洗膜15 min× 3次,再加入对应二抗(1 ∶1 000),室温孵育1 h,PBST洗膜后加入ECL化学发光试剂盒,于Bio-Rad ChemiDoc MP 多功能成像系统显影成像。用Image J软件扫描特异性条带及灰度值,用β-actin作为内参,计算两者比值分析蛋白质相对表达量,并进行统计分析。
1.5 统计学分析实验重复3次,数据以 x±s表示,采用SPSS 22.0统计软件,两组间比较用t检验,多组间比较用单因素方差分析。
2 结果 2.1 高磷对VSMCs钙盐沉积的影响在倒置显微镜下观察VSMCs细胞爬片的茜素红S染色情况,对照组的VSMCs细胞未见红色钙化斑(图 1A),而高磷组钙化斑数量显著增加(图 1B),半 定量结果显示高磷组吸光度明显高于对照组[(0.08±0.02) vs (0.19±0.03),P<0.01]。
 |
| A: NP组;B: HP组 图 1 茜素红S染色观察各组VSMCs钙盐沉积情况 (×100) |
Western blot检测结果显示,与对照组相比,高磷组PPARγ[(0.93±0.04) vs (0.58±0.02),P<0.05]及血管平滑肌细胞标志物SM22α[(1.02±0.09) vs (0.77±0.03),P<0.05]表达显著下降(图 2),高磷组成骨细胞标志物BMP2[(0.26±0.02) vs (0.74±0.03),P<0.01]及Runx2[(0.29±0.03) vs (0.91±0.04),P<0.01)]的表达均显著上升(图 2)。表明,高磷可诱导血管平滑肌细胞向成骨细胞分化,同时可使PPARγ的表达明显下调。
 |
| A: Western blot检测结果; B:半定量分析结果 1:PPARγ; 2:SM22α;3:BMP2;4:Runx2 a:P<0.05,与NP组比较;b:P<0.01,与NP组比较 图 2 Western blot检测各组VSMCs相关蛋白表达 |
血管平滑肌细胞爬片茜素红S染色结果显示,与高磷组相比,罗格列酮预孵育可以明显减弱高磷诱导的钙化作用[(0.19±0.02) vs (0.12±0.03),P<0.05](图 3)。
 |
| A:NP组;B:HP组;C:RGL组;D:HP+RGL组 图 3 茜素红S染色观察PPARγ对高磷诱导VSMCs钙盐沉积的影响 (×100) |
Western blot结果显示,与高磷组相比,罗格列酮预孵育可以明显上调 PPARγ[(0.63±0.04) vs (0.85± 0.03),P<0.05]和平滑肌细胞标志物SM22α[(0.69± 0.02) vs (0.99±0.03),P<0.01]的表达,同时可明显下调高磷诱导的VSMCs细胞BMP2[(1.02±0.04) vs (0.48±0.05),P<0.01]和Runx2[(1.00±0.06) vs (0.67±0.03),P<0.01]的表达(图 4)。提示高磷诱导血管平滑肌细胞PPARγ表达明显下调,而罗格列酮预孵育可以显著提高PPARγ表达水平,并在一定程度上通过上调PPARγ抑制VSMCs向成骨细胞分化,从而抑制VSMCs钙化。
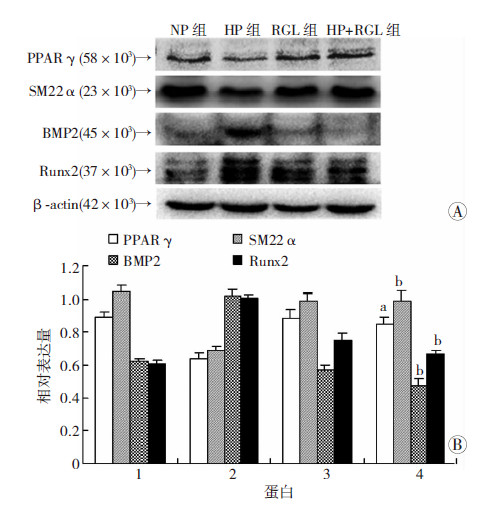 |
| A:Western blot检测结果;B:半定量分析结果 1:PPARγ;2:SM22α;3:BMP2;4:Runx2 a:P<0.05,b:P<0.01,与HP组比较 图 4 Western blot检测各组VSMCs相关蛋白表达 |
在CKD患者中,血管钙化是心血管疾病发生和发展的重要病理基础[1]。CKD患者血管钙化的发生率明显高于普通人群,而中膜钙化是CKD血管钙化的主要特征,随着血管钙化的发生,CKD患者心血管疾病的病死率的显著升高,因此明确CKD血管钙化的发生机制具有重要临床意义。
目前研究表明,高磷血症是CKD患者最常见的临床特征之一,且高磷血症也是血管钙化的重要诱因[2],而降低血磷水平可减轻血管钙化[3]。所以,高磷是促进CKD患者血管钙化发生和发展的关键因素,但其诱导血管钙化的具体机制尚未明确[2]。本研究以小鼠VSMCs为实验对象,证实了VSMCs在高磷的诱导下逐渐失去平滑肌细胞表型,并向成骨细胞表型转化。与此同时,茜素红S染色观察到了血管平滑肌细胞发生了钙化。这与文献[6]报道一致。
PPARγ基因属于核受体超家族成员基因,可以通过其胰岛素敏感的噻唑烷二酮类配体而具有转录调控活性。PPARγ主要在脂肪组织表达,可参与调控胰岛素敏感性、调节葡萄糖代谢、促进脂肪细胞分化和脂肪生成[7, 8]。PPARγ与细胞钙磷代谢及血管钙化有着密切的关系。Abedin等[9]在研究鱼油与血管钙化中发现PPARγ在牛血管中层细胞中可以抑制钙离子向血管平滑肌细胞内流,Gaillard等[10]研究认为,激动PPARγ可以抑制血管中层钙化,而PPARγ缺失会诱导血管平滑肌细胞向成骨细胞分化[11],Yamashita等[12]研究也发现,用PPARγ-siRNA抑制PPARγ表达可以诱导胚胎干细胞向成骨细胞分化。由此看出,PPARγ与细胞钙磷代谢及血管平滑肌细胞的成骨分化有着密切的关联,但其在高磷诱导的血管平滑肌细胞成骨分化和钙化中是否发挥着关键作用有待于深入探讨。我们研究发现高磷诱导VSMCs发生钙化的同时,PPARγ的表达明显降低,说明PPARγ可能在高磷诱导的血管平滑肌细胞成骨分化和钙化中发挥着重要作用。为了进一步明确PPARγ的可能作用,我们采用PPARγ激动剂罗格列酮预孵育后再次观察高磷对血管平滑肌细胞成骨分化和钙化的影响,结果提示罗格列酮预处理的VSMCs其PPARγ表达水平较高磷组有明显升高,罗格列酮预处理可以显著抑制高磷诱导的血管平滑肌细胞向成骨细胞分化和钙化。这提示高磷可通过降低PPARγ表达诱导VSMCs发生钙化,而PPARγ激动可以显著抑制高磷诱导的VSMCs向成骨细胞分化和钙化。
综上所述,本研究验证了高磷可诱导血管平滑肌细胞向成骨细胞分化,并进一步对血管平滑肌细胞钙化的机制进行了探讨,结果发现高磷诱导的PPARγ表达下调可能是VSMCs向成骨细胞分化和钙化的重要机制之一,上调PPARγ虽然能抑制VSMCs向成骨细胞分化,但是其机制尚不清楚,这将是我们今后工作的重要关注点。而PPARγ在CKD血管钙化中是否发挥着关键作用还有待于深入的体内研究加以证实。
| [1] | Roman-Garcia P, Carrillo-Lopez N, Fernandez-Martin J L, et al. High phosphorus diet induces vascular calcification, a related decrease in bone mass and changes in the aortic gene expression. 9.09.Bone, 2010, 46(1): 121-128. DOI:10.1016/j.bone.200006 |
| [2] | Lau W L, Pai A, Moe S M, et al. Direct effects of phosphate on vascular cell function. Adv Chronic Kidney Dis, 2011, 18(2): 105-112. |
| [3] | Yamada S N, Tatsumoto N, Takumoto M, et al. Phosphate binders prevent phosphate-induced cellular senescence of vascular smooth muscle cells and vascular calcification in a modified, adenine-based uremic rat model. Calcif Tissue Int, 2015, 96(4): 347-358. |
| [4] | Lomashvili K A, Cobbs S, Hennigar R A, et al. Phosphate-induced vascular calcification: role of pyrophosphate and osteopontin. J Am Soc Nephrol, 2004, 15(6): 1392-1401. |
| [5] | Sugawara A, Uruno A, Kudo M, et al. Effects of PPARgamma on hypertension, atherosclerosis, and chronic kidney disease. Endocr J, 2010, 57(10): 847-852. |
| [6] | Montes-de-Oca A, Madueno J A, Martinez-Moreno J M, et al. High-phosphate-induced calcification is related to SM22α promoter methylation in vascular smooth muscle cells. J Bone Miner Res, 2010, 25(9): 1996-2005. DOI:10.1002/jbmr.93 |
| [7] | Berger J P, Akiyama T E, Meinke P T. PPARs: therapeutic targets for metabolic disease. Trends Pharmacol Sci, 2005, 26(5): 244-251. DOI:10.1016/j.tips.2005.03.003 |
| [8] | Monsalve F A, Pyarasani R D, Delgado-Lopez F, et al. Peroxisome proliferator-activated receptor targets for the treatment of metabolic diseases. Mediators Inflamm, 2013, 2013: 549627. |
| [9] | Abedin M, Lim J, Tang T B, et al. N-3 fatty acids inhibit vascular calcification via the p38-mitogen-activated protein kinase and peroxisome proliferator-activated receptor-gamma pathways. Circ Res, 2006, 98(6): 727-729. DOI:10.1161/01.RES.0000216009.68958.e6 |
| [10] | Gaillard V, Casellas D, Seguin-Devaux C, et al. Pioglitazone improves aortic wall elasticity in a rat model of elastocalcinotic arteriosclerosis. Hypertension, 2005, 46(2): 372-379. DOI:10.1161/01.HYP.0000171472.24422.33 |
| [11] | Iyemere V P, Proudfoot D, Weissberg P L, et al. Vascular smooth muscle cell phenotypic plasticity and the regulation of vascular calcification. J Intern Med, 2006, 260(3): 192-210. DOI:10.1111/j.1365-2796.2006.01692.x |
| [12] | Yamashita A, Takada T, Nemoto K, et al. Transient suppression of PPARgamma directed ES cells into an osteoblastic lineage. FEBS Lett, 2006, 580(17): 4121-4125. DOI:10.1016/j.febslet.2006.06.057 |



